沙门氏菌ERA 可视化快速检测方法的建立
杨艳歌,王 帅,2,李红娜,李 涛,吴占文,2,孙冬梅,袁 飞*
(1 中国检验检疫科学研究院 国家市场监管重点实验室(食品质量与安全)北京100176 2 黑龙江八一农垦大学生命科学技术学院 黑龙江大庆 163000)
沙门氏菌(Salmonella)是环境中广泛存在的一类食源性致病菌,能够引起人畜食物中毒[1],引起肠道内疾病,表现为急性发热、腹痛、呕吐等症状[2],也可导致败血症、脑膜炎的发生[3]。据报道,全球每年约有9 000 多万例的沙门氏菌感染事件[4]。我国现行的国标GB 29921-2021 《食品安全国家标准 预包装食品中致病菌限量》[5]中明确规定,肉制品、水产制品、即食蛋制品等食品中不得检出沙门氏菌。目前沙门氏菌的检测方法主要有培养法[6]、免疫分析法[7]、PCR 检测法[8]、芯片检测法[9]、质谱分析法[10]、光谱测定法等[11]。其中传统培养法耗时费力,PCR 法、芯片法、质谱光谱法等均需依赖精准控温的仪器、设备和专业的操作,不适合室外环境快速检测。
酶促等温扩增技术(Enzymatic recombinase amplification,ERA)是我国自主研发的一种新型等温扩增技术,诞生时间较晚,其反应原理与RPA技术类似[12-13],都是在37~42 ℃的常温环境下,重组酶与引物DNA 紧密结合的聚合物在模板DNA上搜索到完全匹配的互补序列,然后在单链DNA结合蛋白的帮助下打开DNA 双链结构,最后在DNA 聚合酶的作用下完成扩增产物的指数级扩增。目前关于ERA 技术的研究主要集中在病毒和临床疾病检测等方面。如曾宇晨等[14]建立了非洲猪瘟病毒B646L、EP402R、MGF505/360 基因ERA检测方法,并应用到临床样品的检测。Zhang 等[15]建立了一种检测猪圆环病毒3 型的ERACRISPR/Cas12a 方法。Yang 等[16]建立了一种鉴别猪流行性腹泻病毒PEDV 野生型的ERACRISPER/Cas12a 方法。Liu 等[17]使用ERA 试剂盒结合CRISPR 技术建立一种快速检测癌症细胞耐药基因FLT3-F691L 的方法,40 min 即可获得检测结果。Meng 等[18]基于ERA 试剂盒结合CRISPR技术建立便捷、即时的检测啤酒腐败菌的方法。然而,目前未见该技术在食源性致病菌快速检测中的报道。
本研究将文献报道的沙门氏菌RPA 引物探针应用到ERA 快速检测体系,拟建立荧光法和显色法两种沙门氏菌ERA 可视化高效快速检测方法,旨在为沙门氏菌可视化快速检测提供技术参考。
1 材料与方法
1.1 材料与试剂
鸡胸肉,购于北京某超市。热贴和自热包,购于某电商平台。试验用菌,分别购自美国菌种保藏中心(American Type Culture Collection,ATCC)、中国医学细菌菌种保藏管理中心(National Center for Medical Culture Collections,CMCC)和中国检验检疫微生物菌种保藏管理中心(Inspection and Quarantine Culture Collections,IQCC),详见表1。

表1 试验用菌株信息Table 1 Information about the strains used in this study
脑心浸液肉汤培养基(Brain heart infusion,BHI)、脑心浸液琼脂培养基(Brain heart infusion agar,BHIA),英国Oxoid 公司;PrepManTMUltra样品制备试剂,美国Thermo Fisher 公司;基础型核酸扩增试剂盒(ERA 法)、荧光型核酸扩增试剂盒(ERA 法),苏州先达基因科技有限公司;酚∶氯仿∶异戊醇(体积比为25 ∶24 ∶1)、10000×SYBR Green I,北京索莱宝科技有限公司;中性红、苯酚红、钙黄绿素,天津福晨化学试剂厂;羟基萘酚蓝,山东酷尔化学有限公司。
1.2 设备与仪器
Pico 17 离心机,Thermo Fisher Scientific 公司;掌上离心机,美国SCILOGEX 公司;涡旋混合器,德国IKA 公司;拍击式均质器,法国Interscience 公司;高压灭菌锅,以色列Tuttnauer 公司;DH-420 电热恒温培养箱,美国Memmert 公司;水浴锅,金坛市白塔新宝仪器厂;BioSpec-nano 核酸蛋白分析仪,日本岛津公司;便携式迷你qPCR仪,上海翊辉生物科技有限公司;电泳仪、全自动凝胶成像系统PharosFX,美国伯乐(BIO-RAD)公司。
1.3 方法
1.3.1 引物来源 按参考文献[19]~[22]合成引物及探针序列,所有引物和探针均由英潍捷基(上海)贸易有限公司合成,序列见表2。

表2 引物探针序列信息Table 2 The information of primers and probes
1.3.2 沙门氏菌培养及基因组DNA 提取 将冻干菌粉接种到5 mL BHI 培养基中,置恒温培养箱37 ℃培养20 h。取菌液,平板划线接种至BHIA 培养基中,于37 ℃恒温培养箱培养20 h,挑取单菌落加入5 mL BHI 培养基中培养12 h。取1 mL 菌液置于1.5 mL 离心管中16 000×g 离心2 min,去上清,加入100 μL PrepManTMUltra 样品制备试剂提取液,涡旋振荡混匀,然后100 ℃水浴10 min,16 000×g 离心2 min,取上清液50 μL,即提取的DNA,采用核酸蛋白分析仪测其浓度后-20 ℃保存[23]。
1.3.3 反应体系与检测程序 ERA 荧光法反应体系参照荧光型核酸扩增试剂盒(ERA 法)使用说明书制备预混液,基础型ERA 体系(显色法)参照基础型核酸扩增试剂盒(ERA)说明书制备预混液,模板量均为1 μL。预混液混匀后取48 μL 转移至ERA 酶粉反应管,向管盖滴加2 μL 激活剂,盖紧后涡旋瞬时离心,ERA 荧光反应体系放入便携式迷你qPCR 仪。设置反应程序为:39 ℃反应1 s;39℃反应14 s,40 个循环。在第二反应阶段收集FAM 荧光信号,检测阈值设为自动。ERA 显色法反应程序设置为:39 ℃扩增15 min。反应结束,取25 μL 扩增产物加入等体积的酚∶氯仿∶异戊醇(25 ∶24∶1),振荡混匀后充分离心,上清用2%琼脂糖凝胶电泳检测。其余扩增产物用于后续显色法试验。
1.3.4 引物探针筛选 以表1 中5 株沙门氏菌为模板,采用表2 中编号1、2、4 的3 套引物探针进行ERA 荧光法检测,采用表2 中的4 组引物(编号1,2,3,4)进行基础型ERA 检测,比较扩增效果。对扩增效率较好的引物和探针进行特异性分析。以肠炎沙门氏菌为检测对象,以表1 中编号6~17 的12 种菌为特异性分析的阴性对照菌株。通过上述试验,筛选扩增效率高、特异性好的引物探针组合进行后续试验。所有DNA 样品质量浓度统一为10 ng/μL,以无菌ddH2O 为阴性对照,做3次重复试验。
1.3.5 显色法的建立 为满足基础型ERA 快速的需求,需建立一种现场可视化分析方法以取代电泳法。分别配制100 μmol/L 的中性红、羟基萘酚蓝、苯酚红、钙黄绿素,以及1000× SYBR Green I溶液。ERA 反应后,分别向管中添加1,1.5,2.5,2.5 μL 和3.5 μL 上述显色液,选择能明显区分阳性和阴性结果的显色剂和剂量。所有DNA 样品质量浓度统一为10 ng/μL,以无菌ddH2O 为阴性对照,做3 次重复试验。
1.3.6 ERA 检测方法反应程序优化 为建立可视化ERA 快速检测方法,对ERA 检测程序进行优化。
1)ERA 荧光法反应程序优化 将1.3.3 节ERA 荧光法反应程序中的循环数分别缩短为35,30,25 和20,以肠炎沙门氏菌ATCC10708 的DNA(10 ng/μL)为模板,采用1.3.4 节筛选的最佳引物探针组合进行ERA 反应,比较扩增结果并确定荧光型ERA 快速反应程序。试验过程中以无菌ddH2O 为空白对照。每个反应设置2 个平行,做重复试验2 次(n=4)。
2)ERA 显色法反应程序优化 将1.3.3 节基础型ERA 反应程序的扩增时间分别缩短到12,10,8,6 min 和4 min,以肠炎 沙门氏 菌ATCC10708 的DNA(10 ng/μL)为模板,以1.3.4 节筛选的最佳引物组合进行ERA 反应,比较扩增结果并确定ERA 显色法快速反应程序。以无菌ddH2O 为空白对照,做3 次重复试验。
1.3.7 不依赖仪器的ERA 显色法的建立 为满足现场检测的需求,对DNA 提取和ERA 检测中需要依赖传统实验室设备的步骤进行改良。以肠炎沙门氏菌ATCC10708 为研究对象,采用自热盒加热的方法代替传统水浴锅进行DNA 提取,同时用温度计监测沸腾时的温度和维持时间。采用核酸蛋白分析仪测定DNA 浓度和纯度。使用热帖加热的方式代替PCR 仪或等温扩增仪进行ERA 检测,同时用温度计监测热帖达到ERA 反应最适温度的时间,采用显色法进行结果分析,电泳法验证检测效果。以上试验均重复3 次。
1.3.8 ERA 可视化快速检测方法灵敏度分析 为分析建立的ERA 可视化快速检测方法的灵敏度,将肠炎沙门氏菌ATCC10708 的DNA 稀释至102,101,100,10-1,10-2ng/μL,采用1.3.6 节确定的快速反应程序进行荧光法和显色法ERA 反应,分析两种ERA 快速可视化方法的检测灵敏度。以无菌ddH2O 为空白对照,做3 次重复试验。
1.3.9 ERA 可视化快速检测法对人工污染样品的检出限分析 以鸡肉为基质,按GB 4789.4-2016[24]方法制备人工污染沙门氏菌的样品。向均质液中添加1 mL 浓度为103,102,101,100CFU/mL 的肠炎沙门氏菌ATCC10708 培养液,37 ℃增菌培养0,2,4 h 后,按1.3.7 节步骤提取DNA。分析人工污染样品的检出限。以无菌ddH2O 为空白对照,做3次重复试验。
2 结果
2.1 ERA 荧光法的建立
2.1.1 ERA 荧光法检测引物探针的筛选结果 采用表2 中3 组引物探针(编号1#、2#和4#)进行ERA 扩增效果分析,发现1#引物探针不仅能同时扩增5 种沙门氏菌,而且扩增效率比2#和4#的效果好(图1a~1c)。为进一步分析该引物探针组合在ERA 荧光法反应体系中的特异性,以肠炎沙门氏菌ATCC10708 为检测对象,对食品中常见的食源性致病菌,如枯草芽孢杆菌、金黄色葡萄球菌等12 种阴性对照菌,使用1#引物探针进行ERA 特异性分析。结果显示,1#引物探针仅能特异性扩增肠炎沙门氏菌ATCC10708,枯草芽孢杆菌、金黄色葡萄球菌等12 种非沙门氏菌的食源性致病菌均未扩增(图1d),表明该引物探针在ERA 反应体系中对沙门氏菌特异,可用于ERA 荧光法快速检测体系的建立。
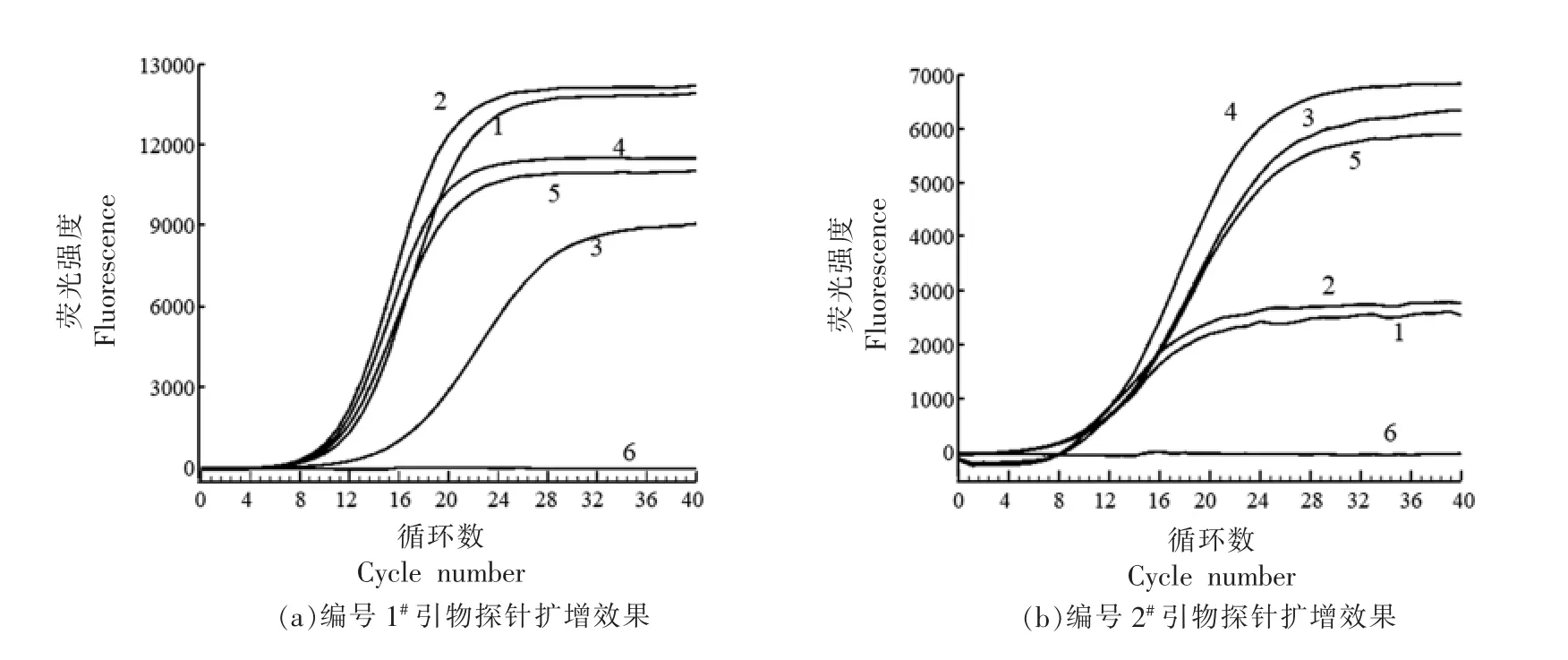
图1 沙门氏菌引物探针筛选结果Fig.1 Results of Salmonella primer probe screening
2.1.2 ERA 荧光法快速反应程序的建立 为缩短检测时间,以肠炎沙门氏菌ATCC10708 为模板,依托便携式迷你qPCR 仪,对ERA 荧光法的检测程序进行优化。扩增结果显示,当扩增循环数设为40 时,ERA 结果的重复性最好,扩增效率最高,此时检测时间为17 min(图2a)。随着反应时间的缩短,ERA 结果重复性虽有所降低,但起峰时间和荧光值变化不大,扩增效率仍较好(图2b~2d)。当扩增循环数降到20 时,反应时间虽仅需9 min,但扩增曲线的重复性较差,荧光值也降低较多(图2e),说明该程序对扩增效果有影响。从节约时间的角度考虑,在保证检测效率的情况下,ERA 荧光法快速反应程序设定为:39 ℃反应1 s;39 ℃反应14 s,25 个循环。此时,检测时间仅需11 min。

图2 ERA 荧光法快速反应程序优化Fig.2 Optimization of rapid reaction procedure for ERA fluorescence method
2.1.3 ERA 荧光法检测的灵敏度分析 分析建立的ERA 荧光法对沙门氏菌的检测灵敏度,分别以DNA 质量浓度为102,101,100,10-1,10-2ng/μL的肠炎沙门氏菌ATCC10708 为模板,检测结果见图3。当DNA 质量浓度为10-2ng/μL 时仍被检出,扩增效果良好。最终确定本研究建立的ERA 荧光法检测沙门氏菌的最低灵敏度为10-2ng/μL。
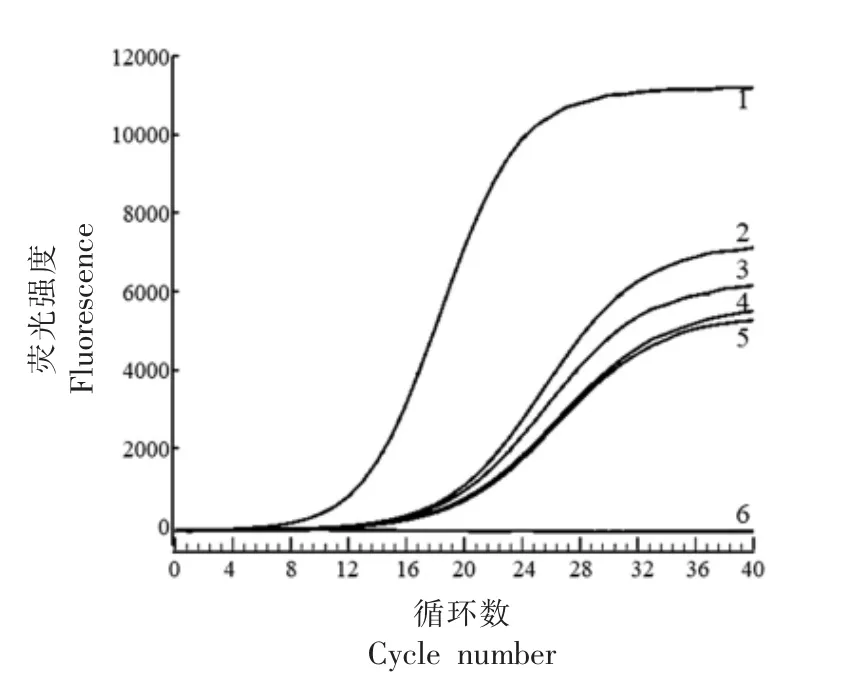
图3 建立的ERA 荧光法的灵敏度分析结果Fig.3 Sensitivity analysis results of fluorescent ERA reaction
2.2 ERA 显色法的建立
2.2.1 基础型ERA 引物筛选 采用表2 中4 组沙门氏菌PRA 引物进行ERA 反应,扩增效果如图4a 所示。1F1R 和3F3R 的扩增效果较好。对这两组引物的特异性以及对5 种沙门氏菌的覆盖性进行分析,结果显示:1F1R 对5 种鼠伤寒沙门氏菌的扩增效果较好,且其它12 种非沙门氏菌的食源性致病菌均无扩增。引物3F3R 虽也对沙门氏菌特异,但对鼠伤寒沙门氏菌ATCC14028 的扩增效果较差(图4b)。后续试验以1F1R 为沙门氏菌基础型ERA 检测的引物。

图4 沙门氏菌基础型ERA 引物筛选Fig.4 Primers screening of basic ERA method for Salmonella
2.2.2 显色剂的筛选 对基础型ERA 检测结果的传统分析需采用电泳检测和凝胶呈像。为满足现场检测的要求,本研究欲建立一种现场显色法以取代电泳法。常见的显色剂包括:中性红、羟基萘酚蓝、苯酚红、钙黄绿素和1000×SYBR Green I等。本试验比较基础型ERA 反应后采用上述显色剂的检测效果,结果如图5a 所示。添加中性红、苯酚红酸碱指示剂,以及羟基萘酚蓝、钙黄绿素离子检测剂时无法区分阳性样品和空白对照。若加入核酸染料SYBR Green I,则阳性样品呈绿色,空白对照显橙色,两者形成明显对照,并可通过肉眼观察结果。后续选择1000×SYBR Green I 作为基础型ERA 反应的显色剂。
为分析显色剂添加量对检测结果的区分效果,对1000×SYBR Green I 的添加量进行分析。分别向ERA 反应后的产物中添加1,1.5,2.5,2.5,3.5 μL 的1000×SYBR Green I,颠倒混匀后观察颜色变化,结果如图5b 所示。可以看出,当添加量为1~2.5 μL 时,均能区分阳性结果与空白对照,其中添加量为2 μL 时,区分效果最明显。而当添加量增到3 μL 时,阳性样品与空白的颜色差距不大,基本呈现1000×SYBR Green I 染料的颜色,无法区分二者。最终确定后续ERA 显色法试验1000×SYBR Green I 的添加量为2 μL/25 mL 反应产物。
2.2.3 ERA 显色法快速检测反应程序优化 为缩短ERA 显色法检测的时间,以肠炎沙门氏菌ATCC10708 为模板,对基础型ERA 的扩增程序进行优化,分别用电泳法和显色法观察结果。如图6所示,扩增时间从原始扩增程序的15 min 降到4 min 的过程中均可明显区分阳性结果与空白对照,即ERA 显色法只需4 min 即可进行结果分析。从节约时间的角度,在满足检测要求的情况下,后续基础型快速检测的反应程序设定为:39 ℃等温扩增4 min。

图6 ERA 显色法反应时间优化结果Fig.6 Reaction time optimization results of ERA chromogenic method
2.2.4 不依赖仪器的ERA 显色法的建立 无论是采用煮沸法提取致病菌的DNA,还是ERA 检测都需要加热设备,如水浴锅、PCR 仪或等温扩增仪等。为摆脱现场检测对传统实验室设备的依赖,以自热盒取代水浴锅,提供DNA 提取所需温度环境。结果显示:自热盒1 min 30 s 开始出现气泡(84 ℃,图7a 左),20 min 内保持80~84 ℃。提取的DNA 质量浓度(285.44±2.13)ng/μL 与传统煮沸法(315.65 ± 10.99)ng/μL 差异不大,纯度平均值几乎相同,可满足后续ERA 反应的要求。然后,使用热帖代替PCR 仪或等温扩增仪,以提供现场ERA 反应所需温度。撕开热帖包装5 min 后温度可达37 ℃(图7a 右),即ERA 反应要求的温度下限;20 min 后可达42 ℃,即ERA 反应的上限温度。采用此法进行ERA 快速检测,显色结果如图7b 所示,阳性样品呈现明显的绿色,而空白为橙色,区分效果良好。电泳结果也显示良好的扩增条带,证实建立的不依赖仪器的ERA 显色法可行。

图7 不依赖仪器的ERA 显色法检测结果Fig.7 Results of ERA chromogenic method without instruments
2.2.5 不依赖仪器的ERA 显色法灵敏度分析 为分析上述建立的不依赖仪器的ERA 显色法的检测灵敏度,分别以模板质量浓度为102,101,100,10-1,10-2ng/μL 的肠炎沙门氏菌ATCC10708 进行检测,结果见图8。当模板质量浓度低至10-2ng/μL 时显色仍为绿色,与空白对照区分明显,对应的电泳结果有清晰的目的条带。最终确定建立的不依赖仪器的ERA 显色法对沙门氏菌的检测灵敏度低至10-2ng/μL。

图8 ERA 显色法灵敏度检测结果Fig.8 Sensitivity for Salmonella of ERA chromogenic method
2.3 人工污染试验
对人工污染肠炎沙门氏菌ATCC10708 的污染量分别为103,102,101,100的样品增菌0~4 h,并提取DNA,分析建立的2 种ERA 可视化快速检测方法的实际检出限。结果显示:前增菌2 h,两种方法最低可检出浓度为100 CFU/mL 的沙门氏菌,前增菌4 h 最低可检出1 CFU/mL 的沙门氏菌(表3)。图9 显示增菌4 h 的检测结果。随着污染量的降低,荧光法的扩增效率逐渐降低(图9a)。显色法结果显示试验组均有绿色荧光,与空白对照差别明显,对应的电泳条带亮度逐渐下降。最终确定本研究建立的两种ERA 可视化快速检测方法前增菌4 h 的检出限均为1 CFU/mL。
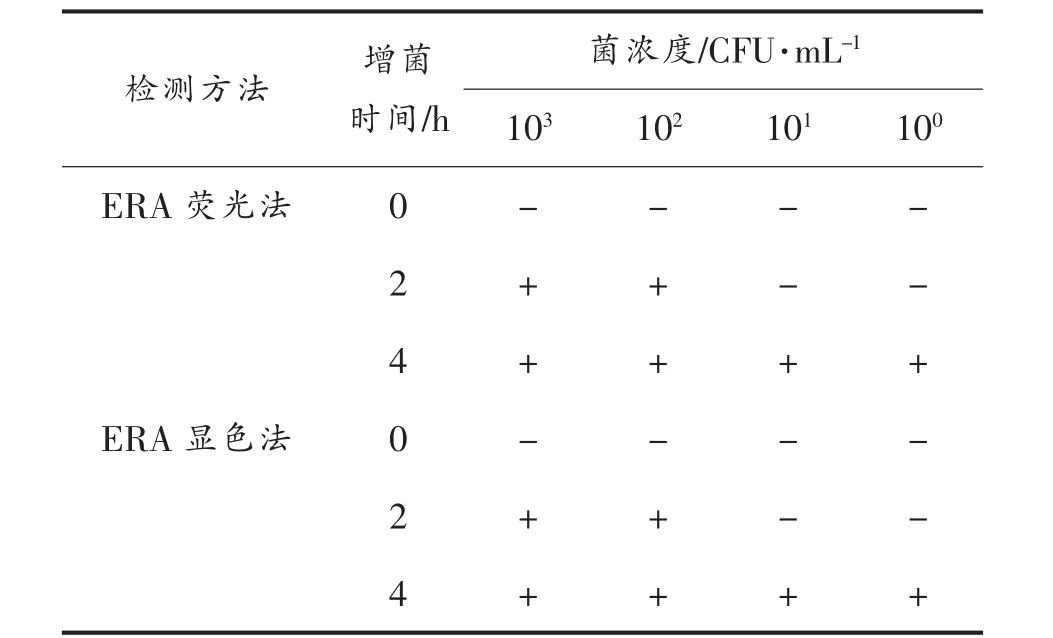
表3 人工污染样品检测结果Table 3 Test results of artificially contaminated samples
3 讨论
在我国,每年都有因食源性致病菌导致的中毒事件发生。目前,食源性致病菌的检测主要采用GB 4789 规定的培养法,检测周期4~6 d,时间长、流程复杂且需经验丰富的检测人员。面对当今生鲜农产品快速流通的现状,这种耗时较长的检测手段无法满足市场快速筛查的需求。近年,已报道许多食源性致病菌快速检测方法。例如,魏莹等[25]根据CepA 基因设计了针对A 族乙型溶血性链球菌的RPA 引物和探针,在39 ℃恒温下,20 min 内可检 出10 copies/μL 的 目的基 因。Yang等[26]综述LAMP 在沙门氏菌检测方面的研究进展,并分析其在食品等领域的应用前景。陈佳平等[27]通过rfbE 基因设计RPA 引物及探针,能够快速、准确区分大肠杆菌O157 血清型与非O157 血清型的菌株。Jiang 等[28]针对副溶血弧菌设计RPA 引物探针,将其应用到生蚝中副溶血弧菌的检测,针对实际样品的检测灵敏度达2 CFU/g。刘立兵等[29]基于RPA 技术建立了一种产气荚膜梭菌的快速检测方法,仅需3~13 min 即可检出人工污染样品中的阳性样品,检出限为1×102CFU/mL。王妙姝等[30]建立了一种通过可视化单引物等温扩增技术检测发酵乳制品中沙门氏菌的方法,对纯培养物的检出限为3.2×101CFU/mL。
ERA 技术诞生时间较晚,目前研究主要集中在病毒和临床疾病检测等方面,在食源性致病菌快速检测方面缺乏报道。本研究创新性地将文献报道的RPA 引物探针应用至ERA 检测体系,首次建立沙门氏菌ERA 可视化快速检测方法,为食源性病原菌的快速检测提供了新思路和新方法。研究过程中,首先依托国产便携式迷你qPCR 仪建立ERA 荧光法,检测时间仅需11 min。该仪器仅A4 纸大小,可携带至现场检测,且具有无运动光学部件,移动运输无需校准维护。目前已集成一个从DNA 提取到ERA 可视化快速检测为一体的便携式快速检测箱,可为口岸、野外等应用场景的现场快速检测提供良好的技术装备。其次,筛选基础型ERA 检测的显色剂,建立ERA 显色法,并且创新性地使用自热包和热帖进行DNA 提取和ERA 反应,集成了不依赖仪器的现场可视化快速检测装备,从而摆脱了对传统设备如水浴锅、PCR仪、等温扩增仪等的依赖,不仅降低了检测成本,而且自热包的升温速度更快,能够显著缩短DNA提取所需时间,从DNA 提取到可视化检测整个流程仅需10 min 左右。本研究建立的沙门氏菌ERA可视化快速检测方法特异性好、灵敏度高、操作简单、成本低廉、不依赖设备,十分适合在现场和基层检测中应用推广,可为我国食品安全监管和口岸食品查验提供技术支持。采用的ERA 检测试剂和集成的便携式现场快速检测装备均为我国自主研发,对打破国外试剂装备垄断,突破国外“卡脖子”技术具有重要的意义。

