抗氧化肽在真空冷冻干燥过程中对乳双歧杆菌Probio-M8 的保护作用
王昊乾,张静雯,杨雄洲,刘青轩,姚国强,孙天松
(内蒙古农业大学 乳品生物技术与工程教育部重点实验室 农业农村部奶制品加工重点实验室 呼和浩特 010018)
双歧杆菌已广泛应用于乳制品、发酵和制药等行业,其作为辅助培养物需在保质期内保持较高的生物活性[1]。干燥脱水能够确保产品的贮藏稳定性,其中真空冷冻干燥是保存双歧杆菌最为常用的方法[2]。然而,由于双歧杆菌属于专性厌氧菌,对氧极为敏感,在加工过程中,氧气可以通过多种方式进入产品并发生氧化应激反应,是导致双歧杆菌活力丧失的主要因素[3-4]。
目前,有关乳酸菌在真空冷冻干燥过程中的研究以优化冻干参数以及开发新型的冻干保护剂为主要研究方向[5-7],而氧化应激对乳酸菌在冷冻干燥过程中的影响鲜有报道。目前,有研究发现低温冷冻伴随着蛋白变性和脂质氧化的产生,并且氧化应激反应的发生不受样品处于玻璃态时具有较低的分子迁移率的限制[8]。双歧杆菌在真空冷冻干燥的预冻过程中,极易受到氧化应激导致的细胞膜脂质氧化[9-10],生成丙二醛等氧化产物,并降低细胞膜流动性,导致细胞膜通透性增加,细胞内容物泄漏,最终致双歧杆菌死亡[11-12]。本试验以乳双歧杆菌Probio-M8 为研究对象,以乳清蛋白水解物分离纯化的前期试验中获得的水解多肽3-2(HP3-2)为天然抗氧化型保护剂,研究其在真空冷冻干燥过程中对菌体的保护作用,为乳酸菌冷冻干燥保藏技术提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
乳双歧杆菌Probio-M8,由内蒙古自治区农业微生物种质资源库提供;Syto9、碘化丙啶(PI)、丙酮(色谱纯)、甲醇(色谱纯)、正己烷(色谱纯),赛默飞世尔公司;2,7-二氯荧光素二乙酸酯(DCFHDA)荧光染料、2',7'-二-(2-羧乙基)-5(6)-羧基荧光素乙酰甲酯(BCECF-AM)、6-十二酰基-N,N-二甲基-2-萘胺(Laurdan),大连美伦生物技术有限公司;丙二醛试剂盒,南京建成有限公司。
1.2 仪器与设备
M2 多功能酶标仪,美国美谷分子公司;DRC-1000 真空冷冻干燥机,日本东京理化公司;CytoFLEX 流式细胞仪,美国贝克曼库尔特公司;pH 计(FE28),梅特勒-托利多仪器上海有限公司;7890B-5977A 气相色谱-质谱联用仪(GC-MS),美国安捷伦公司;平行生物反应器,上海顾信生物科技有限公司;M900 生化分析仪,深圳希尔曼科技有限公司;HWS28 型水浴锅,上海一恒科技有限公司。
1.3 试验方法
1.3.1 菌种活化与培养 将保存于冻存管(-80℃保藏)中的乳双歧杆菌Probio-M8 于MRS(加入0.05%的L-半胱氨酸盐酸盐)培养基中活化,37℃厌氧培养24 h,然后重复上述步骤再活化2 代后获得种子液,以5%的接种量接种于3 L 平行生物反应器中,培养温度通过自动控制系统保持在(37±0.2)℃,氮气保压(0.02 Pa),转速200 r/min,通过自动流加25%的氨水使pH 值维持在5.9。
1.3.2 菌种的冻干前处理及抗氧化肽的制备 本试验中使用的抗氧化肽HP3-2 为之前试验所获得的产物,其氨基酸序列为AGPPGPTGPAGP PGFPGAV、GETGPAGPPGAPGAPGAPGPVGPAG、GKDGLNGLPGPIGPPGPRG、GPSGPQGPSGPPGPK、TGAAGPPGPTGPAGPPGFPGAVGA,分子质量在1 500~2 000 u,具体分离纯化方法如下:使用碱性蛋白酶于pH 10.0,50 ℃水解乳清蛋白(酶底比为5%),水解2 h 后,灭酶,于4 000×g,离心15 min,将所获得的乳清蛋白水解物上清液进行超滤分离,获得小于3 ku 的样品,经阳离子交换层析以及高效液相色谱分离纯化后,将获得的水解多肽3-2 作为冻干保护剂,以乳清蛋白作为对照组。
将发酵后的乳双歧杆菌Probio-M8 发酵液于4 000×g,4 ℃,离心10 min,收集菌体,重悬于灭菌后的PBS(pH 7.4)中,清洗2 次后,将菌体和保护剂按照1∶1.5 的质量比相混合,以保护剂中只加入10%海藻糖作为空白对照组,含有不同浓度的HP3-2 作为试验组,含有5.0 mg/mL 乳清蛋白作为对照组(表1)。真空冻干过程:于-80 ℃预冻6 h后,进行真空冷冻干燥,真空冷冻干燥条件:真空度15 Pa,样品温度由-40 ℃升温至30 ℃,冷阱温度保持在-45 ℃,工作时间为36 h。

表1 不同组分的保护剂组成及含量Table 1 The composition of the different components of lyoprotectant
1.3.3 活菌数测定 真空冷冻干燥后样品的细胞存活率测定按照王淑敏等[13]描述的方法并适当修改。取1 g 冻干样品,与9 mL 的磷酸盐缓冲液(PBS,pH 7.4)混匀,于摇床振荡20 min 后进行梯度稀释,倾注于MRS 固体培养基中(加入0.05%的半胱氨酸盐酸盐),于37 ℃厌氧培养72 h。
1.3.4 细胞膜脂肪酸的提取与测定 根据Wei等[14]描述的方法并稍作修改;将冻干后的菌体复溶于PBS 缓冲液中,于4 000×g,15 min 离心,洗涤2 次后,称取0.5 g 菌体,加入1.9 mL 氯仿-甲醇(1∶2,V/V)混合溶液,振荡15 min,再加入0.625 mL的氯仿以及0.625 mL 去离子水,旋涡振荡15 min,于4 000 r/min,15 min 离心,吸取下层有机相,用氮气吹干;加入1 mL 甲醇钠-甲醇溶液,放于冰中1 min,振荡5 min,再加入600 μL 正己烷萃取脂肪酸,振荡5 min,于4 000×g,5 min 离心,取上层相,置于GC-MS 上样瓶中,通过GC-MS分析。
脂肪酸含量测定采用GC/MS 法。色谱柱:HP-5 毛细管填充柱(30 m×0.22 mm 柱内径,0.25 μm膜厚,Restek);载气(He)流速29.6 mL/min;总流量1 mL/min;柱压63.4 kPa;进样口温度260 ℃;检测器温度280 ℃;色谱柱温升温程序:起始温度100℃,保持1 min,随后以4 ℃/min 速率增至250 ℃,并在250 ℃保持5 min,进样量:1 μL。
质谱条件:电子轰击(EI)离子源;电子能量70 eV;传输线温度275 ℃;离子源温度200 ℃;激活电压1.5 V;质量扫描范围35~500 m/z。计算脂肪酸各峰的峰面积、保留时间,结果与37 种脂肪酸标样进行对比。
1.3.5 细胞内活性氧测定 使用DCFH-DA 分析检测细胞内活性氧的产生和积累[15]。将菌体用PBS缓冲液清洗2 次,4 000×g,离心5 min,然后重新悬浮在PBS 缓冲液中,加入DCFH-DA 至终浓度为10 μmol/L,37 ℃避光孵 育50 min,以未用DCFH-DA 处理的细胞作为对照,通过流式细胞仪检测细胞的荧光强度(488 nm 激发波长)。
1.3.6 胞内外pH 测定 将菌体复溶于无菌蒸馏水中,使用pH 计测定细胞外pH 值。
使用BECEF-DA 分析检测细胞内pH 变化情况[16]。将菌体用PBS 缓冲液清洗2 次,4 000×g,离心5 min,然后重新悬浮在PBS 缓冲液中,加入BECEF-DA 至终浓度为1 μmol/L,37 ℃避光孵育30 min,以未用BECEF-DA 处理的细胞作为对照,通过流式细胞仪检测细胞的荧光强度(488 nm 激发波长)。
将菌体 悬浮在pH 值 为6.2,6.5,6.8,7.2 的PBS 缓冲液中,加入终浓度为1 μmol/L 的尼日利亚菌素和BECEF-DA,37 ℃避光孵育30 min,构建胞内pH 标准曲线。
1.3.7 细胞膜流动性测定 使用Li 等[17]描述的方法对细胞膜流动性进行测定。将冻干菌粉复溶后,用PBS 缓冲液清洗菌体2 次,4 000×g 离心5 min,重悬在PBS 缓冲液中,加入Laurdan 至终浓度为10 μmol/L,30 ℃避光孵育30 min,以未用荧光染料处理的细胞作为对照,测定荧光强度,广义荧光偏振(GP)测定样品的细胞膜流动性。
式中,I440nm——在440 nm 波长处的荧光强度;I490nm——在490 nm 波长处的荧光强度。
1.3.8 细胞外Na+浓度测定 将冻干后的乳双歧杆菌Probio-M8 复溶于PBS 缓冲液中,并与16 g/L 的氯化钠溶液按等体积比混合,在4 000×g,4 ℃离心5 min,取上清液于1.5 mL 的EP 管中,使用生化分析仪进行测定,样品溶液上机测试得到的结果×2 即为样品中实际的Na+离子浓度。
1.3.9 细胞膜电位测定 使用流式细胞术对真空冷冻干燥后的乳双歧杆菌Probio-M8 的细胞膜电位进行测定,将真空冷冻干燥后的菌粉复溶于PBS 缓冲液中,旋涡振荡混匀后,4 000×g,4 ℃离心5 min,使用PBS 清洗2 次后,重悬,再用PBS连续稀释,使样品的活菌数在1×106CFU/mL 左右,加入DiBAC4(3)荧光染料,样品中的最终浓度为1 μmol/L,于37 ℃避光孵育30 min 后,使用流式细胞仪检测样品的荧光强度[18]。
膜电位标准曲线:将冻干后的样品复溶于不同浓度的钾离子溶液(140,70,35,14,7,3.5 mmol/L)中,并加入终浓度为1 μmol/L 的缬氨霉素和尼日利亚菌素,并加入2 μmol/L 的DiBAC4(3)荧光染料,于37 ℃避光孵育30 min,上机测定并绘制标准曲线;另外,2%预冷甲醛于4 ℃固定菌体60 min 后,作为去极化样品,剩余的荧光染色步骤与样品相同。
1.3.10 数据处理 所有数据每组3 个平行,使用GraphPad Prism 9.0 和Origin 2021 对试验数据进行显著性分析,P〈0.05 为显著,同时完成相关图形的绘制。
2 结果与分析
2.1 冻干后活菌数
双歧杆菌作为革兰氏阳性厌氧菌,由于自身缺乏过氧化氢酶、过氧化物酶等氧化还原酶,在有氧条件下极容易受到ROS 的攻击,导致核酸、蛋白质等生物大分子造成不可逆的损伤,对双歧杆菌的生长代谢造成影响[19-20]。经过真空冷冻干燥后乳双歧杆菌Probio-M8 的菌种存活率如图1 所示,随着HP3-2 质量浓度的升高,乳双歧杆菌Probio-M8 的菌种存活率呈显著上升趋势(P〈0.05),含有5 mg/mL 的HP3-2 试验组菌种存活率为(80.40±3.34)%,显著高于WP 组(64.69±2.47)%和T 组(72.65±1.98)%(P〈0.05)。结果说明,高温灭菌后的WP 会降低乳双歧杆菌Probio-M8 的菌种存活率,含有抗氧化活性的HP3-2 试验组(5 mg/mL)能够在真空冷冻干燥过程中,对细胞起到更好的保护作用,并提高菌体的冻干存活率。已有研究表明,乳清蛋白水解物中含有较多疏水性氨基酸的多肽,能够与细胞膜上的脂质相结合,通过清除氧自由基,抑制细胞膜的脂质氧化,达到对细胞的保护作用[21-23]。
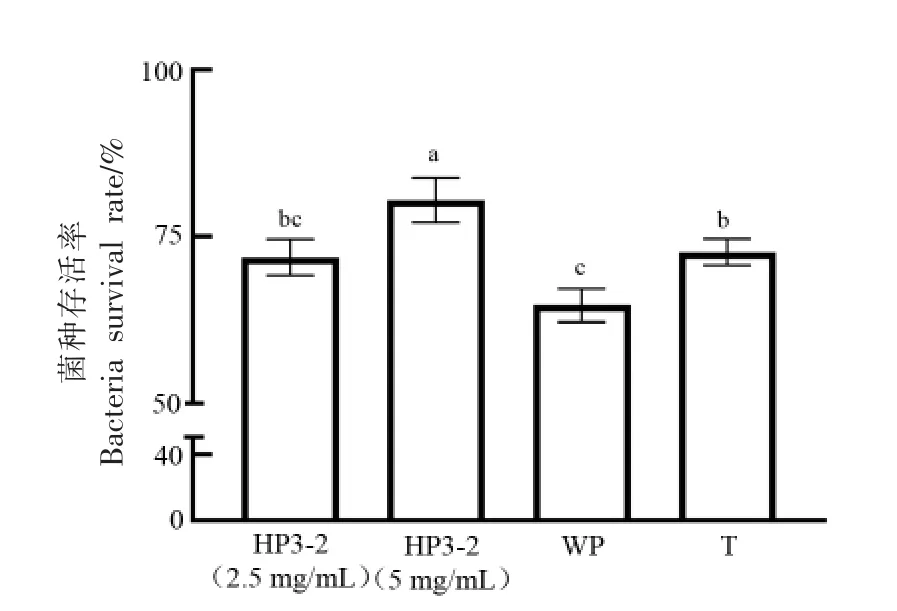
图1 乳双歧杆菌Probio-M8 冻干存活率变化Fig.1 Change in the survival rate of Probio-M8 after freeze-drying
2.2 细胞内外pH 变化
pH 变化是评估应激反应的重要参数[24]。乳双歧杆菌Probio-M8 冻干后细胞外pH 如图2a 所示,含有5.0 mg/mL 的HP3-2 试验组 的pH 值(4.99±0.00)最低,显著低于WP 组(5.14±0.00)和T 组(5.24±0.00),P〈0.05;使用流式细胞术对乳双歧杆菌Probio-M8 的胞内pH 值进行测定(图2b),含有2.5 mg/mL 和5.0 mg/mL 的HP3-2 试验组胞内pH 值(5.82±0.06 和5.89±0.03)显著高于WP 组(5.74±0.01)和T 组(5.50±0.01),P〈0.05;含有不同质量浓度HP3-2 的细胞内、外pH 差值显著高于WP 组和T 组(表2)。为了维持胞内蛋白酶的活力,细胞内pH 一般呈中性,而细胞在真空冷冻干燥过程中不断脱水,并伴随胞内溶质的浓缩,使胞内pH 值下降,同时,氧化应激导致细胞膜发生脂质氧化,导致细胞受损;当细胞复水后,不含有抗氧化活性的WP 组和T 组中,由于氧化应激导致细胞膜受损,使细胞内溶质流出,从而使细胞膜质子梯度遭到破坏,使细胞内pH 与环境pH 更为接近,而含有抗氧化肽HP3-2 的试验组能够通过降低氧化应激对细胞膜的损伤,防止细胞内容物的泄漏并维持细胞膜质子梯度,达到对乳双歧杆菌Probio-M8 的保护作用。已有研究表明,具有完整的细胞膜能结构是维持细胞质子梯度的关键因素[25],另外,氧化应激的产生与pH 的变化密切相关[26]。
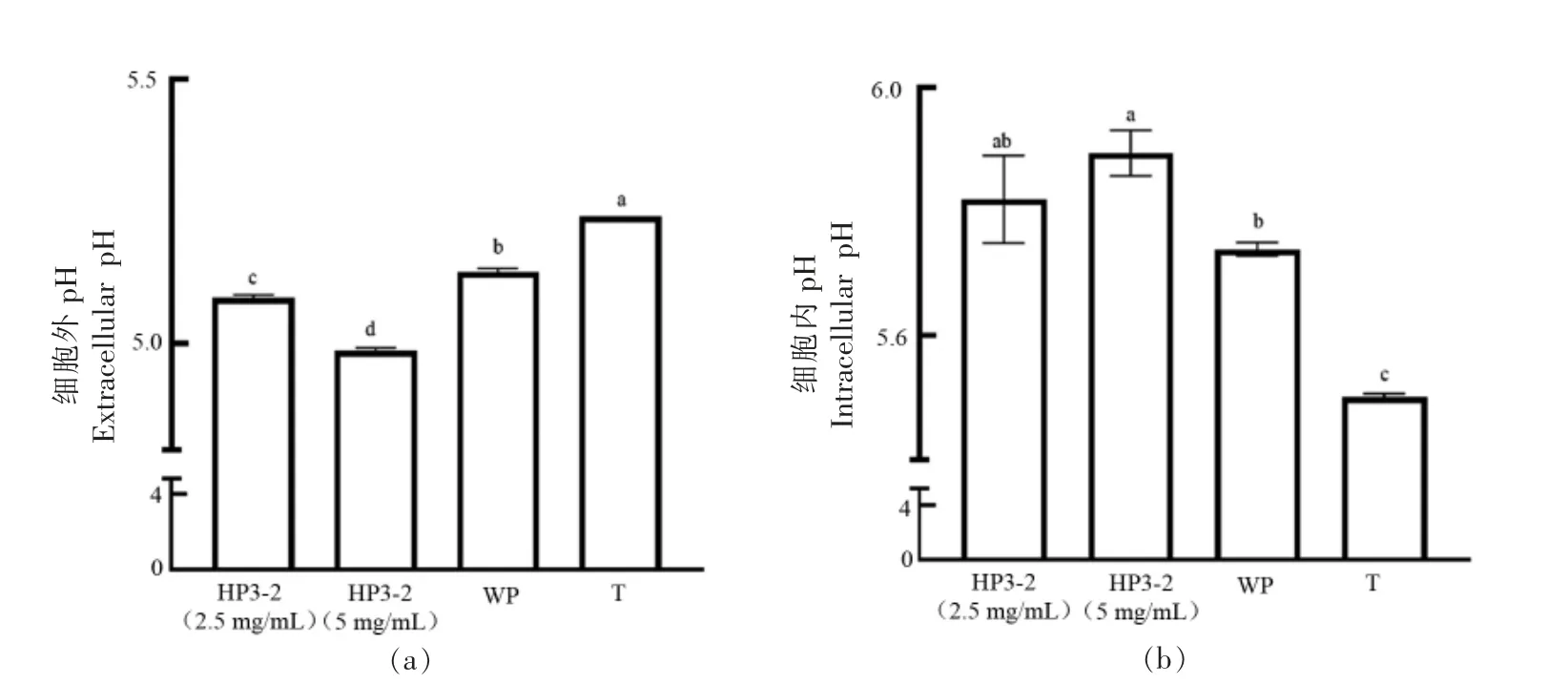
图2 乳双歧杆菌Probio-M8 冻干后细胞外pH(a)和细胞内pH(b)变化Fig.2 Extracellular(a)and intracellular(b)pH changes of Probio-M8 after freeze-drying
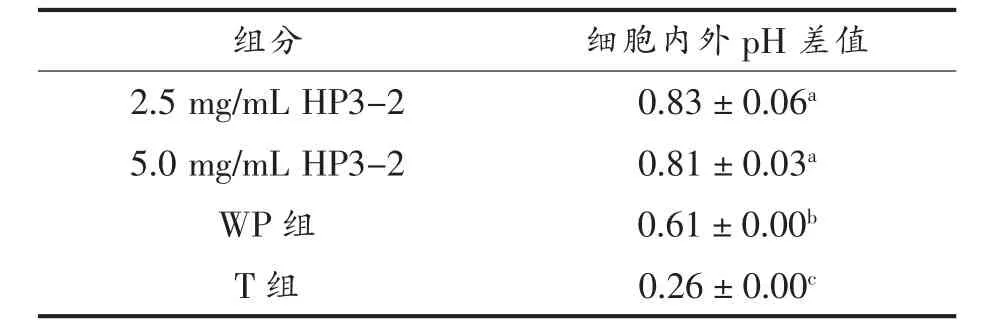
表2 乳双歧杆菌Probio-M8 冻干后细胞内、外pH 差值Table 2 Change in pH difference between inside and outside cells after freeze-drying of Probio-M8
2.3 脂肪酸含量及细胞膜流动性变化
细菌的脂肪酸一般由含有12~22 个碳的饱和脂肪酸(SFA)及不饱和脂肪酸(UFA)组成,其中以含有16~18 个碳的脂肪酸占总脂肪酸的60%以上[27]。真空冷冻干燥后,乳双歧杆菌Probio-M8 的细胞膜脂肪酸主要由肉豆蔻酸(C14∶0)、十五烷酸(C15∶0)、棕榈酸(C16∶0)、棕榈烯酸(C16∶1)、十七烷酸(C17∶0)、硬脂酸(C18∶0)、油酸(C18∶1n9c)、亚麻酸(C18 ∶2n6t)、花生酸(C20 ∶0)和γ-亚麻酸(C18∶3n6)10 个脂肪酸组成(表3),其中油酸、棕榈烯酸和亚麻酸为不饱和脂肪酸(UFA)。含有5.0 mg/mL HP3-2 试验组的相对UFA 含量(51.49±1.26)显著高于WP 组(39.96±1.57)和T 组(33.33±0.62),P〈0.05。结果表明,抗氧化肽HP3-2 能够降低氧化应激造成的细胞膜损伤,使细胞膜维持较高的不饱和脂肪酸含量,并且HP3-2 对细胞膜具有更好的保护作用。研究发现,Niranjan 等[28]发现肽的N 端为疏水性氨基酸时,能够与生物膜中脂肪酸相互作用,通过捕捉自由基减少链式反应的发生;另外,乳酸菌细胞膜中含有较高不饱和脂肪酸比例,能够在冷冻干燥过程中维持较高细胞膜完整性,减少细胞损伤[29];Zhang 等[30]研究发现谷胱甘肽能够在真空冷冻干燥过程中保护旧金山乳杆菌中不饱和脂肪酸,并提高菌体的冻干存活率。

表3 真空冷冻干燥后乳双歧杆菌Probio-M8 细胞膜脂肪酸组成(%)Table 3 Fatty acid composition of the cell membrane for Probio-M8 after freeze-drying(%)
流动性是细胞膜的重要特性之一,主要取决于温度和细胞膜脂肪酸组成[31];细胞膜流动性有助于细胞感知外界环境的变化(温度、pH 和渗透压等),使细胞通过基因的表达,适应外界环境的改变[32]。真空冷冻干燥后,乳双歧杆菌Probio-M8的细胞膜流动性如图3 所示,图中纵坐标广义荧光偏振所测得的结果(GP 值)与细胞膜流动性成反比。随着HP3-2 浓度的升高,含有HP3-2 样品的GP 值呈下降趋势,并且含有5.0 mg/mL HP3-2试验组的GP 值(0.086±0.002)显著低于WP 组(0.092±0.002)和T 组(0.092±0.001),P〈0.05。结果表明,抗氧化肽HP3-2 能够在真空冷冻干燥过程中降低氧化应激对细胞造成的损伤,使细胞膜中具有较高的不饱和脂肪酸含量,并维持较高的细胞膜流动性,从而达到对乳双歧杆菌Probio-M8的保护作用。Marielle 等[33]发现增加细胞膜脂肪酸中UFA/SFA 的比例,能够提高细胞膜的流动性;另外,在干燥和贮藏过程中,氧化反应会损伤细胞膜的物理结构并改变脂质组成,导致细胞膜流动性降低并影响细胞功能[34]。Li 等[17]发现提高细胞膜流动性和细胞膜完整性,能够提高乳酸菌在真空冷冻干燥过程中的菌种存活率。

图3 乳双歧杆菌Probio-M8 冻干后细胞膜流动性Fig.3 Cell membrane fluidity of Probio-M8 after freeze-drying
2.4 细胞内活性氧及丙二醛含量
活性氧在细胞代谢以及应激反应过程中具有重要意义[35]。氧敏感的乳酸菌在干燥及贮藏过程中发生氧化应激反应,造成蛋白质、DNA 和脂质发生不可逆的损伤,是导致细胞死亡的主要原因[36]。氧化应激与褐变反应在冷冻干燥与贮藏期间使细胞发生蛋白羰基化和脂质氧化[37],其中,脂质过氧化物和氢过氧化物加速分解生成醇、醛等多种氧化产物,其中,丙二醛是最为常见的氧化产物[38]。使用流式细胞术对细胞内活性氧含量进测定(图4),试验组和对照组中胞内活性氧的荧光强度分别为T 组/WP 组〉2.5 mg/mL 的HP3-2 组〉5 mg/mL 的HP3-2 组,并且HP3-2 试验组中胞内活性氧的荧光强度随着HP3-2 浓度的升高而降低;使用丙二醛检测试剂盒对真空冷冻干燥过程中乳双歧杆菌Probio-M8 受到氧化应激所产生的氧化产物丙二醛含量进行测定(图5)2.5 mg/mL 和5 mg/mL 的HP3-2 试验组丙二醛含量分别为(2.23±0.06)nmol/mL 和(2.14±0.06)nmol/mL,丙二醛浓度随着HP3-2 浓度的升高而降低,另外,5 mg/mL 的HP3-2 试验组的丙二醛含量显著低于WP 组(2.30±0.05)nmol/mL 和T 组(2.33±0.05)nmol/mL,P〈0.05。结果表明,抗氧化肽HP3-2 在真空冷冻干燥过程中,能够降低细胞内活性氧的含量,防止氧自由基对细胞膜中不饱和脂肪酸的氧化,降低氧化产物丙二醛的含量。已有研究表明,脂质氧化是细胞脱水过程中氧化应激导致细胞损伤的重要因素[39];抗氧化肽能够提供还原氢或给自由基一个配对的电子,使活性氧失去氧化活性[40],因此,由于抗氧化肽HP3-2 含有甘氨酸和脯氨酸等疏水性氨基酸,能够通过捕获活性氧分子降低细胞膜脂肪酸氧化,并减少丙二醛含量,提高乳双歧杆菌Probio-M8 的菌种存活率。

图4 乳双歧杆菌Probio-M8 冻干后胞内活性氧含量变化Fig.4 Changes in intracellular reactive oxygen species content of Probio-M8 after freeze-drying

图5 乳双歧杆菌Probio-M8 冻干后丙二醛含量变化Fig.5 Changes in malondialdehyde content of Probio-M8 after freeze-drying
2.5 细胞膜电位及Na+浓度变化
细胞处于静息状态时,细胞膜具有100 mV 的跨膜电位,并且细胞膜内、外Na+离子浓度处于“外高内低”的状态[41];当细胞受到外界环境刺激后,通过控制离子通道改变细胞膜内、外的Na+浓度梯度,使细胞膜电位发生改变,从而影响细胞正常的生理代谢过程[42]。乳双歧杆菌Probio-M8 经真空冷冻干燥复水后,细胞胞外Na+浓度变化如图6a 所示,添加2.5 mg/mL 和5 mg/mL 的HP3-2 试验组中,胞外Na+浓度为(5.67±0.64)mmol/L 和(62.45±0.49)mmol/L,显著高于WP 组(52.01±0.54)mmol/L 和T 组(51.70±0.43)mmol/L,P〈0.05;使用流式细胞术检测乳双歧杆菌Probio-M8 的细胞膜电位变化(图6b),含有2.5 mg/mL 和5 mg/mL的HP3-2 试验组中细胞膜电位为(-10.95±0.75)mV 和(-13.10±0.86)mV,显著低于WP 组(-9.93±0.50)mV 和T 组(-9.35±1.23)mV,P〈0.05。结果说明,真空冷冻干燥过程会造成乳双歧杆菌Probio-M8 细胞损伤,使细胞外Na+浓度和细胞膜电位发生改变,抗氧化肽HP3-2 能够保护细胞膜结构稳定,降低氧化应激对Na+浓度和细胞膜电位的影响,维持细胞正常的生理代谢。

图6 Na+浓度(a)和细胞膜电位(b)变化Fig.6 Changes in Na+ ion concentration(a)and cell embrane potential(b)
3 结论
真空冷冻干燥过程中产生的氧化应激会对双歧杆菌细胞膜结构及生物活性产生影响,抗氧化肽HP3-2 中主要含有较多的疏水性氨基酸,能够与细胞膜中的脂质相结合,通过清除氧自由基,降低氧化产物丙二醛的含量,使细胞膜具有较高的不饱和脂肪酸含量和细胞膜流动性,维持细胞膜完整,并使细胞膜内、外的质子梯度、细胞膜电位和Na+浓度保持平衡,在真空冷冻干燥过程中起到对乳双歧杆菌Probio-M8 的保护作用;通过本研究结果,能够为天然抗氧化型保护剂的开发提供理论基础,为双歧杆菌发酵剂的工业化生产提供技术支持。

