甘薯叶片原生质体快速制备方法的优化
赵昊,周晓晴,马遇乐,蔡梦琪,王爱华
(1.青岛农业大学生命科学学院,山东青岛 66109;2.青岛农业大学草业学院/黄河三角洲草地资源与生态国家林业和草原局重点实验室,山东青岛 266109)
原生质体是去掉细胞壁的“细胞”,广泛应用在基础生命科学研究中,如细胞壁再生、细胞分裂与分化、细胞膜的离子转运机制、膜透性、细胞器和病毒侵染实验等等理论研究。原生质体具有细胞全能性,给予适宜的培养条件可再生细胞壁、分裂增殖,直至发育成完整植株。原生质体易接受外源的遗传物质并表达,因此原生质体也被广泛应用到植物育种、体细胞杂交、基因组编辑、原生质体瞬时表达、亚细胞定位、蛋白互作等研究中[1-4]。
原生质体可利用叶片、子叶、根、愈伤组织等材料进行制备,其中叶片是常用的材料,这是因为叶片材料来源广泛且易分解[5],而且酶解后能长时间保持细胞形态,易于获得生理状况与遗传学特性较为一致的原生质体[6]。酶解法是原生质体制备的常用方法,为了增加植物细胞与酶溶液的接触面积,通常将材料切碎后进行酶解。有研究发现,用镊子将植物叶片的表皮撕掉,将叶肉细胞直接暴露在酶溶液里,可以提升制备植物细胞原生质体的速度[2]。但是不同物种的叶片结构不同,这种方法只能适用在某些特定的植物中[2]。Wu等[7]使用胶带撕掉拟南芥叶片的表皮后再酶解,可以明显缩短酶解时间。除此之外,酶溶液的浓度[8]、酶解温度以及纯化时的离心速度等条件都会影响原生质体的制备时间,也会影响原生质体的质量和得率。甘薯原生质体的分离和培养始于20世纪70年代末[9],多以叶片、叶柄等作为材料,采用常规酶解方法,制备时间需要15~18 h或更长[10-13],这也给后续的瞬时表达等分子生物学研究、体细胞杂交育种等复杂实验带来了不便。
本研究通过优化叶片处理方式、酶溶液的浓度、酶解温度以及离心速度等条件,建立了一种甘薯叶片原生质体的快速制备方法,可以在短时间内制备原生质体,为瞬时表达系统、体细胞杂交育种等复杂的实验提供参考及技术支撑。
1 材料与方法
1.1 试验材料和试剂
1.1.1 试验材料
甘薯[Dioscoreaesculenta(Lour.) Burkill]完全展开的幼嫩叶片。
1.1.2 试剂
酶溶液:纤维素酶R-10、离析酶R-10(均来自北京索莱宝科技有限公司),D-甘露醇0.6 mol/L、氯化钙0.5%、吗啉乙磺酸一水合物(MES)5.0 mmol/L,pH 5.8;W5洗净液:CaCl2·2H2O 125.0 mmol/L、NaCl 154.0 mmol/L、KCl 5.0 mmol/L、葡萄糖5.0 mmol/L、MES 5.0 mmol/L,pH 5.8;25%蔗糖溶液。
1.2 方法
1.2.1 叶片的处理
称取完全展开的甘薯叶片0.5 g,采取三种处理方式。(1)剪成细丝:用剪刀将叶片剪成0.5~1 mm宽的细丝后装入培养皿中备用(图1A);(2)撕去下表皮:截取一段透明胶布粘住甘薯叶片上表皮后,轻轻拂拭使其粘牢,再截取一段透明胶布粘到甘薯叶片下表皮后将下表皮撕下来,将叶片放进培养皿备用(图1B);(3)撕去下表皮后剪成细丝:将甘薯叶片用胶布撕去下表皮后剪成0.5~1 mm宽的细丝,装入培养皿中备用(图1C)。

A:叶片剪成细丝; B:叶片撕去下表皮; C:叶片撕去下表皮后剪成细丝。
1.2.2 原生质体分离
将处理的叶片装入培养皿中,加入5 mL酶溶液,封口后用铝箔纸遮光,恒温震荡(50 r/min)培养箱中设置好适宜的温度酶解,显微观察酶解情况。其中对酶浓度(纤维素酶R-10:0.4%、0.5%、0.6%;离析酶R-10:0.2%、0.3%、0.4%)、酶解温度(24 ℃、26 ℃、28 ℃、30 ℃、32 ℃)、酶解时间(4 h、6 h、8 h、18~20 h)进行了单因素优化;为了缩短原生质体制备时间,又进一步提高酶浓度,进行了酶浓度(纤维素酶R-10:0.8%、1.0%、1.6%、1.8%、2.0%;离析酶R-10:0.6%、0.7%、0.9%、1.1%)和酶解时间(2 h、3 h)的双因素优化,重复3次。
1.2.3 原生质体的纯化
用200~400目不锈钢网过滤,去掉未酶解的组织。取2 mL 25%蔗糖溶液加入10 mL离心管中,将过滤后的甘薯原生质体-酶混合溶液沿离心管内壁缓慢加入,使之悬浮于蔗糖溶液之上,形成界面。
使用低速离心机离心10 min,收集界面上的原生质体。将盛有原生质体的离心管中加W5洗净液至5 mL,为优化离心速度,以不同离心力(550×g、450×g、550×g)离心5 min,弃掉上清液,洗涤2次。重复3次。
1.2.4 显微观察
显微镜下观察制备的原生质体,血球计数板计数统计原生质体数目,取平均值。
2 结果与分析
2.1 甘薯叶片的不同处理方法对原生质体制备的影响
通过相同的酶解条件(0.4%纤维素酶R-10+0.2%离析酶R-10酶溶液),比较不同的叶片处理方法对原生质体分离情况的影响。根据酶解情况(图2A、2B、2C)及原生质体的质量(图2E、2F、2D),去表皮的两种方法酶解效果比较好。仅去表皮方法比去表皮且剪成细丝的方法获得的原生质体产量稍低,但前者破碎的细胞等杂质少,原生质体纯化后较纯净,因此后续试验均采用撕去叶片下表皮后酶解的方法制备原生质体,以期得到量较大且较为纯净的原生质体。
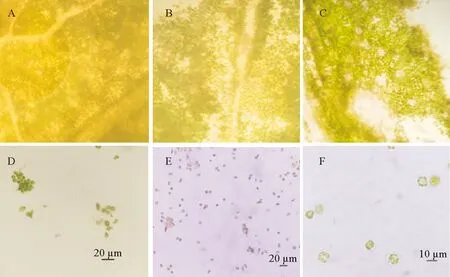
A:叶片剪成细丝的酶解情况;B:叶片撕去下表皮的酶解情况; C:叶片撕去下表皮后剪成细丝的酶解情况;D:未纯化原生质体; E:纯化后原生质体(100倍); F: 纯化后原生质体(400倍)。
2.2 酶浓度对原生质体制备的影响
在相同的酶解条件下,设置了纤维素酶R-10和离析酶R-10的浓度梯度(见表1),酶解6 h后显微镜下观察发现,0.6%纤维素酶R-10+0.4%离析酶R-10的酶解条件下获得的原生质体的产量与质量(图2D至2F)在筛选条件中效果最好(表1),随着酶浓度的提高,原生质体产量增长。
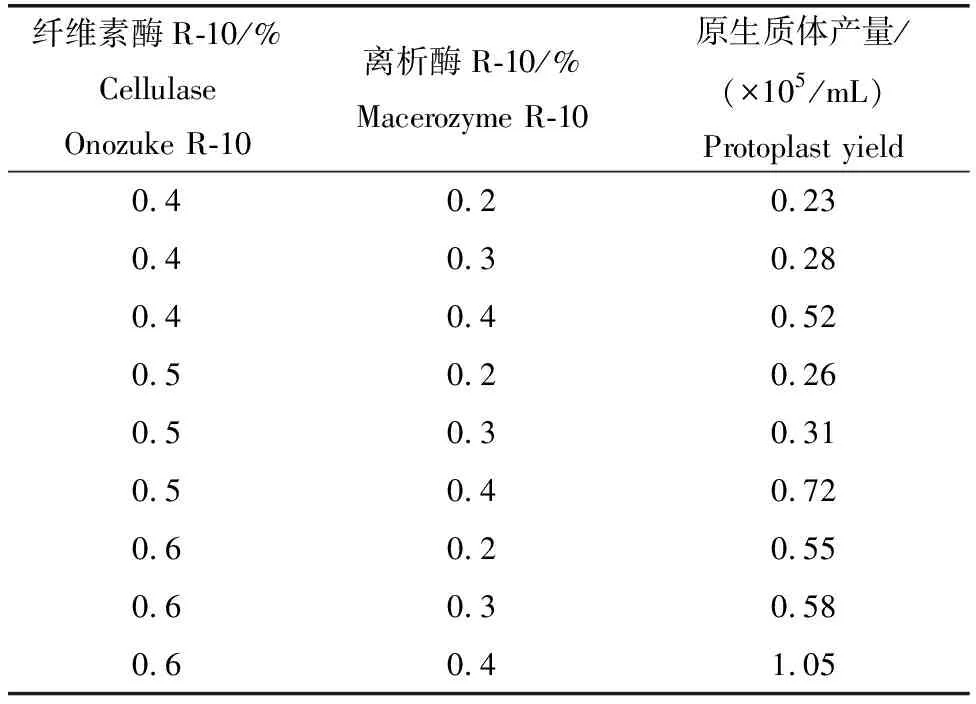
表1 不同酶浓度对原生质体制备的影响
2.3 酶解温度对原生质体制备的影响
由表2可以看出,在0.6%纤维素酶R-10+0.4%离析酶R-10的酶溶液中酶解6 h时,温度的变化影响了原生质体的得率。在24~28 ℃范围内,随着温度的升高,显微镜下视野里原生质体产量在明显增加,而在28 ℃与30 ℃条件下原生质体产量差异不明显,当温度升高到32 ℃时,原生质体产量明显下降。这可能是因为较高的温度对原生质体不利,酶解出来的原生质体无法稳定存在而破裂,导致原生质体产量下降,因此28 ℃是甘薯利用纤维素酶R-10+离析酶R-10酶解比较适合的酶解温度。

表2 不同酶解温度对原生质体制备的影响
2.4 酶解时间对原生质体制备的影响
在相同酶溶液(0.6%纤维素酶R-10+0.4%离析酶R-10)中,28 ℃条件下随着酶解时间的延长,显微镜下观察,发现在酶解4 h时就可以产生少量的原生质体(见表3),酶解6 h、8 h的原生质体产量多且差异不大,过夜处理(18~20 h)的原生质体产量稍有降低,且溶液中破碎的细胞等杂质增多,可能是由于已经酶解的原生质体破裂造成。酶溶液(0.6%纤维素酶R-10+0.4%离析酶R-10)酶解6 h可以获得大量的原生质体,满足大部分实验的需求。

表3 酶解时间对原生质体制备的影响
2.5 酶浓度及酶解时间双因素的优化
为了更快制备原生质体,根据前期优化试验,进行了酶浓度及酶解时间双因素的优化(见表4)。从表4可以看出,酶解2 h时,酶浓度较低时没有观察到原生质体;酶浓度为1.6%纤维素酶R-10+0.7%离析酶R-10时原生质体的产量较低;1.8%纤维素酶R-10+0.9%离析酶R-10和2.0%纤维素酶R-10+1.1%离析酶R-10这两种高浓度酶溶液在酶解2 h时原生质体产量都较高,可以满足试验需求,但酶解3 h的原生质体产量有差异;酶溶液(2.0%纤维素酶R-10+1.1%离析酶R-10)浓度高对原生质体有不利影响,酶解3 h会导致原生质体产量下降。因此,综合考虑原生质体的产量、质量及经济因素,酶溶液(1.8%纤维素酶R-10+0.9%离析酶R-10)更适合短时间快速制备甘薯叶片的原生质体,酶解时间可缩短到2 h。

表4 酶浓度与酶解时间对原生质体制备的影响
2.6 离心速度对原生质体纯化的影响
为了更好地纯化原生质体,对界面法纯化的离心速度进行了筛选,将酶解后的酶溶液分别以550×g、450×g和350×g离心10 min。结果表明,在原生质体纯化时使用350×g离心力离心10 min会使原生质体处在蔗糖溶液与甘薯原生质体-酶混合溶液的界面上,纯化效果较好;550×g、450×g离心力时原生质体沉淀到离心管壁上,难以获得纯净的原生质体。
3 讨论
甘薯是世界上重要的粮食、饲料作物,也是重要的工业原料及新型能源材料。但是由于甘薯遗传上的高度杂合性及其种间、种内广泛存在的杂交不亲和性,限制了甘薯育种中亲本选配以及近缘野生种资源的利用,开展原生质体研究可以为甘薯的生物技术育种提供技术支撑。
利用胶带撕去甘薯叶片的下表皮后再进行酶解,酶溶液可以更充分地与叶肉细胞接触,能有效缩短酶解时间且得到较为纯净的原生质体-酶混合溶液,也有利于后续原生质体纯化。
通过提高酶溶液的浓度也可以有效地缩短酶解时间,但同时高浓度的酶溶液也对原生质体不利,会使原生质体破裂,因此不同浓度的酶溶液适宜的酶解时间不同,把握好酶解时间才能得到大量的高质量原生质体。
酶解温度是影响酶解效果的另一个因素,适宜的酶解温度要同时考虑酶的适宜反应温度和材料的耐受性两个方面。根据北京索莱宝科技有限公司提供的产品信息,纤维素酶R-10与离析酶R-10的最适温度为40~50 ℃,而甘薯叶肉细胞可长时间处在23~28 ℃而不失去活性,因此酶解时在24~30 ℃进行,经过筛选28 ℃效果最佳。
酶解时间会影响原生质体产量与质量,酶解时间过长会使已经酶解完成的原生质体破裂,酶解时间过短,又无法得到充足的优质原生质体,因此时间的把控极为重要。不同植物叶片适宜的酶解时间有差异,已经报道的酶解法多数酶解时间较长,如白桦树叶片酶解时间15~16 h[14]、棉花的酶解时间是18~20 h[15]、甘薯(0.4%纤维素酶R-10+0.2%离析酶R-10)酶解时间18 h[13]。试验过程中发现不同浓度的酶溶液适宜的酶解时间差异很大,低浓度酶溶液需要的酶解时间长(0.6%纤维素酶R-10+0.4%离析酶R-10酶解6 h比较合适,效果较好),高浓度酶溶液需要的酶解时间短(1.8%纤维素酶R-10+0.9%离析酶R-10酶解2 h比较合适,酶解3 h原生质体产量反而下降)。
本研究使用纤维素酶和离析酶混合酶液获得了甘薯叶片的原生质体,这与刘庆昌等[13]报道的类似,不同的是试验采用了胶带撕去下表皮的处理方式提高了酶解效果,同时结合调整酶浓度、酶解温度可以将酶解时间缩短到2 h,大大缩短了酶解时间。

