昆明系小鼠酒精性脂肪肝与非酒精性脂肪肝造模比较
樊鲁倩,关佳佳,迟良,刘焕奇
(青岛农业大学动物医学院,山东青岛 266109)
脂肪肝病是由肝细胞内脂肪堆积过多而形成,根据病因划分为酒精性脂肪肝病(alcoholic fatty liver disease, AFLD)和非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD),根据肝脏发生脂肪变性的范围,划分为轻度、中度和重度脂肪肝,随着病情发展,重度脂肪肝会演变成肝脏纤维化和肝硬化。肝脏是动物机体内新陈代谢最活跃的器官,脂肪肝的病理机制包括脂质代谢紊乱、线粒体氧化应激损伤、细胞因子和脂肪因子的表达变化。改变生活方式、减肥手术和药物治疗是脂肪肝病的主要治疗方法。
乙醇在肝脏内首先代谢生成乙醛,长期摄入酒精会导致肝脏乙醛含量升高、线粒体功能受损,进一步造成AFLD。AFLD受摄入酒精的浓度、含量以及动物的性别、品种等因素影响。啮齿动物AFLD造模主要有三种方法:以过量饲料饲喂,结合乙醇灌胃的Lieber DeCarli方法[1];长期在饮水或饮食中添加乙醇的慢性摄入乙醇法[2];以及Tsukamoto-French等[3]采用的慢性摄入添加乙醇的饲料,后急性乙醇灌胃的方法。昆明系小鼠是目前我国使用量最大的远交群小鼠,抗病力和适应力强,广泛应用于医学实验。在国内,关光玉等[4]利用昆明系小鼠灌胃酒精建立小鼠AFLD模型。
NAFLD是一种常见的肝病,涵盖了肝脏单纯脂肪变性和和非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)[5]。NAFLD的发生与多种因素有关,包括营养因素、遗传因素、胰岛素抵抗、肠道微生物群等[6]。据统计,现在已经在超过39种啮齿动物上实现了NAFLD/NASH造模。其中利用高脂饮食(high-fat diet, HFD)喂养小鼠是一种常用的造模方法,该方法会导致小鼠体内向肝脏输送脂肪酸(fatty acid, FA)增加,肝脏发生脂肪变性[7]。我们通过长期高脂(60%高脂饲料)饲喂昆明系小鼠,观察小鼠的肝脏损伤状况及健康状况。本研究通过对小鼠进行灌胃白酒的方法和长期高脂饮食的方法造模,探究不同脂肪肝发生方式及其对引起肝脏病变的差异。
1 材料和方法
1.1 实验动物和药物
健康雄性昆明系小鼠,4周龄,体质量22~24 g,共30只,购自青岛大任富城畜牧有限公司。60%高脂饲料(20%碳水化合物+20%蛋白质+60%脂肪)购自江苏协同医药生物工程有限责任公司。56%及50% vol白酒购自北京顺鑫农业股份有限公司。
本实验中小鼠饲养于325 mm×210 mm×180 mm聚砜类IVC笼盒中,12 h光照与12 h黑暗环境交替,环境温度20 ℃~26 ℃,空气湿度40%~70%,自由饮水。实验终末期2%戊巴比妥实施麻醉,断颈处死小鼠后收集血液、组织样品。所有的试验都得到了青岛农业大学动物伦理委员会的批准,符合动物福利政策。
1.2 主要试剂和仪器
Evo M-MLV反转录预混型试剂盒、SYBR Green Pro Taq HS预混型qPCR试剂盒均购自艾科瑞生物;RNAfast2000总RNA极速抽提试剂盒购自上海飞捷生物技术有限公司;4%多聚甲醛通用型组织固定液购自上海尚宝生物科技有限公司;过氧化物酶体增殖物激活受体γ(Peroxisome proliferator-activated receptor gamma, PPAR-γ)、核受体亚家族1、H组、成员4(Nuclear receptor subfamily 1, group H, member 4, NR1H4)和TOLL样受体4(Toll-like receptor 4, TLR4)基因引物购自生工生物工程(上海)有限公司;FDC NX500iVC+生化分析仪购自日本富士公司;Bio-Rad CFX 实时荧光定量PCR仪购自伯乐生命医学产品(美国)有限公司。
1.3 试验方法
1.3.1 造模和分组
通过HFD饲喂小鼠进行NAFLD造模,12只小鼠随机分为对照组和高脂组,每组6只。对照组小鼠饲喂基础饲料,高脂组小鼠饲喂60%高脂饲料,均自由饮水。
通过HFD饲喂小鼠结合灌胃酒精进行AFLD造模,20只小鼠随机分为对照组和高剂量酒精组,中剂量酒精组,对照组4只,高剂量酒精组8只,中剂量酒精组8只。对照组小鼠饲喂基础饲料,酒精组小鼠饲喂60%高脂饲料,均自由饮水,对照组饲喂基础饲料,每只鼠每日按照体质量10 μL/g灌胃生理盐水,高剂量酒精组每只鼠每日按照体质量10 μL/g灌胃56% vol白酒,中剂量酒精组每只鼠每日按照体质量10 μL/g灌胃50% vol白酒。
1.3.2 血清学指标测定
AFLD组小鼠连续灌胃酒精35 d,NAFLD小鼠饲喂至14周。小鼠禁食12 h,麻醉后心脏取血0.3~0.4 mL,检测血清学指标。离心血液样品,血清总胆固醇(total cholesterol, TC)、甘油三酯(triglycerides, TG)、谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)水平采用全自动生化仪检测。
1.3.3 肝脏标本采集
采血完成后将小鼠以2%戊巴比妥实施麻醉,断颈处死小鼠,每只小鼠取小块肝脏左叶、中叶置于4%多聚甲醛固定液中,同时取适量肝脏组织制成匀浆用以RT-qPCR实验。
1.3.4 制作肝脏组织病理学切片
制作肝脏组织苏木精-伊红染色(hematoxylin-eosin staining, HE)切片的步骤包括,固定肝脏组织,脱水透明,浸蜡包埋,切片与贴片,脱蜡,染色,脱水透明,封片。
制作肝脏组织油红O染色切片的步骤包括,包埋肝脏组织,制作冰冻切片,洗涤包埋剂,异丙醇浸洗,工作液染色,异丙醇调色,苏木精复染,盐酸酒精分化,甘油明胶封片。
1.3.5 RT-qPCR检测肝脏基因mRNA表达变化
取10~15 mg肝脏组织研磨充分,按照RNAfast-2000试剂盒操作说明提取总RNA。使用微量分光光度计检测样品RNA的浓度和纯度,挑选符合纯度要求同时浓度达标的RNA样品用于后续qPCR试验。将样品RNA按照Evo M-MLV 反转录预混型试剂盒操作说明反转录成cDNA。按照SYBR®Green Pro Taq HS 预混型qPCR试剂盒操作说明将样品cDNA和目的基因、内参基因的上下游引物、SYBR GREEN混匀,滴加至96孔板中,于qPCR仪进行实时荧光定量检测。PPAR-γ(NM_011144.6)、SCD1(NM_009127.4)、NR1H4(NM_001163504.1)和内参(GAPDH,NM_008084)基因引物序列见表1。
1.4 统计学方法
应用 GraphPad Prism 8 统计软件处理,两组间比较用配对双尾T检验,多组间比较用多因素方差分析,P<0.05可视为差异有统计学意义。
2 结果与分析
2.1 AFLD组与NAFLD组小鼠体质量变化
高剂量酒精组小鼠死亡率高达87.5%,中剂量酒精组死亡率为37.5%。与对照组相比,中剂量酒精组小鼠体质量增长缓慢。高脂组小鼠与对照组相比,体质量在后期显著上升。小鼠体质量变化见图1,图中误差棒代表标准差。
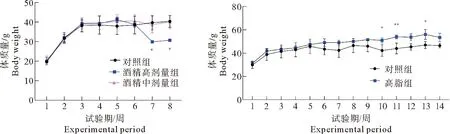
注:与对照组相比,“*”表示差异显著,P<0.05;“**”表示差异非常显著,P<0.01。
2.2 AFLD组与NAFLD组小鼠肝功能与血脂血清学指标
酒精组小鼠血清ALT含量平均值为136 U/L,对照组含量平均值为62 U/L,酒精组含量明显增加;酒精组小鼠血清AST含量平均值为822 U/L,对照组为380 U/L,酒精组含量显著增加;酒精组小鼠血清TC含量平均值为3.11 mmol/L,对照组为3.84 mmol/L,酒精组含量略有下降;酒精组小鼠血清TG含量平均值为0.99 mmol/L,对照组为1.83 mmol/L,酒精组含量显著下降。AFLD组小鼠血清学指标见图2A、2B、2C、2D。
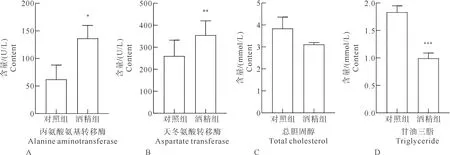
注:与对照组相比,“*”表示差异显著,P<0.05;“**”表示差异非常显著,P<0.01;“***”表示差异极其显著,P<0.001。
高脂组小鼠血清ALT含量平均值为87 U/L,对照组含量平均值为59 U/L,高脂组含量增加;高脂组小鼠血清AST平均值为278.7 U/L,对照组含量平均值为179.5 U/L,高脂组含量显著升高;高脂组小鼠血清TCHO含量平均值为4.27 mmol/L,对照组含量平均值为2.94 mmol/L,高脂组含量增加;高脂组小鼠血清TG含量平均值为0.49 mmol/L,对照组含量平均值为0.43 mmol/L,两组无明显差别。NAFLD组小鼠血清学指标见图3A、3B、3C、3D,图中误差棒代表标准差。
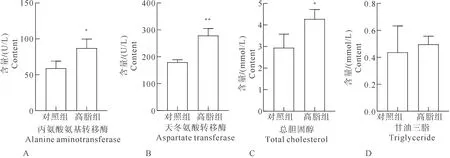
注:与对照组相比,“*”表示差异显著,P<0.05;“**”表示差异非常显著,P<0.01;“***”表示差异极其显著,P<0.001。
2.3 AFLD组与NAFLD组小鼠肝脏病理学切片观察
酒精组小鼠肝脏组织HE切片显示肝组织结构清晰,肝细胞排列正常,肝索呈放射状,未见脂肪变性,油红O染色切片显示脂肪含量减少,见图4A、4B、4E、4F。高脂组小鼠肝脏组织HE切片显示,肝组织结构清晰、肝细胞排列正常、肝索呈放射状、肝板之间有少量圆形脂肪滴、为脂肪变性部位;高脂组小鼠肝脏油红O切片显示,脂肪含量明显增多,见图4 C、4D、4G、4H。

图4 AFLD造模与NAFLD造模组小鼠肝脏组织病理学切片
2.4 AFLD造模组与NAFLD造模组小鼠肝脏基因表达
酒精组小鼠肝脏组织与对照组相比,NR1H4基因表达量下降,PPAR-γ表达量明显下降,TLR4表达量显著降低,见图5A-5C。高脂组小鼠肝脏组织与对照组相比,TLR4基因表达量显著升高,NR1H4、PPAR-γ表达量显著降低,见图6A-6C,图中误差棒代表标准差。

注:与对照组相比,“*”表示差异显著,P<0.05;“**”表示差异非常显著,P<0.01;“***”表示差异极其显著,P<0.001。
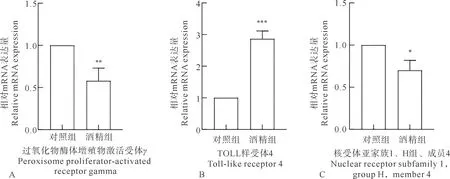
注:与Control组相比,“*”表示差异显著,P<0.05;“**”表示差异非常显著,P<0.01;“***”表示差异极其显著,P<0.001。
3 讨论
利用白酒灌胃小鼠进行AFLD造模周期较短,付强强[8]和胡祥宇等[9]对昆明系小鼠进行高脂喂养结合白酒灌胃,3周后即造成酒精性脂肪肝;而NAFLD造模周期长,本研究造模周期长达12周。AFLD发病机制包括乙醇代谢物乙醛具有毒性,造成肝脏线粒体损伤、氧化还原反应发生改变;乙醇代谢相关的酶造成肝脏损伤主要体现在肝代谢紊乱、自由基导致肝细胞损伤、炎症因子分泌增多介导炎症。NAFLD发病机制包括肝脏脂肪过度积累,由内质网应激、线粒体和溶酶体功能障碍造成的脂质毒性,肝脏细胞因子分泌改变。本研究中利用白酒灌胃小鼠造成肝脏损伤,反映在肝脏酶学指标发生改变及肝脏脂质代谢基因表达量的显著变化;本研究利用长期饲喂小鼠高脂饲料的方法造成肝脏损伤,体现在脂肪肝的明显病变,肝脏酶学指标和脂质代谢基因均发生显著变化。
ALT和AST是反映肝损伤常用的酶学指标,ALT主要分布于细胞质中,AST则有细胞质(cytoplasm-Aspartate aminotransferase, c-AST)和线粒体(mitochondrion-Aspartate aminotransferase, m-AST)两种类型。酒精可损害肝细胞线粒体,使得血清m-AST活力升高[10],AFLD组血清ALT、AST含量升高可能与酒精消耗了作为转氨酶辅酶的磷酸吡哆醛有关。大量摄入酒精造成小鼠体重增长缓慢,肝脏TG含量下降,病理学观察可见肝脏组织脂肪含量减少(图4A)。高脂饲料提供能量远超过小鼠每日所需,导致体内合成游离脂肪酸增多,经血液循环运输至肝脏,造成肝脏脂肪变性[11]。肝脏脂质积累产生脂毒性造成肝细胞损伤,NAFLD组血清ALT与AST水平升高反映出肝细胞受损。机体TC代谢过程中肝脏外的胆固醇酯充足,高密度脂蛋白胆固醇(high density lipoprotein cholesterol , HDL-C)可将游离的TC吸收并且转化为胆固醇酯,然后转移给低密度脂蛋白胆固醇(low density lipoprotein cholesterol , LDL-C)[12]。小鼠长期食用高脂饲料造成肝脏中TC代谢发生异常,血清中TC含量升高。
PPARs受体属于核受体亚家族中的配体激活受体。现已发现,在不同的物种中已经发现了PPARs的三个亚型,它们充当脂质传感器,调节脂质代谢的几乎每个方面。PPARs受体发生功能障碍或失调会导致肥胖、脂肪肝和2型糖尿病。PPAR-γ在脂肪组织中高度表达,控制脂肪组织的分化,在提高胰岛素敏感性和促进脂肪摄取脂肪酸的环节发挥重要作用[13]。本研究选取PPAR-γ基因,观察其表达量在造模组肝脏组织中的变化。AFLD组肝脏中PPAR-γ基因表达量下降,NAFLD组PPAR-γ基因表达量显著下降,这显示出酒精和高脂饮食造成PPARs受体调控胰岛素抵抗环节受到干扰;长期高脂饮食造成肝脏中脂质增多,PPAR-γ参与调控脂肪生成的过程受到影响。
胆汁酸(bile acid, BA)可以激活核受体FXR(farnesoid X receptor,FXR)/NR1H4、孕烷受体PXR(pregnane X Receptor,PXR)/NR1I2、维生素D受体VDR(vitamin D receptor,VDR)/NR1I1等多种信号通路。BA激活的FXR信号通路参与肝糖异生、糖原合成和调节胰岛素敏感性[14]。研究发现小鼠FXR受体激活后可以特异性降低肝脏内单不饱和脂肪酸(monounsaturated fatty acids,MUFA)和多不饱和脂肪酸(polyunsaturated fatty acids, PUFA)的水平[15]。本研究显示,ALD组与NAFLD组肝脏组织NR1H4基因表达量均下降。肝脏中FXR(NR1H4)参与脂质合成,酒精与高脂饮食造成肝脏脂质合成紊乱,并且可以通过降低FXR受体的表达量进一步影响肝肠循环中胆汁酸的代谢。
Toll样受体(toll like receptor, TLR)是参与非特异性免疫(天然免疫)的一类重要蛋白质分子 ,机体内TLR4参与炎症和氧化应激的发生,研究发现NASH大鼠肝脏Kupffer细胞(kupffer cells, KCs)TLR4蛋白表达升高,TLR4-p38 MAPK通路激活后KCs炎症水平升高[16]。本研究发现ALD组肝脏组织TLR4基因表达量下降,显示出酒精可能通过TL4通路介导调控肝脏炎症和氧化应激;而在NAFLD组肝脏组织中,TLR4基因的表达量升高,高脂饮食通过促进炎症因子的释放,可能进一步促进肝脏炎症。

