利用小泛素蛋白修饰分子融合技术在大肠杆菌 BL21(DE3)中表达重组抗菌肽LLv
殷文霞,王为栋,刘晓东,邵坤,单虎,张洪亮,王述柏
(1.青岛农业大学动物医学院,山东青岛 266109;2.青岛农业大学动物科技学院,山东青岛 266109)
目前在抗生素禁用的养殖形势下,养殖业迫切需要寻找抗生素替代品[1]。抗菌肽是一类具有广谱抗菌、抗病毒和免疫调节功能的小分子多肽,与抗生素比较,具有细菌不易对其产生耐药性、无残留等优势,被认为是理想的抗生素替代品[2-4]。目前畜禽用抗菌肽新产品及其高效制备技术缺乏,是制约抗菌肽在养殖业广泛应用的瓶颈。
小分子泛素蛋白最早于1995年在酿酒酵母中被发现。迄今研究者已利用SUMO融合技术在E.coli中重组表达了CM4、IDR-1和TacticinQ等抗菌肽[5]。SUMO融合技术具有多方面的优点:一是SUMO分子量较小,在融合蛋白中所占比例较小,更有利于获得目的蛋白;二是SUMO可以促进靶蛋白的可溶性表达和正确折叠,对蛋白酶和热具有较强的抵抗能力,有利于维持靶蛋白的稳定性;三是相比于其他蛋白酶所具有的氨基酸序列特异性,SUMO可识别蛋白质的三级结构而不是几个氨基酸残基,因此不易产生非特异性切割[6-10]。白福良等[11]利用SUMO表达系统高效表达人白细胞介素15,最终纯化后的白细胞介素15具有显著刺激T细胞增殖功能。宋妮等[12]利用SUMO表达系统高效表达O型口蹄疫病毒VP0、VP1、VP3基因,表达的蛋白具有极好反应原性。曲栗等[13]利用SUMO表达系统高效表达鸡传染性法氏囊病病毒VP3基因,表达的外源蛋白亦具有良好的反应原性。因此,本试验利用SUMO融合技术构建了重组大肠杆菌表达载体pSUMO-LLv,在E.coliBL21(DE3)中重组表达融合蛋白SUMO-LLv,优化了融合蛋白SUMO-LLv的表达条件,分析了融合蛋白SUMO-LLv的可溶性并分离纯化了目的蛋白。试验旨在建立制备重组抗菌肽LLv的高效低成本方法,为其生产和应用提供技术支撑。
1 材料与方法
1.1 菌株与质粒
E.coliBL21(DE3)菌株由青岛农业大学山东省预防兽医学重点实验室保存,pSUMO表达载体,购自LifeSensors公司(Philadelphia, Pennsylvania, USA),货号:No.1001K。
1.2 酶和相关试剂
T4 DNA连接酶、限制性内切酶,均购自宝生物工程(大连)有限公司;质粒抽提试剂盒、胶回收试剂盒,均购自OMEGA Bio-Tek公司。其余试剂为国产分析纯。
1.3 重组抗菌肽LLv氨基酸序列和基因序列的设计与合成
以LL-37为模板,设计出新肽LLv,序列为:LLGDFFKKSKEKIGKEFKRIVQRIKDFLRNLVP RTEK。然后选用大肠杆菌偏好密码子,将含抗菌肽LLv基因及限制性内切酶SacⅠ(restriction endonucleaseSacⅠ)、XhoⅠ酶切位点的质粒 pUC57(pUC57-LLv)委托生工生物工程(上海)股份有限公司合成。
1.4 重组质粒表达载体pSUMO-LLv的构建
提取质粒pUC57-LLv,以其为模板,应用聚合酶链式反应(polymerase chain reaction,PCR)扩增目的基因,25 μL PCR扩增体系,上游引物为5′-GAGCTCCTGCTGGGCGATT-3′;下游引物为5′-GTGGCTCTTCTTTGAGCT-3′,扩增片段长度为126 bp。提取质粒pSUMO,用限制内切酶SacⅠ、XhoⅠ双酶切质粒pSUMO和回收PCR产物LLv基因片段,双酶切反应体系为50 μL酶切体系。回收双酶切产物后,将目的基因LLv与质粒SUMO按照10 μL体系进行连接,连接产物转化E.coliDH5α感受态细胞。提取重组质粒,将酶切鉴定后的pSUMO-LLv阳性克隆送TSINGKE公司测序。
1.4.1 PCR扩增体系
PCR扩增体系(总体积25 μL):上下游引物各1 μL,引物浓度为10 μmol/L,模板2 μL,rTaq酶12.5 μL,ddH2O 8.5 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共30个循环;72 ℃延伸5 min。
1.4.2 重组质粒双酶切反应体系
重组质粒双酶切反应体系(总体积50 μL):质粒20 μL,10x Buffer 5 μL,SacⅠ、XhoⅠ各2.5 μL,ddH2O 20 μL。
1.4.3 连接反应体系
连接反应体系(总体积10 μL):T4 Buffer 1 μL,T4连接酶0.5 μL,目的片段(LLv)6 μL,SUMO 2.5 μL。
1.5 E. coli BL21(DE3)表达融合蛋白SUMO-LLv条件的优化
1.5.1 不同异丙基硫代半乳糖苷(isopropyl beta-D-thiogalacyranoside,IPTG)浓度对E.coliBL21(DE3)表达融合蛋白SUMO-LLv的影响
将鉴定为阳性的重组质粒pSUMO-LLv转化至E.coliBL21(DE3)感受态细胞,阳性克隆接种于5 mL LB(含50 μg/mL卡那霉素)液体培养基中,37 ℃、200 r/min振荡培养过夜。当OD600值达到0.6左右时加IPTG至终浓度为0 mmol/L、0.5 mmol/L、1.0 mmol/L 、2.0 mmol/L,在37 ℃诱导2 h后各取样1 mL,进行聚丙烯酰胺凝胶电泳分析。表达上清液在DNA/RNA微量定量仪上测定蛋白含量。每个浓度做三个重复,结果取平均值。
1.5.2 融合蛋白SUMO-LLv表达的可溶性分析
将诱导后的菌体超声破碎后,10 000 g离心10 min,上清液和沉淀分别进行SDS-PAGE电泳分析,利用DNA/RNA微量测定仪分别测定上清液和沉淀中融合蛋白的含量。
1.5.3 不同IPTG诱导时间对E.coli表达融合蛋白SUMO-LLv的影响
将pSUMO-LLv阳性克隆培养至OD600值达到0.6左右时,加IPTG至终浓度0.5 mmol/L,在37 ℃条件下诱导,分别于2 h、4 h、8 h及过夜后,取样1 mL进行SDS-PAGE电泳分析;将表达上清液在DNA/RNA微量定量仪上测定蛋白含量。每个诱导时间做三个重复,结果取平均值。
1.5.4 免疫印迹试验Western-Blot鉴定
将样品10 000 g离心10 min,将菌体重悬8 mL PBS中,超声破碎后,10 000 g离心10 min,上清液和沉淀各取30 μL,加入10 μL的4xSDS缓冲液,于沸水煮沸10 min。SDS-PAGE电泳,然后转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上。恒流300 mA,冰上转膜1.5 h,将PVDF膜漂洗5次,每次3 min,在5%牛血清白蛋白封闭液中过夜;次日将PVDF膜用PBST缓冲液漂洗5次,每次3 min,以小鼠抗His标签抗体(Anti his-tag mouse mAb,HIS)为一抗(1∶1 000),室温摇床孵育2 h;弃去一抗,将PVDF膜漂洗5次,每次3 min;加入辣根过氧化物酶(Horseradish Peroxidase,HRP)标记鼠抗IgG为二抗(1∶1 000),室温孵育2 h;将PVDF膜漂洗5次,每次3 min;用二氨基联苯胺染色。
1.5.5 融合蛋白SUMO-LLv的分离纯化
将Ni柱树脂充分摇匀,加入直径为1.5 cm的层析柱中,至终体积为2 mL;用5倍柱体积的去离子水清洗;用8倍柱体积的Binding Buffer(20 mmol/L Tris,500 mmol/L NaCl,10 mmol/L咪唑,pH值8.0)平衡;加入纯化的重组蛋白SUMO-LLv样品,控制其流速为0.5 mL/min,收集样品流出液,采用SDS-PAGE分析;用10倍柱体积的Wash Buffer(20 mmol/L Tris,500 mmol/L NaCl,20 mmol/L咪唑,pH值8.0)清洗,收集清洗液,采用SDS-PAGE分析;用5倍柱体积的Elution Buffer(20 mmol/L Tris,500 mmol/L NaCl,250 mmol/L咪唑,pH值8.0)洗脱,收集洗脱液,获得目的蛋白LLv,采用SDS-PAGE分析。
2 结果与分析
2.1 重组表达载体pSUMO-LLv的构建
PCR扩增结果见图1,由图可知,含LLv基因的pUC57质粒可以被限制性核酸内切酶XhoⅠ正确切割,对重组质粒DNA测序显示质粒的基因序列与设计的一致,证明重组表达的质粒pSUMO-LLv构建成功。
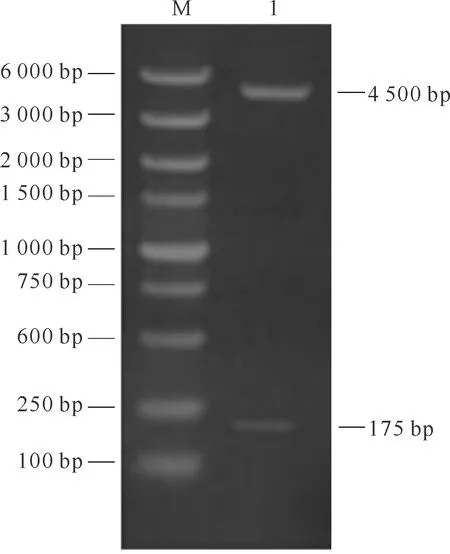
注:M.蛋白质marker;1.被切割的含LLv基因的pUC57质粒。
2.2 融合蛋白SUMO-LLv诱导表达条件优化
不同IPTG浓度对E.coli表达融合蛋白SUMO-LLv的影响见图2,由图可知,1组(空白对照组)不表达,0.5 mmol/L、1 mmol/L、2 mmol/L组的表达量基本一致,分别为9.66 μg/mL、9.60 μg/mL、9.66 μg/mL。考虑IPTG成本较高,以0.5 mmol/L浓度的IPTG为佳。
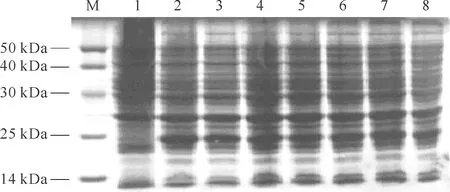
注:M.蛋白质marker;1.未诱导;2-4分别为0.5 mmol/L、1mmol/L、2mmol/L IPTG诱导;5-8分别为诱导2 h、4 h、8 h和过夜。
不同诱导时间对E.coli表达融合蛋白SUMO-LLv的影响见图2,由图可知,4组诱导时间(2 h、4 h、6 h、过夜)均可表达出融合蛋白,且表达量基本一致,分别为11.26 μg/mL、11.19 μg/mL、11.20 μg/mL、11.21 μg/mL。诱导时间以2 h为佳。
2.3 融合蛋白SUMO-LLv诱导表达的可溶性分析
使用2.2筛选出的最佳诱导条件:诱导剂IPTG浓度为0.5 mmol/L,诱导温度为37 ℃;诱导2 h的表达产物,超声波破碎后进行的SDS-PAGE电泳分析结果见图3。由图可以看出上清液和包涵体中在25 kDa至30 kDa之间均有融合蛋白SUMO-LLv表达,且上清液中条带颜色比包涵体深,说明上清液中融合蛋白SUMO-LLv的表达量高。另外,通过DNA/RNA微量定量仪测定,上清液中融合蛋白SUMO-LLv的含量为11.34 μg/mL,包涵体含量为3.53 μg/mL,进一步证明融合蛋白SUMO-LLv存在于上清液中。因此,SUMO-LLv主要以可溶性表达。
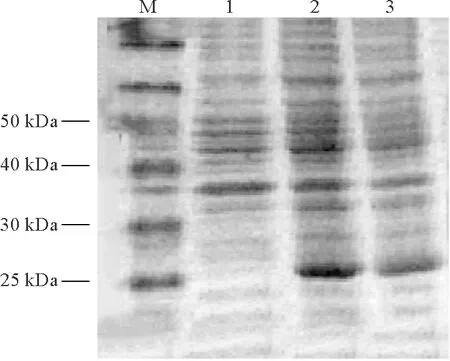
注:M.蛋白质marker;1.BL21(DE3)对照;2.上清液;3.包涵体。
2.4 融合蛋白SUMO-LLv的Western-Blot和分离纯化的结果
如图4所示,经Western-Blot鉴定,将转印好的PVDF膜经一抗二抗孵育,染色后在25~30 kDa之间有一条蛋白质条带,与目的蛋白大小一致。这说明表达出了融合蛋白SUMO-LLv,同时证明了表达产物具有良好的反应原性。

注:M.蛋白质marker;1-3.BL21(DE3)/LLV IPTG诱导。
图4显示大肠杆菌中融合蛋白SUMO-LLv主要以可溶性表达的形式存在,用SUMO蛋白酶I和终浓度2 mmol/L的DTT酶解,经SDS-PAGE电泳分析,重组蛋白SUMO-LLv样品、酶切液和目标肽LLv的SDS-PAGE电泳分析结果(图5)显示:获得了5 kDa目的蛋白LLv。

注:M.蛋白质marker;1.样品;2.酶切液;3.目的蛋白LLv。
3 讨论与结论
诱导剂IPTG浓度过低时,E.coli无法最大化分泌外源蛋白,但IPTG浓度过高会对E.coli有抑制作用[14]。本试验发现随着IPTG浓度的升高,融合蛋白表达量基本保持不变,因此认为0.5 mmol/L IPTG为最佳诱导浓度。
据报道IPTG诱导表达时间对外源蛋白的表达量具有一定影响,随诱导时间的延长外源蛋白表达量逐渐增多,但也会不断降解[15]。万健[16]报道利用SUMO融合技术在E.coli中表达抗菌肽SMAP-29,随着诱导表达时间的增加其表达量并没有明显变化。本试验亦采用了SUMO融合技术,发现诱导时间从2 h至过夜,蛋白的表达量基本一致。据报道,诱导时间越长,抗菌肽对菌体的毒害时间越长,且菌体量虽然增加,但相对表达量并没有增高,而且后续分离纯化消耗大[17]。因此,在延长表达时间对表达量没有明显提高的条件下,IPTG诱导时间宜短不宜长,因此本试验最佳表达时间为2 h。
Ni柱亲和层析具有吸附性强、分离条件容易满足且不影响蛋白质自身的生物活性等诸多优点[18]。本试验采用的表达载体SUMO自身带有6xHis标签,该标签可与目的蛋白LLv结合,在纯化时携带目的蛋白LLv吸附在Ni柱上,因此利用Ni柱亲和层析纯化重组融合蛋白SUMO-LLv,纯化效果较好。
利用E.coli表达抗菌肽,具有操作方便、价格低廉等优点,能够高效获得重组抗菌肽LLv。但E.coli表达系统亦存在缺点,如E.coli表达的蛋白需经过化学试剂切割才能得到目的蛋白[19-20]。本试验为了防止抗菌肽直接杀死E.coli,将重组抗菌肽LLv加上6xHis标签蛋白,但是添加标签蛋白后,在提纯时要把标签蛋白与目的蛋白分离,增加了目的蛋白的提纯难度。
本试验采用了SUMO融合技术构建重组表达载体pSUMO-LLv,经DNA测序验证,SUMO-LLv表达载体构建正确;SUMO-LLv诱导表达的最佳反应条件为:IPTG浓度0.5 mmol/L,诱导表达时间为2 h;融合蛋白SUMO-LLv主要存在于上清液中,以可溶性表达,含量为11.34 μg/mL;采用Western-Blot鉴定证明融合蛋白具有良好的反应原性;采用Ni柱亲和层析法在诱导菌液中成功纯化到了目的蛋白LLv,目的蛋白大小为5 kDa。

