卵泡大小、COCs形态和IGF-1、E2添加对驴卵母细胞体外成熟的影响
李国超,朱新远,赵珊珊,刘艺丹,董焕声,潘庆杰
(1.青岛农业大学动物科技学院,山东青岛 266109;2.荣成畜牧局,山东荣成 264300 )
我国有4 000多年的养驴历史,至少拥有24个地方知名品种,一直是养驴大国[1]。但随着机械时代的加快,驴的役用功能被机械取代,其饲养量在我国越来越少,存栏量从1991年的1 120万头(历史最高)下降到2018年的253.3万头,降幅接近80%[2],目前存栏量不足世界(4 412.56万头)的6%[3]。繁殖力低是制约马驴业发展的主要因素之一[4]。母驴通常2.5~3.0岁到适配年龄,三年两胎,每胎一驹,导致现有驴群的扩繁速度慢。驴在每一个发情周期会有数十个卵泡同时发育,这些卵泡质量上没有明显差异,只是在优势卵泡出现以后其他卵泡才逐渐闭锁。如果将这些卵泡在发生闭锁之前从活体中取出,然后在体外培养成熟和体外受精,将获得的早期胚胎移入受体子宫内,大大提高具有优良生产性状的驴的繁殖速度。根据驴卵泡发育规律,一般每10~15 d可以取卵1次,每次能获得6~10枚卵母细胞,受精后能获得可移植囊胚1~2枚,将大大提高驴的扩繁速度。
卵母细胞的体外成熟(invitromaturation of oocytes,IVM)是充分利用驴卵母细胞资源的重要步骤之一[5]。关于卵母细胞的体外成熟,有较多影响因素,卵母细胞成熟液中激素与生长因子的选择、卵巢卵泡直径大小的选择、卵母细胞的培养方式等都对卵母细胞的体外成熟产生一定影响。对于卵泡的选择,Dunning等[6]研究证明,卵巢深层皮质小卵泡内卵母细胞在体外发育时,往往具有较高的体外成熟率。哺乳动物卵母细胞从卵泡分离后体外发育成熟的能力已被广泛评估,尽管这些卵母细胞在体外经过培养完成了自身的核成熟,但它们大部分没有达到完全的细胞质成熟[7]。胰岛素生长因子(insulin-like growth factor, IGF-1)在卵巢中不单单对卵泡的生长发育具有调节作用,同时IGF-1可通过促进颗粒细胞(granular cells, GCs)的有效分裂,促进卵母细胞的胞质成熟[8]。卵母细胞体外成熟能力还取决于初始卵丘GCs形态,卵母细胞恢复时的卵泡直径大小[9],因此研究卵泡直径大小、IGF-1浓度是提高是和完善卵母细胞体外成熟必要的途径。目前马属动物繁殖技术的相关研究多集中在马上,驴卵母细胞体外成熟的相关研究较少。鉴于驴肉、驴皮和驴奶的商业价值,以及对驴品种快速扩繁的需求,对驴进行体外辅助生殖技术尤其是卵母细胞体外成熟的研究具有重要意义。
本试验通过驴卵丘卵母细胞复合体(cumulus oocyte complex, COCs)体外成熟培养,探索了发情与非发情季节不同大小卵泡内不同类型卵母细胞的体外发育成熟情况,以及添加不同浓度IGF-1、E2对卵母细胞成熟的影响。通过比较分析,得到不同季节如何高效成熟培养体外COCs的方案,并维持稳定的体外成熟率。
1 材料与方法
1.1 试验材料
试验样本取自青岛市屠宰场,选取刚刚屠宰成年驴(3~8岁)卵巢,并在4 h内通过保温桶运回实验室(保温桶温度保持在25~30 ℃,保存介质为生理盐水并加有青链霉素混合液)。
1.2 试剂与药品
青链霉素混合液体(双抗)、线粒体红色荧光探针(Mito-TrackerTMRed CMXRos)、Triton X-100、Hoechst33342、多聚甲醛均购自索莱宝公司;氯化钠注射液(生理盐水),购自辰欣药业股份有限公司;Medium199/EBSS(SH30253.01)购自Hyclone公司;促黄体生成素(luteinizing hormone,LH)、促卵泡素(follicle stimulating hormone,FSH)均购自RayBiotech公司;IGF-1、非必需氨基酸溶液(non-essential amino acid solution,MEM)、表皮生长因子(epidermal growth factor,EGF)、E2、丙酮酸钠、透明质酸酶、甘氨酸、胎牛血清(fetal bovine serum,FBS),均购自Sigma公司;卵泡液采自1~3 cm卵泡,经12 000 r/min,离心15 min,0.45 μm滤器过滤,-20 ℃保存。
1.3 主要仪器
体视显微镜(奥林巴斯公司,日本)、恒温水浴锅(龙口先科公司,中国)、电子天平(奥豪斯公司,美国)、超净工作台(哈尔滨市东联电子技术开发有限公司,中国)、CO2培养箱(赛默飞世尔科技有限公司,中国)等。
1.4 卵母细胞体外培养
1.4.1 卵巢的前期处理
将驴卵巢从保温桶中取出,用已添加双抗并预热的生理盐水清洗卵巢2~3次,洗去表面的污渍与血块,剪掉卵巢表面的白膜以及明显的血管。随后将卵巢放入9 cm培养皿中,用标尺进行卵泡大小的测量,卵泡直径≤1 cm称之为小卵泡,卵泡直径在1~3 cm范围内称之为中卵泡,卵泡直径≥3 cm称之为大卵泡,测量完成后,用生理盐水清洗卵巢2遍,放入小烧杯中,加入生理盐水,置于38.5 ℃水浴锅保温,以备后期试验。
1.4.2 卵母细胞获取
卵母细胞的获取方法有两种:分别是抽吸法与切割法。
抽吸法:用手触及卵巢,选取突出卵巢表面,肉眼可见的凸起卵泡,记录数量,选用20 mL(18G针头)注射器,将针头从卵泡的下侧或卵巢介质穿刺吸取卵泡液,吸取卵泡液的同时用针头刮取卵泡内侧面,以确保卵母细胞全部收集。
切割法:将抽吸完成的卵巢用生理盐水清洗一遍,将卵巢平铺放入9 cm的培养皿中,用手术刀从右向左进行切片式切割,切割卵巢内部小卵泡时用生理盐水进行冲洗,将冲洗后的液体收集到集胚皿中。切割结束,将集胚皿中的液体使用生理盐水反复冲洗,直到液体明亮,在体视镜下进行卵母细胞的收集。
根据卵母细胞表层的GCs扩散形态与层数将收集的卵母细胞分为三类,分别是扩展型卵母细胞(expanded cumulus cocyte, ExCOCs),外周GCs大于2层且扩散形状为松散状;紧凑型卵母细胞(compact cumulus oocyte, CpCOCs),外周GCs少于2层且扩散状态为紧缩状;裸卵(无GCs包被),将收集到的裸卵丢弃,其他用作培养。
1.4.3 试验分组
试验一:根据卵泡直径大小将卵泡分为≤1 cm、1~3 cm、≥3 cm的三个组,分别收集三种卵泡内ExCOCs与CpCOCs,共同培养后分组统计第一极体排出率。
试验二:将卵母细胞类型进行划分,分为Ex与Cp两种类型,成熟培养后分别统计第一极体排出率。
试验三:在不同的季节分别共同培养Ex与Cp两种类型COCs,成熟培养后统计不同季节的第一极体排出率。
试验四:选取大于两层GCs包被的COCs分三个组,分别添加50 ng/mL、100 ng/mL、200 ng/mL的IGF-1,以配制三种不同浓度成熟液,用作COCs体外成熟培养,统计第一极体排出率。
试验五:选取大于两层GCs包被的COCs分三个组,分别添加0.1 μg/mL、1 μg/mL、10 μg/mL的E2,以配制三种不同浓度成熟液,用作COCs体外成熟培养,统计第一极体排出率。
试验六:通过分析比较确定添加物IGF-1和E2浓度后,在成熟液中加入6 mmol/mL的甘氨酸(glycine,Gly),观察线粒体胞质内定位,统计第一极体排出率。六组试验每组设置三次重复,以保证数据的准确性。
1.4.4 卵母细胞的体外成熟培养
采用的基础成熟液配方为M199、10% FBS、0.01 IU/mL FSH、0.01 IU/mL LH、100 ng/mL EGF、0.11 mg/mL 丙酮酸钠、1%双抗、1 mL卵泡液上清、1% MEM。在基础成熟液配方中分别添加相应浓度试验要求的激素、生长因子试剂制备成熟培养液。取500 μL成熟培养液加入到四孔板中,并覆盖300 μL石蜡油,培养箱中预热4 h;用成熟液把收集的COCs冲洗三遍,转入四孔板,置于38.5 ℃、5% CO2恒温培养箱培养36 h。
1.4.5 成熟卵母细胞的筛选
COCs在培养箱成熟培养28~36 h后,每10个COCs一组转移到装有300 μL 0.1%透明质酸酶的1.5 mL离心管中,用200 μL移液枪反复吹打50次,去除COCs周围的卵丘GCs。吹打结束,用含有5% FBS的M199清洗COCs三次,置于显微镜下进行观察。以第一极体排出、胞质均匀、透明带清晰为成熟标准,记录每次成熟卵母细胞个数,统计并计算成熟率。
1.4.6 卵母细胞线粒体荧光染色
去除GCs的卵母细胞在含有MitoTracker的IVM培养液中培养45 min进行线粒体标记。
标记结束后,用1% BSA的PBS液冲洗卵子三次,每次5 min。冲洗后,用4%的多聚甲醛对卵母细胞室温下固定1 h。再用10 μg/mL的Hoechst33342进行核染色5 min,再用1% BSA的PBS液冲洗三次,每次3 min。抗荧光淬灭剂进行卵母细胞的封片保存,激光共聚焦显微镜下进行荧光染色分析。
1.5 数据整理
采用GraphPad Prism 8.0.2 进行绘图,使用SPSS 25.0的t检验方法与单因素方差分析方法对试验数据进行分析,检测不同组的差异显著性,结果采用平均数±标准误差表示,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 不同直径卵泡内卵母细胞类型差异分析
卵泡直径≤1 cm、≥3 cm的卵泡内ExCOCs外周卵丘GCs大约有两层,卵泡直径在1~3 cm的卵泡内ExCOCs外周卵丘GCs大约有三到四层,而且卵泡直径在1~3 cm的卵泡内ExCOCs外周卵丘GCs层最多(图1A—图1C′)。在卵泡直径≤1 cm、≥3 cm的卵泡内CpCOCs外周的卵丘GCs大约有一层,直径在1~3 cm的卵泡中,CpCOCs外周卵丘GCs只有一到两层,卵泡直径在1~3 cm的卵泡内CpCOCs外周的卵丘GCs层数相对较多(图1 D—图1F′)。

注: A,A′,D,D′:≤1c m卵泡及其中采集的卵母细胞;B,B′,E,E′:1~3 cm卵泡及其中采集的卵母细胞;C,C′,F,F′:≥3cm卵泡及其中采集的卵母细胞。Ex:扩散型卵母细胞;Cp:紧凑型卵母细胞。 Bar=50 μm。
2.2 不同大小卵泡对COCs第一极体排出率的影响
通过不同直径卵泡内卵母细胞体外培养后第一极体排出率差异比较,由表1所示,直径在1~3 cm的卵泡中,COCs的第一极体排出率为(45.33±3.34)%,与直径≥3 cm和直径≤1 cm卵泡COCs组第一极体排出率有极显著差异(P<0.01),而直径≥3 cm卵泡COCs组与直径≤1 cm卵泡COCs组之间也存在极显著差异(P<0.01)。结果表明:三种规格卵泡内COCs在体外进行培养时,应选择1~3 cm卵泡内COCs,可获得较高的COCs体外成熟率。

表1 不同大小卵泡对COCs第一极体排出率的影响
2.3 不同类型COCs对第一极体排出率的影响
通过对不同类型COCs体外培养后第一极体排出率差异比较,ExCOCs组第一极体排出率为(54.26±2.41)%,与CpCOCs组具有极显著性差异(P<0.01,表2)。结果表明:ExCOCs组外周颗粒细胞状态良好,良好的扩散形态可以促进COCs的体外成熟。

表2 不同类型COCs对第一极体排出率的影响
2.4 不同季节对COCs第一极体排出率的影响
通过对不同季节COCs培养后第一极体排出率差异比较,在发情季节,COCs体外第一极体排出率为(48.86±1.03)%,极显著高于非发情季节COCs的体外成熟率(29.03±2.44)%(P<0.01,表3)。结果表明:在发情季节,COCs获得体外成熟的能力高于非发情季节。

表3 不同季节对COCs第一极体排出率的影响
2.5 E2对COCs第一极体排出率的影响
通过在成熟液中添加不同浓度E2培养后第一极体排出率结果差异比较,在发情季节,对照组第一极体排出率为(42.72±3.18)%,与0.1 μg/mL、1 μg/mL、10 μg/mL浓度添加组相比均无显著差异(P>0.05)。在非发情季节,1 μg/mL浓度添加组第一极体排出率为34.00%,与对照组、0.1 μg/mL、10 μg/mL浓度添加组具有极显著差异(P<0.01)(见图2)。结果表明:在非发情季节,添加1 μg/mL的E2可显著提高COCs体外成熟率。
注:**表示差异极显著(P<0.01)。下同。图2 添加不同浓度E2对卵母细胞体外第一极体排出率的影响
2.6 IGF-1对COCs第一极体排出率的影响
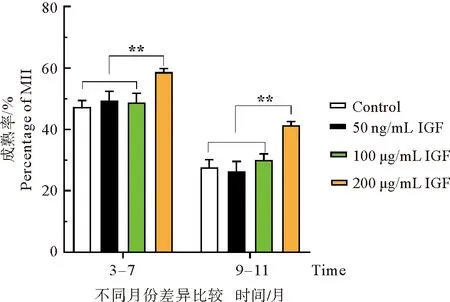
通过在不同季节成熟液中添加不同浓度IGF-1培养后第一极体排出率结果差异比较,在发情季节(3—7月),200 ng/mL浓度添加组第一极体排出率为58.67%,与对照组47.33%、50 ng/mL浓度添加组49.33%、100 ng/mL浓度添加组48.67%相比,具有极显著差异(P<0.01)。在非发情季节(11—12月),200 ng/mL组第一极体排出率为41.33%,与对照组27.67%、50 ng/mL组26.33%、100 ng/mL组30.00%相比,具有极显著差异(P<0.01,图3)。结果表明:在发情季节与非发情季节,成熟液体系中添加200 ng/mL的IGF-1均可显著提高COCs体外成熟率。

图3 添加不同浓度IGF-1对卵母细胞体外第一极体排出率的影响
2.7 Gly对COCs第一极体排出率与线粒体分布的影响
对照组与添加Gly组COCs培养36 h之后,卵丘GCs的扩散状态有一定差别,Gly组的COCs卵丘GCs扩散比较完整,对照组的COCs卵丘GCs扩散较为浓缩。Gly组卵丘GCs扩散良好可更好的支持COCs成熟过程中。卵丘GCs将成熟液中大部分葡萄糖转化为丙酮酸,为COCs生长发育提供足够的能量,而对照组卵丘GCs扩散较少则不能高效地转化自身发育所需要的丙酮酸,所以Gly对卵丘GCs的扩散有一定影响从而影响COCs自身的成熟。通过对比Gly组与对照组第一极体排出率差异比较,Gly组第一极体排出率为53.33%,与对照组无显著差异(P>0.05)(见图4)。

注:Ctrl:对照组;Gly:甘氨酸组。Bar=50 μm。
通过对添加Gly组与照组线粒体定位分析,两组线粒体均成簇分布在细胞质周边,细胞核周围较为丰富,均具有成熟卵母细胞线粒体分布的特征。通过线粒体荧光分布分析,Gly组的线粒体荧光强度要大于对照组。若对卵母细胞进行发育能力评价,Gly组继续发育的能力可能要显著高于对照组。在卵母细胞体外成熟液中添加Gly,一定程度上会轻微抑制卵丘GCs的发育,但对卵母细胞总体达到成熟并无影响(见图5)。

注:Ctrl:对照组;Gly:甘氨酸组。Bar=50μm。
3 讨论与结论
3.1 卵泡大小对第一极体排出率的影响
在发情季节与非发情季节,驴卵巢上卵泡大小具有差异性。在发情季节,卵泡数量要比非发情季节多,这是由于动物处于发情季节,自身调控分泌的促黄体生成素较多,能显著促进卵泡的生长并最终排卵,这与卵泡的排卵机制也是相符合的[10]。关于COCs发育能力,据报道来自卵巢内部小卵泡内的COCs具有较高的减数分裂能力[11],本研究中,与非发情季节直径≤1卵泡内COCs的减数分裂能力结果是一致的。直径≥3 cm的卵泡内获得的COCs第一极体排出率与直径在1~3 cm的卵泡具有差异性,原因是直径≥3 cm卵泡内COCs可能已经获得减数分裂能力,而再经过体外培养,一定程度上导致了COCs自身程序性退化。
3.2 COCs类型对第一极体排出率的影响
卵丘GCs的扩散情况在一定程度上直接决定了COCs后期的发育能力,卵丘GCs层数的饱满度有利于COCS与GCs的双向通讯,同时这种细胞间双向通讯控制着GCs与COCs的发育,对COCs的发育至关重要。定义卵母细胞发育能力的核心特征是初培养时卵母细胞质量[12],卵母细胞的质量好坏一般可在显微镜下来判断。卵母细胞的类型分为Ex与Cp,其减数分裂能力各不相同,这种差异可能与它们自身的葡萄糖代谢有关。CpCOCs在成熟过程中,相比ExCOCs消耗更多的葡萄糖以及堆积大量的乳酸[13]。本研究中,ExCOCs组第一极体排出率显著高CpCOCs组,这与先前的研究也是相符合的,ExCOCs周围有较多的GCs,可为GCs与COCs间的高效糖代谢提供保障[14],从而促进卵母细胞的体外成熟。
3.3 不同季节对第一极体排出率的影响
驴属于季节性多次发情动物,且繁殖周期长,一般在每年的3—9月进入发情期,但一般在4—7月进入发情旺期,发情时间一般可持续5~8 d,其他月份可认定为乏情期[15]。在发情季节,卵母细胞与颗粒细胞会存在一种完全功能性的通讯,而在非发情季节,大约有一半的卵母细胞与颗粒细胞间的这种通讯会被完全打断[16],从而影响卵母细胞的体外成熟,这种通讯存在与否,是由季节决定的,所以在不同季节上,卵母细胞体外培养会表现出不一样的发育能力,在发情季节,卵母细胞的体外成熟能力极显著的高于非发情季节。
3.4 E2对第一极体排出率的影响
发情季节在成熟液配方中添加E2,对驴卵母细胞的体外成熟无显著影响,原因可能是是E2可通过雌激素核受体影响DNA的甲基化水平,导致纺锤体的组装异常,最后影响卵母细胞的体外成熟[17]。由于E2是调控雌性动物生殖过程的重要激素之一,E2对卵母细胞成熟过程以及卵母细胞后续发育潜能的获得具有重要的作用。在非发情季节向培养液中添加1 μg/mL E2,能够有效促进COCs 的卵丘扩展,激发卵母细胞后续发育的潜能[18],能一定程度上提高COCs的体外成熟率。说明在非发情季节卵丘扩展的程度与E2浓度在一定范围内呈正相关,但E2提高卵丘扩展水平的具体机制尚不明确。
3.5 IGF-1对第一极体排出率的影响
IGF-1在体内卵泡发育过程中主要由GCs分泌,且会随着卵泡的逐渐发育IGF-1浓度逐渐增加。通过在不同季节添加IGF-1的浓度,说明在发情季节,卵母细胞对于IGF-1的需求更高,而在非发情季节,添加IGF-1能显著提高体外成熟率,因此,不同季节添加IGF-1生长因子,均能显著提高卵母细胞细胞质成熟,实现卵母细胞细胞质与细胞核的同步成熟,进而提升整体COCs的体外成熟率。证明IGF-I可通过诱导丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)的积累来改善卵母细胞的细胞质成熟[19],所以成熟液中添加IGF-1对卵母细胞体外成熟具有促进作用。
3.6 Gly对第一极体排出率的影响
Gly是卵泡液中含量较高的一种氨基酸,可通过改善线粒体功能,降低卵丘GCs的凋亡,对卵母细胞体外成熟具有重要作用。线粒体聚集分布表明线粒体分布活跃,这些活跃的线粒体大都分布在胞质中央或者细胞核周围,这种分布现象被评估为细胞质成熟的标志。在卵母细胞的体外成熟过程中,添加Gly可显著提高细胞质中线粒体活性,本研究发现,添加了Gly组的卵母细胞的线粒体活性水平偏高。在牛卵母细胞体外成熟研究中,线粒体在未成熟卵母细胞细胞质中的含量特别低,且呈分散存在,而成熟后牛的卵母细胞胞质中线粒体含量较高,并呈聚集分布[20]。在猪的卵母细胞体外成熟过程中,在成熟液中添加Gly可以显著提高猪卵母细胞体外成熟质量和卵丘扩散情况[21],这与本试验结果一致。在驴的卵母细胞体外成熟过程中,添加6 mmol/mL的Gly与对照组第一极体排出率虽无显著差异,但可以促进卵母细胞卵丘颗粒的扩展,保证卵母细胞内的能量供应。
本试验结果表明:体外培养卵母细胞时,选择发情季节卵泡直径范围1~3 cm卵泡内的扩展型卵母细胞更具优势,可获得较高的卵母细胞体外成熟率;通过对E2与IGF-1的浓度探究,筛选出最适合的成熟液添加1 μg/mL E2与200 ng/mL IGF-1;添加6 mmol/mL的Gly可提高卵母细胞体外成熟的质量,但对整体成熟率无影响。本试验建立了完善卵母细胞体外培养体系,保证了在发情季节COCs的体外成熟率最高可以达到60%,非发情季节可以达42%,研究结果为后期驴体细胞核移植奠定基础。

