pH响应红色荧光碳点的制备及对敌敌畏的检测
徐香,王路瑶,孙钦星,李伟娜
(青岛农业大学化学与药学院,山东青岛 266109)
有机磷类化合物是一类有效的广谱杀虫剂,在世界范围内被广泛应用于农业、水产养殖和畜牧业,它可以促进胆碱酯酶的磷酸化并使胆碱酯酶失活,引起乙酰胆碱的累积,从而消除病虫害[1-2]。然而,有机磷农药的长期大量使用不可避免地在作物、土壤和水体中富集和残留,给生态、环境和人类健康带来严重危害。为了有效保护环境、监测食品质量和保障公众健康,开发快速、灵敏的有机磷农药检测策略变得越来越紧迫。目前,通常采用高灵敏度分析技术检测有机磷农药的存在,如高效液相色谱法(HPLC)[3]、气相色谱-质谱法(GC/MS)[4]、液相色谱-质谱法(LC/MS)[5]、酶联免疫吸附测定法(ELISA)[6]和电化学分析[7]等。这些传统的基于仪器的技术通常需要复杂的设备、昂贵的检测器、烦琐的样品预处理程序和专业的技术人员[8]。另外:ELISA还需要高成本、长时间的抗体制备过程,且容易受环境和基质成分的影响[9];电化学分析法需要复杂的电极修饰程序和标记过程,并且存在假阳性效应[10]。上述问题限制了这些分析技术在常规安全监控和实时监测领域的应用。
荧光检测法具有操作简单、灵敏度高、成本低等优点[11],可以很容易地将分子检测信息转化为荧光强度信号,而传统有机/聚合物荧光探针制备过程复杂、水溶性差、聚集易引起荧光猝灭[12]。因此,开发具有明亮的长波发射、良好的生物安全性和水溶性的荧光发射基团,对理想的荧光传感器至关重要[13]。碳点是一类粒径小于10 nm的发光碳纳米材料,它除了具有高量子产率和发射波长可调等性质,还具有优异的光稳定性、低细胞毒性、良好的生物相容性、环境友好和高化学惰性等优点[14]。并且,碳点表面存在的大量基团、聚合物链,如羧基、羟基等,赋予了碳点良好的水溶性和后修饰性能[15-17]。吉林大学的闫旭和江苏大学的石吉勇课题组分别将碳点与二硫代硝基苯甲酸发光化合物、金纳米粒子复合,利用荧光和比色双通道法检测有机磷农药[18-19]。这些工作为碳点在有机磷农药检测方面的应用打下了良好的基础,然而用于有机磷农药检测的碳点发射波长小于600 nm,很容易受到蓝紫色背景荧光的干扰,难以在实际场景中应用[20-24]。
本文以一水合柠檬酸和尿素为原料,采用一锅溶剂热法合成发射波长大于600 nm的红色荧光碳点,利用红外光谱、X射线光电子能谱图、紫外-可见光谱、荧光发射光谱对碳点的结构和性能进行表征,并对碳点的酸碱响应特性和敌敌畏检测性能进行深入探究。
1 材料与方法
1.1 试剂与仪器
所有试剂和化学品均为分析纯。一水合柠檬酸(C6H8O7·H2O)、尿素、氢氧化钠(NaOH),天津巴斯夫化工股份有限公司;敌敌畏(C4H7Cl2O4P),西格玛奥德里奇(上海)贸易有限公司。
Nicolet iS10傅里叶变换红外光谱议(FTIR),波数扫描范围500~4 500 cm-1,美国赛默飞世尔科技公司;U-3900紫外-可见光谱仪(UV-Vis),波长扫描范围200~700 nm,日本日立;F-7000荧光光谱仪,波长扫描范围300~700 nm,狭缝宽度10 nm,日本日立;PHI Quantera II X射线光电子能谱仪(XPS),日本Ulvac-Phi股份有限公司;JEM-2100F透射电子显微镜(TEM),Tecnai-G2-F30显微镜,加速电压200 kV,日本电子株式会社。
1.2 试验方法
1.2.1 红色荧光碳点的制备
采用一锅溶剂热法合成红色荧光碳点(R-CDs)。将2.10 g 10.0 mmol的一水合柠檬酸和3.00 g 50.0 mmol的尿素溶解在20 mL N,N-二甲基甲酰胺(DMF)中,超声30 min,使样品充分溶解;将混合液转移到使用聚四氟乙烯为内衬的50 mL不锈钢反应釜中,180 ℃加热8 h,自然冷却至室温,获得暗红色溶液;过0.22 μm微孔滤膜后,添加至200 mg/mL的氢氧化钠溶液中,16 000 r/min离心20 min,收集沉淀,冷冻干燥,即为红色荧光碳点。所得R-CDs配制成高浓度的溶液,4 ℃冷藏保存,备用。
1.2.2 红色荧光碳点的酸碱响应性质检测
室温下,将0.5 mL 10 mg/mL的R-CDs溶液添加至5.0 mL缓冲溶液中,缓冲溶液的pH值依次为2.0、3.0、4.0、5.0、6.0、7.0和8.0,混合均匀,室温下孵育5 min。设置激发光波长540 nm,测试R-CDs的荧光光谱;分别使用浓度为1.0 mol/L的HCl和NaOH溶液调节R-CDs溶液,使其pH值在2.0和7.0之间循环4个周期,测试R-CDs荧光强度的酸碱可逆性。每个实验重复3次。
1.2.3 红色荧光碳点对敌敌畏的检测
移取75 μL有机磷农药敌敌畏(浓度为1×10-8~1×10-7mg/mL)和75 μL 7.5 mU/mL的乙酰胆碱酯酶(acetylcholine esterase,AChE),混合均匀,37 ℃孵育30 min;在上述混合液中加入100 μL 2 mmol/mL的乙酰胆碱(thioacetylcholine,ATCh),孵育20 min,最后加入3 mL最佳浓度的R-CDs。设置最优激发波长为540 nm,测试混合溶液体系的荧光强度。
2 结果与讨论
2.1 红色荧光碳点的性能表征
以一水合柠檬酸和尿素为原料,采用一锅溶剂热法合成R-CDs。如图1a所示,R-CDs是均匀分散的球形纳米颗粒,直径为1.0~3.0 nm,平均粒径为2.0 nm。FTIR光谱(图1b)显示:3 300 cm-1附近有一个宽的吸收峰,属于O-H/N-H的伸缩振动;1 605 cm-1处的吸收峰属于C=O的伸缩振动[25];1 450 cm-1和1 365 cm-1处的吸收峰属于N-H和O-H的弯曲振动;1 086 cm-1和1 049 cm-1处的吸收峰分别属于C-N和C-O的伸缩振动。红外光谱结果表明,碳点表面富含-COOH、-OH、-NH2等亲水性基团。

图1 R-CDs的TEM照片(a)和FTIR光谱(b)
通过XPS表征R-CDs表面的元素组成。XPS全扫描光谱显示:R-CDs包含C、N和O 3种元素,相应的原子百分数分别为56.27%、9.48%和34.25%;以285.00 eV、399.85 eV和531.26 eV为中心的3个特征峰分别对应于C1s、N1s和O1s[26];C1s的高分辨光谱(图2a)在284.7 eV、286.4 eV和288.1 eV处的3个吸收峰分别属于C-C/C=C、C-N/C-O和C=N/C=O;N1s光谱(图2b)在398.0 eV、399.4 eV和400.1 eV处显示的3个峰,分别对应于C=N、C-N和N-H;O1s光谱中(图2c),531.2 eV和535.5 eV处的2个特征吸收峰证实了C=O和C-OH的存在。XPS观测结果进一步表明,R-CDs表面富含-COOH、-OH、-NH2等亲水性官能团。
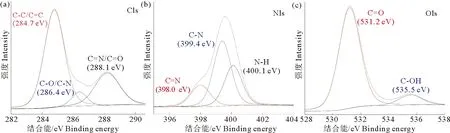
(a)C1s;(b)N1s;(c)O1s。
利用紫外-可见吸收光谱和荧光发射光谱进一步探究R-CDs的光学性质。如图3a所示,紫外-可见光谱在270 nm附近的特征吸收峰属于C=C的π-π*跃迁,在480 nm左右的吸收峰归因于碳点表面杂原子官能团的n-π*跃迁[27]。图3b显示了波长范围为500~580 nm的激发光照射下R-CDs溶液的荧光发射光谱。随着激发波长的增加,R-CDs的荧光发射峰向长波方向移动。当激发波长为540 nm时,R-CDs在605 nm处出现最强的荧光发射峰,且随着激发波长的继续增加,荧光强度逐渐降低。结果表明,R-CDs的荧光发射光谱具有明显的激发波长依赖性,最优激发波长为540 nm,相应的最大发射波长为605 nm。由图3b中的插图可知,在中性环境中,碳点溶液在自然光下呈酒红色,在波长365 nm的紫外灯照射下出现红色荧光。R-CDs的荧光寿命光谱如图3c所示,在波长540 nm的激发光照射下,R-CD荧光的平均寿命为2.05 ns。

(a)紫外-可见吸收光谱;(b)荧光发射光谱,插图为紫外灯(右)和日光灯(左)照射下的图片;(c)荧光寿命光谱。
为筛选R-CDs荧光探针的最佳浓度,对比了R-CDs浓度为20~60 μg/mL时的荧光强度。如图4所示,随着浓度的增加,R-CDs的荧光发射峰位置基本保持不变,荧光强度逐渐增强。当R-CDs的浓度为50 μg/mL时,荧光强度最大。浓度继续增加,荧光强度下降。因此,在后期探针试验中,R-CDs的浓度设置为50 μg/mL。
2.2 基于R-CDs的pH传感器的构建
为进一步探究R-CDs对外界酸碱环境变化的响应,测试了pH值由2.0增加至8.0过程中R-CDs溶液的荧光发射光谱。如图5a、5b所示:当R-CDs溶液pH=2.0时,发生荧光淬灭;pH由3.0增加至8.0过程中,荧光强度保持稳定,发射峰位置轻微蓝移。从图2b的N1s光谱可以看出,R-CDs表面存在着丰富的氮元素,并且以-NH2基团形式存在,它们在强酸性条件下容易结合H+而质子化,从而改变碳点表面电荷密度,引起荧光淬灭。如图5c所示:R-CDs溶液在波长365 nm的紫外灯照射下呈现红色,当溶液pH值降低至2.0时,发生荧光淬灭,颜色消失;继续调节溶液pH至7.0时,R-CDs溶液的红色荧光恢复。在连续4次酸碱循环后,R-CDs的荧光强度仍然可以恢复(图5d),证明R-CDs的荧光发射对溶液pH变化具有良好的可逆性,展示了R-CDs在环境分析中的巨大应用潜力。

(a)pH范围为2~8时的荧光发射光谱;(b)pH范围为2~8时的荧光强度;(c)在波长365 nm的紫外灯照射下,水溶液(左)、
2.3 基于R-CDs的敌敌畏传感器的构建
乙酰胆碱酯酶(AChE)能高效降解乙酰胆碱(ATCh),生成乙酸和胆碱,导致周围环境呈酸性。有机磷农药(OPs)可以有效抑制乙酰胆碱酯酶的活性,阻止对乙酰胆碱的降解,减少乙酸的生成量,从而使周围环境的酸碱性质保持不变[28]。R-CDs在酸性条件下的荧光淬灭,可以指示周围环境酸碱性质的变化,非常适合用于OPs的检测。
敌敌畏是一种典型的有机磷农药,因此以敌敌畏为模型化合物构建R-CDs对有机磷农药的传感体系。传感机理如图6所示:当AChE和ATCh与R-CDs同时存在时,ATCh被AChE水解产生乙酸,溶液的pH值降低,引发R-CDs的荧光淬灭;当有机磷农药敌敌畏与AChE共存时,AChE活性受到抑制,不能水解ATCh产生乙酸,与敌敌畏不存在的情况相比,R-CDs体系的荧光信号强度显著升高。根据荧光信号强度的变化,可以实现敌敌畏的高灵敏度、高准确度测定。

图6 碳点对有机磷农药敌敌畏荧光检测的原理示意图
如图7所示:单独加入AChE或ATCh均不能改变R-CDs的荧光发射强度;当AChE和ATCh共同存在时,R-CDs的荧光强度急剧下降至淬灭;当有机磷农药敌敌畏与AChE、ATCh三者共存时,R-CDs的荧光强度没有明显变化。这一结果表明,R-CDs可以通过荧光颜色的变化指示周围环境中有机磷农药敌敌畏的存在。

A. R-CDs;B. R-CDs+AChE;C. R-CDs+ATCh;D. R-CDs+AChE+ATCh;E. R-CDs+OPs+AChE+ATCh。
如图8a所示:在没有加入敌敌畏的情况下,R-CDs在波长605 nm处具有较强的荧光发射峰;加入乙酰胆碱酯酶和乙酰胆碱后,荧光淬灭;同时加入乙酰胆碱酯酶、乙酰胆碱、敌敌畏,随着敌敌畏浓度的增加,波长605 nm处的荧光强度不断增加。如图8b所示,波长605 nm处的荧光强度与0.01~0.1 ng/mL范围内的敌敌畏浓度呈良好的线性关系,相关系数为0.992 7。根据该线性关系,可以计算得出敌敌畏的最低检测限为2.22×10-8mg/mL。与已报道的质谱法或电化学法相比(表1),本文提出的红色碳点荧光光谱法,具有较好的线性范围和较低的检测限。
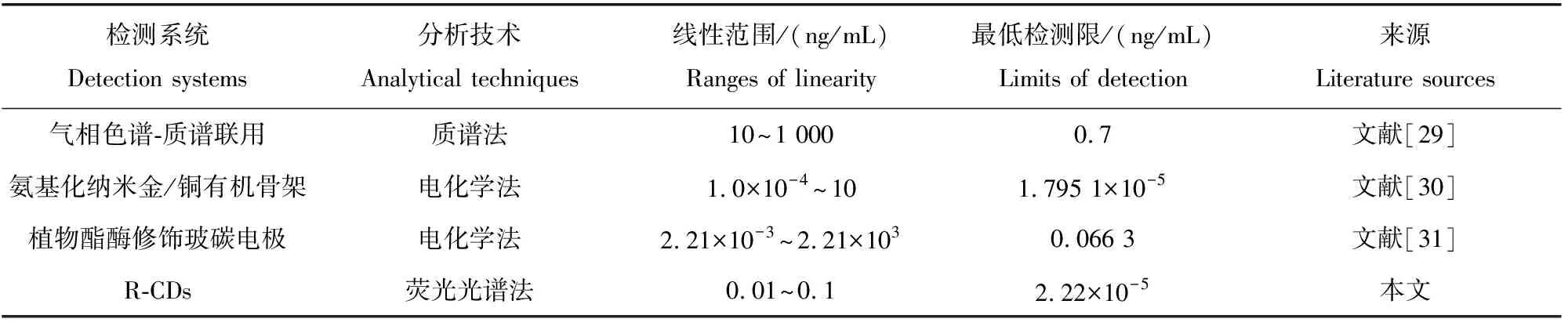
表1 敌敌畏检测方法对比

(a)不同浓度敌敌畏的R-CDs荧光光谱;(b)波长605 nm处的荧光强度与敌敌畏浓度的线性关系。
3 结语
以一水合柠檬酸和尿素为原料,采用一锅溶剂热法合成具有良好水溶性的红色荧光碳点。碳点在酸性环境中荧光猝灭,在碱性条件下荧光稳定,并且可以在酸碱环境循环变化过程中稳定实现荧光的“开—关”。可对敌敌畏进行选择性检测,最低检测限为2.22×10-8mg/mL。

