禽传染性支气管炎病毒拮抗JAK-STAT信号通路的研究
楚红燕,宫晓倩,徐丘璠,仇旭升,谭 磊,孙英杰,刘炜玮,宋翠萍,钱 琨,丁 铲,廖 瑛,陈丽颖
(1.河南农业大学动物医学院,郑州 450002;2.中国农业科学院上海兽医研究所,上海 200241;3.扬州大学江苏高校动物重要疫病与人兽共患病防控协同创新中心 江苏省人兽共患病学重点实验室,扬州 225009)
传染性支气管炎病毒(Infectious bronchitis virus,IBV)属于冠状病毒科,γ冠状病毒属,具有多种血清型,在养禽业中流行多年,对鸡呼吸道、肾脏、输卵管等器官造成严重的损伤,主要引起产蛋率下降[1]。1936年分离出以Mass株和Conn株为代表的呼吸型IBV,其临床诊断特征是病鸡精神沉郁、呼吸困难、发出啰音、咳嗽、张口呼吸、打喷嚏[2]。1962年,Winterfield等[3]首次报道分离到Holte株和Gray株为代表的肾型IBV,以肾病变为主,呼吸道症状较轻微,其病变特征是肾肿大、苍白、肾小管和输尿管充满尿酸盐。肾型IBV以QX株、Holte株、Gray株和T株为代表分离株。目前,肾型QX株、呼吸型Mass株和肌肉型4/91株在我国鸡场流行,同时也存在变异株[2]。IBV的基因组为单股正链RNA,长度约为27.6 Kbp,由10个开放阅读框架(open reading frame,ORF)组成。5'端三分之二序列是开放读码框架ORF1a和ORF1ab,翻译合成两个多聚蛋白pp1a和pp1ab(polyprotein 1a and polyprotein 1ab),由多聚蛋白自身编码的两个非结构蛋白(nonstructural protein,nsp):木瓜样蛋白酶(papain-like protease,nsp3)和3CL蛋白酶(3C-like protease,nsp5)切割产生15个成熟的非结构蛋白(nsp2~nsp16)[4]。这些非结构蛋白包括蛋白酶(nsp3、nsp5)、RNA复制酶(nsp12)、RNA解旋酶(nsp13)、核酸外切酶(nsp14)、核酸内切酶(nsp15)和RNA甲基化酶(nsp16)等,参与病毒的复制,并在病毒-宿主相互作用中发挥重要作用[5]。基因组3'端的三分之一序列编码4个结构蛋白:纤突蛋白(spike protein,S)、小包膜蛋白(envelope protein,E)、膜蛋白(membrane protein,M)、核衣壳蛋白(nucleocapsid protein,N)和4个辅助蛋白3a、3b、5a和5b、M蛋白和E蛋白参与病毒颗粒的组装和释放,N蛋白跟基因组RNA结合形成核衣壳,保护病毒基因组,S蛋白介导病毒入胞,并决定病毒的感染物种和组织嗜性。4个结构蛋白均为感染性病毒颗粒的重要组成部分[1];推测4个辅助蛋白跟病毒的毒力相关[5]。
在病毒感染期间,通常激活转录因子IRF3/IRF7,诱导I型干扰素(IFN-α和IFN-β)的表达。IFN-α和IFN-β是主要的抗病毒细胞因子,是动物先天免疫防御的重要组成部分,在控制病毒感染和引发适应性免疫应答中至关重要[6]。IFN-α和IFN-β分泌到细胞外,与细胞表面的IFN受体(IFNAR-1和IFNAR-2)相结合,激活Janus激酶JAK1和TYK2[7];随后,活化的JAK激酶磷酸化转录因子STAT1和STAT2,与IRF9形成转录复合体,进入细胞核,诱导几百种抗病毒因子干扰素诱导基因ISGs(interferon stimulated genes)的表达[8]。与哺乳动物的冠状病毒相似,γ型禽冠状病毒IBV已经进化出多种策略来有效地拮抗禽类宿主的干扰素反应,抑制抗病毒免疫应答[9]。然而,IBV拮抗干扰素反应的机制,尚不清楚。
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)属于α冠状病毒,主要引起猪流行性腹泻(porcine epidemic diarrhea,PED),是一种高度传染性肠道疾病,引起仔猪严重腹泻[10],死亡率高达100%,并影响母猪的产仔[11]。尽管已有多种疫苗可供使用,但疫情仍在持续,给养猪业带来严重的经济损失[12-14]。已有研究报道,PEDV能够通过3CL蛋白酶诱导STAT1的降解,抑制ISGs的表达,减少宿主的抗病毒反应[15]。在本研究中,PEDV将作为拮抗JAK-STAT信号通路的阳性对照,纳入实验。
为研究IBV拮抗JAK-STAT信号通路的机制,我们首先检测IBV感染是否激活JAK-STAT信号通路,并且证实IBV对IFN-β激活的JAK-STAT信号通路具有抑制作用。此外,我们还纳入nsp15核酸内切酶活性缺陷型重组病毒rIBV-nsp15-H238A,发现此毒株跟野生型IBV一样,能抑制STAT1和STAT2的磷酸化。然而,通过外源表达nsp15,检测STAT1的表达水平和核转位,发现nsp15能够减少STAT1的表达,从而减少进入细胞核的STAT1,说明nsp15参与拮抗JAKSTAT信号通路。然而,nsp15功能缺陷型毒株rIBVnsp15-H238A对JAK-STAT信号通路的拮抗,说明nsp15在病毒拮抗JAK-STAT信号通路中不发挥主要作用;病毒还编码其他的蛋白,抑制JAK-STAT信号通路。
1 材料及方法
1.1 细胞株与毒株Vero细胞(非洲绿猴肾细胞)购自ATCC(美国),并保存于本实验室。其中,培养于10%血清的DMEM中。病毒:IBV Beaudette株,由华南农业大学刘定祥老师实验室馈赠。rIBV-nsp15-H238A病毒由本实验室保存。PEDV HLJBY株由扬州大学郇长超老师馈赠。
1.2 抗体与试剂鼠源Flag标签抗体(F1804)购自Sigma公司;用于质粒转染的转染试剂Fugene(E2311)购自Promega公司。IBV nsp15蛋白抗体(鼠源)由浙江大学周继勇和廖敏实验室馈赠;鼠源PEDV N蛋白抗体由中国农业科学院上海兽医研究所周艳君老师馈赠;兔源STAT1(D1K9Y)、兔源STAT2(D9J7L)和phospho-STAT1(58D6 Tyr701)、兔源phospho-STAT2(Y690 D3P2P)以及兔源HA标签(C29F4)抗体均购自CST公司;鼠源β-actin抗体(AC026)、HRP羊抗兔IgG(H+L)(AS014)和HRP羊抗鼠IgG(H+L)(AS003)购自Abclonal公司;Alexa Fluor羊抗兔488(A-11034)和羊抗鼠594(A-11005)购自Invitrogen公司;Recombinant Human IFN-beta Protein(8499-IF)购自R&D Systems。
1.3 质粒构建质粒:pXJ40F、pXJ40F-nsp15、pXJ40F-nsp15-H223A、pXJ40F-nsp15-H238A、pXJ40F-nsp15-D223A、pXJ40F-nsp15-D315A均带Flag标签,由本实验室构建并保存。根据 GenBank 上公布的鸡源STAT1基因组设计用于构建真核HA标签质粒的引物。所用载体为PCMV-HA,限制性内切酶限制性内切酶SalⅠ和XhoⅠ购自Thermo公司,引物序列见表1。通过DF-1细胞提取RNA,按照RNA 2 μg、Oligo dT 2 μL,反转录酶1.5 μL,dNTP 2 μL,反转录酶抑制剂1 μL,Buffer 10 μL,DEPC水补加至50 μL。42℃进行反转录2 h,75℃灭活反转录酶5 min,得到cDNA。使用Phanta®Max Super-Fidelity DNA Polymerase 进行PCR扩增所需的STAT1序列。PCR反应体系为:cDNA 5 μL,上、下游引物2 μL,缓冲液2× Max buffer 25 μL,Phanta®Max Super-FideLity DNA Polymerase 1 μL,ddH2O补至50 μL。取PCR扩增产物进行琼脂糖核酸电泳检测,胶回收目的片段,酶切产物和载体PCMV-HA酶切产物按照南京Vazyme(C115)试剂盒说明书37℃连接30 min。将10 μL连接产物转化、涂板、挑菌、菌液送测序。测序正确后接菌,摇菌,最终提取质粒。

表1 构建鸡源STAT1所用引物Table 1 Primers used to construct chicken STAT1 plasmids
1.4 质粒的转染将Vero细胞接种于12孔的细胞培养板内,待细胞长至60%~70%时转染1 μg质粒(共转染组加入各1 μg质粒),具体如下:加入50 μL Opti-MEM™(共转染组加入100 μL Opti-MEM™)于EP管内,按照质粒和转染试剂的质量体积比1∶3,轻轻吹打混匀后室温静置15 min,静置期间用PBS洗3次细胞板,然后加入450 μL Opti-MEM™无血清培养基于细胞培养板内,再加入质粒-转染试剂脂质体。
1.5 Western blotVero细胞接种至12孔板,待长至70%~80%,加入不含血清的培养基稀释好的每孔1 MOI的IBV,10 MOI rIBV-nsp15-H238A,或1 MOI PEDV,同时设置不加毒的空白对照组(Mock)。接毒后将细胞放置37℃培养箱培养1 h,换含2%血清的维持培养基培养18 h,IFN-β(1000 IU/ml)刺激1 h。每孔加入100 μL的2×细胞裂解液,转移至EP管,100℃金属浴煮沸10 min,最后12 000 ×g离心5 min得到所需检测样品。将10%蛋白胶置于电泳槽内,加入1×电泳缓冲液。80 V电压30 min使样品跑至分离胶处,调整电压到120 V 75 min。按照滤纸-蛋白胶-硝酸纤维素膜-滤纸的顺序制备夹心三明治,在250 mA下转印95 min。转印结束后将硝酸纤维素膜放置在含有5%脱脂乳的孵育盒内封闭1 h。封闭结束后,用TBST洗涤一遍,孵育一抗(anti-STAT1、anti- phospho-STAT1、anti-STAT2、anti- phospho-STAT2、anti-IBV N、anti-PEDV N、anti-HA、anti-Flag或anti-β-actin),4℃孵育过夜。次日用TBST洗膜;然后将膜放入稀释好的HRP标记的二抗孵育管内,室温孵育2 h。TBST洗3遍后,在膜上均匀加入显色液,置于化学发光仪上进行显色。
1.6 间接免疫荧光实验在12孔板里加入爬片,正常接种细胞,按照如上方法处理细胞。收样时加入500 μL/孔的4%多聚甲醛固定10 min,TBS清洗一遍后,加入0.5%的Triton X-100透化10 min,洗一遍后,加入3%BSA,37℃封闭1 h。结束后,将稀释好的一抗(包括anti-IBV nsp15、anti-PEDV N、anti-STAT1、anti-Flag或anti-HA)滴加在湿盒上50 μL/片,将有细胞的一面与抗体液滴接触,然后将其放置37℃水浴箱孵育1 h。TBS洗3次,每次5 min。将盖玻片有细胞的一面与稀释好的偶联FITC或TRITC的二抗的液滴接触,避光37℃孵育30 min。TBS清洗后按照如上方式继续孵育一抗和二抗。抗体孵育工作结束后,稀释DAPI(1∶1000),每孔加入DAPI稀释液1 mL/孔,室温孵育10 min,TBS洗3遍。最后,在载玻片上滴加一滴抗淬灭剂。室温自然风干,最后在Zeiss激光共聚焦显微镜下观察和拍照摄片。
2 结果
2.1 IBV感染不刺激JAK-STAT信号通路,并能下调IFN-β激活的STAT1和STAT2磷酸化水平已有报道显示冠状病毒编码的核酸内切酶nsp15通过减少双链RNA的累积,拮抗IFN-β反应[16]。为检测nsp15是否参与对JAK-STAT信号通路的调控,将rIBVnsp15-H238A(nsp15核酸酶活性缺陷型重组病毒)纳入本实验。也有文献报道PEDV感染能够显著降低STAT1的蛋白水平[15],将其作为阳性对照组纳入本实验。在IFN-β缺陷型细胞Vero上分别感染IBV,rIBV-nsp15-H238A,PEDV感染后24 h,一组不加IFN-β刺激,另一组加1000 IU/mL IFN-β刺激1 h。通过Western blot检测STAT1和STAT2的磷酸化水平(图1),对IBV N蛋白和PEDV N蛋白检测显示,3个毒株均能有效感染Vero细胞;检测STAT1和STAT2的磷酸化水平显示,在没有IFN-β刺激的情况下,3个毒株均不诱导STAT1和STAT2的磷酸化。在IFN-β刺激的细胞中,PEDV显著降低STAT1和STAT2的磷酸化水平,IBV和rIBV-nsp15-H238A轻度抑制STAT1和STAT2的磷酸化。本实验说明IBV感染在一定程度上抑制IFN-β诱导的STAT1和STAT2的磷酸化,nsp15的核酸酶活性在病毒对JAK-STAT信号通路的抑制中,不起主要作用。
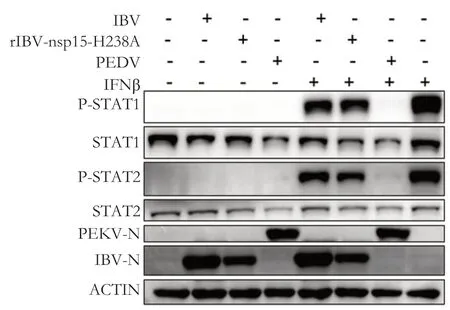
图1 IBV感染抑制IFN-β激活的JAK-STAT信号通路Fig.1 IBV infection inhibits IFN-β stimulated STAT1/2 phosphorylation
2.2 IBV抑制IFN-β刺激的STAT1核转位为进一步确认IBV对STAT1的抑制作用,我们用间接免疫荧光检测在IBV感染情况下,STAT1的核转位情况。本实验纳入模拟感染(Mock)和PEDV感染作为对照组。在Vero细胞上分别感染1 MOI IBV、10 MOI rIBV-nsp15-H238A和1 MOI PEDV。感染后24 h,一组实验不加IFN-β,另一组实验加入IFN-β刺激1 h,利用免疫荧光技术对病毒蛋白和STAT1的核转位进行检测。以IBV nsp15抗体标记IBV感染的细胞,以PEDV N抗体标记PEDV感染的细胞,以STAT1抗体标记STAT1的核转位。在无干扰素刺激的情况下,IBV和rIBV-nsp15-H238A有效感染细胞,且均不诱导STAT1的核转位(图2A),IFN-β刺激有效诱导STAT1的核转位(图2B),IBV和rIBV-nsp15-H238A感染的细胞,在IFN-β刺激下,STAT1不发生核转位(图2B红色箭头)。此结果说明IBV感染不激活JAK-STAT信号通路,且能够显著抑制IFN-β刺激的JAK-STAT信号转导。nsp15的核酸酶活性在IBV拮抗JAK-STAT信号通路中是非必需的。PEDV感染也能在一定程度上抑制IFN-β刺激的STAT1核转位,但抑制作用不如IBV明显。

图2 IBV和rIBV-nsp15-H238A感染Vero细胞,抑制IFN-β诱导的STAT1核转位Fig.2 IBV and rIBV-nsp15-H238A inhibit IFN-β-stimulated STAT1 nuclear translocation in Vero cells
2.3 IBV nsp15减少STAT1的蛋白表达为进一步确认IBV nsp15是否参与拮抗JAK-STAT信号通路,我们对nsp15进行克隆,并把核酸内切酶活性中心H238突变为A,使其失去核酸酶活性。将IBV nsp15和突变型nsp15-H238A转染到Vero细胞,24 h后,以IFN-β刺激1 h,诱导STAT1的核转位。将不做任何处理的细胞(Mock)、IFN-β刺激、空载体PXJ40转染加IFN-β刺激,作为对照组。利用免疫荧光技术,以Flag抗体标记表达nsp15的细胞,以STAT1抗体标记内源性STAT1。Mock组的细胞质和细胞核均分布有STAT1,IFN-β处理有效刺激STAT1进入细胞核,转染PXJ40加IFN-β刺激组,STAT1主要集中在细胞核;表达nsp15的细胞,STAT1在细胞质和细胞核的信号均显著减弱;表达nsp15-H238A的细胞,STAT1主要集中在细胞核,STAT1信号较强。此实验说明nsp15有可能干扰STAT1的表达或促进其降解,导致STAT1的信号变弱,其核酸酶活性参与此功能(图3)。我们未发表的数据表明,nsp15能够广谱性抑制细胞内蛋白翻译,因而减少STAT1的蛋白表达。

图3 外源表达的IBV nsp15减少内源性STAT1的信号,且核酸酶活性发挥重要作用Fig.3 Exogenous expression of IBV nsp15 reduced endogenous STAT1 signal,and the ribonuclease activity was required
2.4 IBV nsp15抑制STAT1的表达,且核酸酶活性和nsp15的三聚化发挥关键作用为了进一步验证nsp15是否通过抑制蛋白表达而减少STAT1的信号强度,我们将nsp15-Flag和鸡源STAT1-HA在Vero细胞共表达,用IFN-β刺激1 h,检测STAT1信号强度和核转位现象。H223和H238是预测的核酸酶活性中心,D285和D315参与nsp15的三聚化,使其维持正常的结构,发挥核酸酶功能。我们将H223、H238、D285和D315分别突变成A,使其失去核酸酶活性或三聚化能力,纳入本实验。空载体PXJ40与STAT1共转染加IFN-β刺激,作为对照组。利用Western blot和间接免疫荧光检测nsp15和STAT1的表达,并检测STAT1的核转位。图4B所示,PXJ40与STAT1共转染组,IFN-β有效诱导STAT1的入核;共表达nsp15与STAT1的细胞,STAT1信号显著减弱(图4A,4B);nsp15-H223A、nsp15-H238A、nsp15-D285A或nsp15-D315A与STAT1共转染的细胞,STAT1的表达水平跟PXJ40与STAT1共转染组相当(图4A),且主要集中在细胞核(图4B)。此实验说明nsp15干扰STAT1的表达或促进其降解,其核酸酶活性中心和三聚化,发挥关键作用。值得注意的是,nsp15-D285A和nsp15-D315A表达水平低于野生型nsp15、nsp15-H223A和nsp15-H238A(图4A),说明这两个突变体,失去三聚化后,不稳定,容易发生降解。在IBV感染过程中,由于存在其他的与nsp15相互作用的病毒蛋白,nsp15在细胞质形成点状聚集,主要位于病毒的复制转录小体[16](图2);然而,外源表达的nsp15进入细胞核(图3、图4B),不能被三聚化的突变体nsp15-D285A和nsp15-D315A,失去了明显的核定位(图4B),说明nsp15的三聚化跟核定位相关,也间接说明nsp15的三聚化和入核,均有可能参与抑制蛋白的表达。

图4 IBV nsp15减少外源的STAT1表达和核转位,且核酸酶活性发挥重要作用Fig.4 IBV nsp15 reduces the expression and nuclear translocation of exogenous STAT1,and ribonuclease activity plays crucial role
3 讨论
先天性免疫应答是抵抗病毒的第一道防线,而I型IFN是这种抗病毒应答的关键组成部分。STAT1是JAK-STAT信号通路的重要成分,IFN-α/β结合细胞膜上相应的IFN受体,激活JAK,刺激STAT1的磷酸化,并磷酸化STAT2;STAT1、STAT2和IRF9形成异源三聚体复合物,进入细胞核,诱导ISGs的表达,执行抗病毒作用。为了逃避宿主的先天性免疫应答,冠状病毒采用多种策略拮抗IFN信号通路,促进其自身复制。由于STAT1和STAT2的磷酸化激活和核转位是JAK-STAT信号通路的关键步骤,因此STAT经常被病毒编码的蛋白靶向抑制[5]。麻疹病毒利用其自身表达的P和V蛋白对抗IFN传导的JAKSTAT信号通路[7];干扰STAT1磷酸化[9,17-18];并通过降解STAT1抑制IFN-β信号传导[19]。PDCoV感染通过其自身编码的3C like蛋白酶(nsp5)剪切STAT2,拮抗IFN信号转导[20]。已有报道表明,SARS-COV-2的ORF6同时抑制I型IFN的产生和下游JAK-STAT信号传导,并且ORF6的C端区域对其拮抗作用至关重要[21];β冠状病毒SARS-CoV的ORF6能通过将核导入因子滞留在粗面内质网/高尔基体膜上而拮抗STAT1功能[22]。IBV属于γ冠状病毒,不编码ORF6,是否编码其他蛋白,参与抑制IFN信号通路呢?
本研究中,我们用IBV Beaudette株感染Vero细胞,发现IBV不激活且能抑制IFN-β诱导的STAT1和STAT2磷酸化,并抑制STAT1的核转位。Nsp15是冠状病毒编码的核酸内切酶,能够剪切病毒的负链RNA,减少双链RNA的累积,逃逸宿主对病毒感染的识别和减少IFN的表达[16]。利用nsp15核酸酶活性缺失毒株rIBV-nsp15-H238A感染Vero细胞,发现其对JAK-STAT的抑制作用跟野生型IBV相当,说明nsp15的核酸酶活性,对于IBV拮抗JAK-STAT信号通路,不是必需的。通过外源表达nsp15,检测内源性STAT1的核转位,发现nsp15能降低内源性STAT1的蛋白信号,核内STAT1信号也相应减弱。通过共转染nsp15和STAT1质粒,检测质粒表达的STAT1信号和核转位情况,发现nsp15也能够抑制外源性STAT1的表达。我们的未发表数据显示,nsp15能够广谱性抑制细胞内蛋白翻译,因此,nsp15对STAT的抑制,有可能是其抑制宿主蛋白翻译的一个结果。对nsp15进行核酸酶活性关键氨基酸突变和三聚化关键氨基酸进行突变,结果显示其核酸酶活性和三聚化能力都参与抑制STAT1的表达。根据nsp15靶向降解RNA的特性,我们推测nsp15有可能作用于宿主RNA,抑制蛋白翻译。外源表达的nsp15能够进入细胞核,进一步证实了这个推测:nsp15靶向细胞核内RNA,因而抑制宿主mRNA的翻译。在病毒感染的情况下,nsp15主要在细胞质形成点状聚集,位于病毒基因组的复制转录复合体[16],说明在病毒感染的情况下,细胞内环境更为复杂,nsp15的功能受其他病毒蛋白的调控,nsp15缺陷型毒株rIBV-nsp15-H238A能够跟野生型IBV一样拮抗JAK-STAT信号通路,说明在病毒感染的情况下,nsp15的核酸酶活性,对于IBV拮抗JAK-STAT通路不是必需的;由此推测,IBV还编码其他蛋白,作用于JAK-STAT信号通路,需要进一步对病毒蛋白进行筛选和研究。
IBV能够抑制JAK-STAT信号通路,降低宿主的抗病毒反应。外源表达的核酸内切酶nsp15能够进入细胞核,减少STAT1的表达,其核酸酶活性和三聚化能力均发挥关键作用;但在病毒感染的情况下,病毒编码的nsp15没有明显减少STAT1的表达,在拮抗JAK-STAT信号通路中没有起到主要作用。据此推断,IBV还编码其他蛋白,参与对JAK-STAT信号通路的拮抗。

