不同畜禽来源产气荚膜梭菌的耐药性分析
吴立婷,田 源,王 娟,包红朵,周 艳,庞茂达,王 冉,张 辉
(1.江苏省农业科学院农产品质量安全与营养研究所 江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地,南京 210014;2.江苏大学食品与生物工程学院,镇江 212013;3.西北农林科技大学,杨凌 712100)
产气荚膜梭菌(Clostridiumperfringens,Cp)是一种革兰阳性厌氧菌,又名为魏氏梭菌,能够产生孢子,它广泛存在于土壤、污水、沉积物以及人和动物的消化道中,可以在环境中水平传播[1]。Cp通过产生的毒素造成畜禽的疾病。Cp所分泌的外毒素已经达到 20余种,基于其产生的主要致死性毒素α、β、ε和ι毒素的差异,将Cp分成A、B、C、D和E等毒素型[2-5]。其中,A 型产气荚膜梭菌主要引起人类的食物中毒、气性坏疽、胃肠道疾病、婴幼儿猝死综合症,以及动物毒血症和禽类的坏死性肠炎等;B、C、D和E型产气荚膜梭菌主要引起畜禽的肠道疾病,同时C型产气荚膜梭菌还能引起人类的坏死性肠炎[5]。近年来,Cp感染所引起的畜禽发病数量在我国逐年增多,流行特点也由点状散发发展为片状散发,给我国养殖业造成了巨大经济损失[6]。长期以来,针对Cp的有效治疗仍需应用抗生素,然而抗生素因早期被广泛地添加于动物饲料、饮水中,使得Cp多重耐药性加剧。这不仅对临床治疗造成了极大困难,还严重威胁公共安全和人类健康,因此针对畜禽养殖业Cp进行抗生素敏感性检测以为相关疾病的治疗和合理使用抗生素具有重要意义。
1 材料与方法
1.1 Cp分离与鉴定2019—2020年,共采集来自河南省、山东省、江苏省、陕西省部分地区畜禽养殖场180份样品,主要选择粪便、肠道、组织、污水样品。8株牛源、15株羊源Cp由西北农林科技大学分离鉴定,江苏省食品质量安全重点实验室保存。取鸡肠道内容物约2 g,加入18 mL PBS漩涡震荡24 h后,取100 μL悬液加到10 mL厌氧肉汤培养基(含D-环丝氨酸,石蜡油)。40℃厌氧培养18~24 h。取培养液,涂布于胰胨-亚硫酸盐-环丝氨酸(tryptose sulfite cycloserine agar,TSC)卵黄平板,待干燥后,再覆盖一层TSC平板(无卵黄),40℃厌氧培养24 h。挑取TSC卵黄平板上有白浊环的黑色单菌落进行革兰染色和显微镜检查;再将鉴定菌落于厌氧肉汤培养基中40℃厌氧培养过夜(表面覆盖石蜡油),将培养物取加入40%甘油置于-80℃保存。
1.2 Cp毒素分型利用多重PCR鉴定菌株的毒力基因型,其中仅有α毒素为A型,含α、ε、β毒素为B型,α、β毒素为C型,α、ε毒素为D型,α、ι毒素为E型。ATCC13124作为阳性对照,引物序列见表1[4]。PCR反应条件:95℃预变性5 min;95℃变性30 s,57℃退火30 s,72℃延伸30 s,共35个循环;72℃再延伸10 min,PCR产物经琼脂糖凝胶电泳检测。

表1 Cp毒素分型引物Table 1 Toxin typing primers of C.perfringens
1.3 Cp药物敏感性测定采用微量肉汤稀释法对分离的Cp进行10种抗菌药物的耐药性检测,分别为青霉素、氯霉素、氨苄西林、甲硝唑、万古霉素、四环素、美罗培南、莫西沙星、克林霉素、头孢曲松。
参照美国临床和实验室标准化协会(Clinical Laboratory Standards Institute,CLSI)推荐的方法测定抗生素的最小抑菌浓度(minimum inhibitory concentration,MIC),使用金黄色葡萄球菌ATCC25923作为药物质控菌株。微量肉汤稀释法推荐使用添加氯化血红素K和溶解马血的布氏肉汤作为液体培养基,细菌生长至1.5×108CFU/mL,用肉汤稀释10倍菌液至工作浓度,制备成菌悬液。在96孔板中每孔加入50 μL布氏肉汤培养基,每排前10个孔中依次加入128 ~0.25 μg/mL共10个浓度梯度的抗菌药物,再加入预先制备好的悬菌液,使每孔菌液终浓度为105CFU/mL,分别设置阳性和阴性对照,每种抗菌药物做三个平行,厌氧环境,37℃过夜培养,读取结果。
1.4 耐药基因检测通过PCR方法分析Cp中7种主要耐药基因携带情况,7种耐药基因主要包括四环素类:tetA、tetB、tetM;氨基糖苷类:qnrA、qnrS;大环内酯类:ermC;氯霉素:cat。参考文献设计并合成引物[7-8](表2),PCR检测后电泳分析扩增产物。

表2 耐药基因引物序列设计Table 2 Primer sequences of resistance genes
2 结果
2.1 Cp鉴定结果来源于鸡、羊和牛源的Cp菌株形态相同,纯化后共获得52株分离株。在TSC平板上37℃培养24 h,形成圆形、光滑、边缘整齐的黑色菌落(图1),在显微镜下可见蓝紫色,革兰阳性,散在或成对存在的粗状的大杆菌,两端钝圆;芽孢椭圆形,直径小于菌体,位于菌体中央或次级端,有荚膜,无鞭毛。在180份禽源样品中,其中29份样品被鉴定为Cp阳性,阳性率为16.11%(29/180)。

图1 Cp的菌落形态及革兰染色镜检Fig.1 Morphology and Gram staining of C.perfringens
2.2 毒力基因鉴定对52株来源于牛、羊和鸡的Cp鉴定其毒力基因,结果可知,以Cp A型参考菌株ATCC13124为阳性对照,52分离株仅扩增出α毒素基因cpa,大小为324 bp的目的条带,未扩增出β(cpb)、ε(etx)、ι(iap)毒素基因,cpa基因扩增后的测序结果显示:与NCBI上已上传的Cp参考菌株ATCC13124的α毒素基因cpa的同源性高达99%,表明鸡源分离株(n=29),羊源(n=8)和牛源分离株(n=18)均为A型Cp(图2)。

图2 α(cpa)毒素鉴定结果Fig.2 Identification of lification of α (cpa)-toxin gene
2.3 药物敏感性分析用于治疗Cp感染的10种常用抗生素耐药性如图3所示。不同来源的Cp对10种抗生素呈现不同程度的耐药性,其中对克林霉素(22/52,42.31%)和四环素(21/52,40.38%)的耐药率较高,对青霉素、氯霉素、氨苄西林、甲硝唑、万古霉素、美罗培南、莫西沙星、头孢曲松耐药率分别为23.08%(12/52)、15.38%(8/52)、19.23%(10/52)、19.23%(10/52)、11.54%(6/52)、1.92%(1/52)、25.00%(13/52)、25.00%(13/52)。根据表3、图4显示,在鸡源分离株中对四环素(12/29,41.38%)耐药率最高,而羊源和牛源的分离株分别对克林霉素表现出高耐药率62.50%(5/8)、73.33%(11/15)。牛源分离株的耐药率普遍高于鸡源与羊源分离株,仅一株牛源分离株对美罗培南产生耐药性。可以发现羊源和牛源对头孢曲松的耐药率分别为50.00%、46.67%,而鸡源较低则为6.90%。

图3 Cp分离株耐药性检测结果Fig.3 Antibiotic resistance of C.perfringens

图4 不同来源Cp耐药性分析结果Fig.4 Antibiotic resistance of C.perfringens from different sources
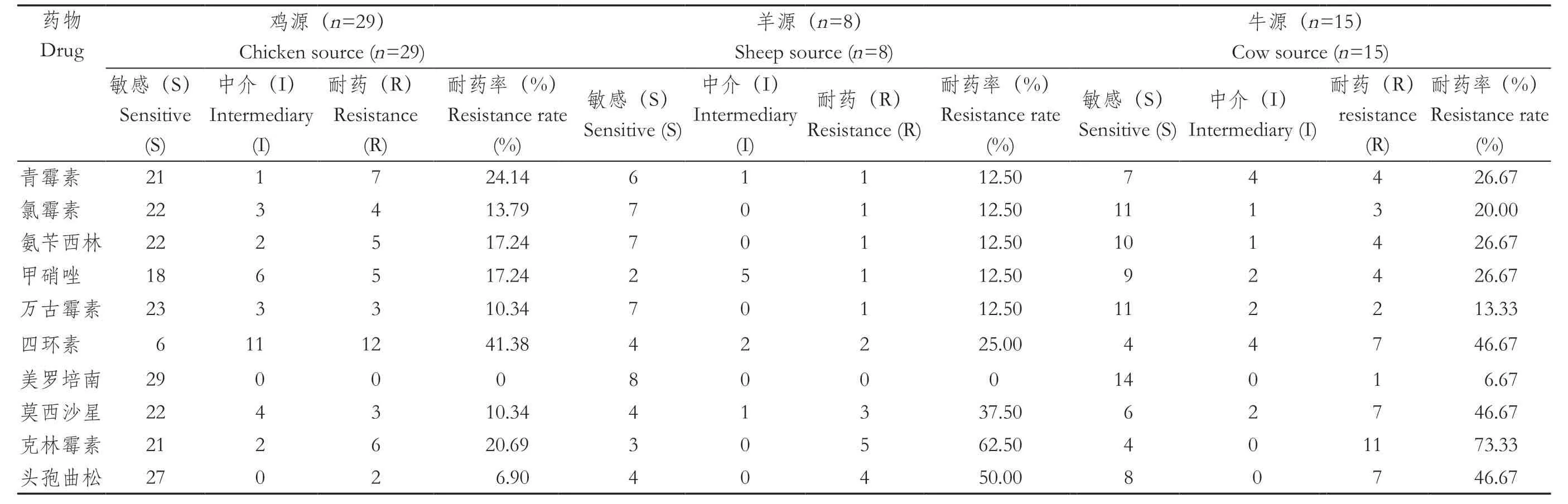
表3 不同来源Cp 耐药情况Table 3 Antimicrobial resistance of C.perfringens from different sources
2.4 多重耐药性分析根据鸡、羊、牛三种不同来源菌株的耐药结果,对多重耐药率进行分析,结果见表4。65.38%(34/52)的Cp至少对一种抗生素产生耐药性,其中鸡源Cp尤为突出(16/29)。羊源、牛源分离株对两种抗生素产生的耐药率分别是25.00%、20.00%,明显高于鸡源的10.34%;同时对三种抗生素的耐药率高达25.00%、26.67%,而无鸡源分离株同时耐受三种抗生素。鸡源、牛源分离株中各有一株对7种抗生素产生耐药性。三种来源分离株至少对9种抗生素耐药的比例分别达到6.90%、12.50%、6.67%。在不同来源分离株中,牛源的多重耐药率最高,其次是鸡源、羊源分离株主要对2种和3种抗生素表现出多重耐药性。一株牛源分离株能够对10种抗生素同时呈现耐药性。

表4 不同来源Cp多重耐药性Table 4 Multiple drug resistance of C.perfringens from different sources
2.5 耐药基因携带情况针对52株Cp进行耐药基因检测,结果见图5。四环素类耐药基因携带率最高,其中tetA的检出率高达94.23%,其次为tetB(65.38%)、tetM(17.31%)。喹诺酮类耐药基因qnrS及qnrA检出率分别为30.77%和13.46%,而大环类脂类ermC、cat基因未检出。根据图6中不同来源Cp耐药基因携带情况分析表明:鸡、牛源分离株均携带tetA,而羊源检出率为62.50%;三种来源分离株中,tetB主要集中在鸡源,可达82.76%;与鸡、牛源相比,羊源分离株携带qnrS基因高达50.00%。由此可见,不同来源Cp分离株其耐药特性具有显著差异。

图5 Cp耐药基因Fig.5 Carrying of resistant genes in C.perfringens

图6 不同来源Cp耐药基因Fig.6 Carrying of resistant genes in C.perfringens from different sources
3 讨论
随着人们生活水平的不断提升,对畜禽产品的需求也与日俱增,从而促使规模化畜禽养殖的快速发展。然而,抗生素在作为促生长剂和临床治疗过程中已逐渐被滥用,导致许多肠道菌的耐药性加剧,部分人畜共患病原菌已出现严重的多重耐药性[9]。Cp作为肠道中常在菌,能够引起动物的坏死性肠炎,误食能够引食物中毒,并引发抗生素相关性腹泻(antibiotic-associated diarrhea,AAD)和间质性腹泻(syndromic diarrhea,SD)[10]。本研究中,在180份鸡源样品中鉴定Cp阳性率为16.11%,高于郑晓丽等[11]从四川省成都、雅安、宜宾等地区的个规模化鸡场5.7%的阳性率。而Fan等[12]2016年报告的台湾地区鸡源Cp的阳性率为29.6%;Chalmers等[13]报道的加拿大两个商业肉鸡场中Cp的阳性率分别为24.72%、23.28%;山东泰安市6个不同的鸡场采集420份样品中,共分离出209株Cp,阳性率30.7%[14],由此可见,不同养殖环境及养殖管理方式中Cp感染率呈现差异,这与我国抗生素促生长剂的使用具有一定相关性。然而,在食品中污染率却显著高于养殖环境,2016年陕西关中地区报道的零售鸡肉中Cp的阳性率53.06%[15],土耳其和澳大利亚报道的鸡肉中Cp的阳性率77%和66%,高于我国活禽市场禽产品中Cp的污染率(22.60%)。
目前,国内外报道分离Cp的毒素型多为A型,也有少数为C型[17],本研究对鸡,羊,牛三种不同来源的Cp进行毒力鉴定,结果显示52株Cp全部为A型菌,由此表明畜禽来源的Cp的流行毒素型多以A型为主,这与国内的报道一致。
近年来,四环素、青霉素、氯霉素和氨苄西林等抗生素被广泛用于治疗Cp引起的坏死性肠炎[3,14]。陕西省部分地区鸡源A型Cp分离株对万古霉素、氯霉素耐药率为20%,大部分菌株为多重耐药[18];马壮等[19]对广州市冷鲜鸡Cp耐药性鉴定结果显示对氨苄西林、青霉素敏感,但对仅可用于人的抗生素克林霉素耐药率达73.68%;Gholamiandehkordi等[20]从肉鸡中分离的Cp对四环素耐药率为 66%。本研究中鸡源分离株对四环素、万古霉素、氯霉素、青霉素,氨苄西林耐药率分别为41.38%、10.34%、13.79%、24.14%,17.24%。而来源于牛和羊的分离株对克林霉素的耐药率维持较高的耐药水平(73.33%,62.5%)。钟召兵等[21]从规模化羊场分离出的Cp对青霉素耐药率为43.3%,随后又从不同规模的牛场分离出Cp,在耐药检测的9种药物中,耐药率超过50%的有4种,对青霉素耐药率为84%。此外,陕西省、宁夏回族自治区、青海省来源的61株羊源Cp对克林霉素、四环素耐药率分别为11.47%、6.55%[22]。在本研究中,牛、羊源分离株对青霉素具有一定的耐药性,而牛源分离株四环素的耐药率可达46.67%,远高于先前的研究。综上所述,分离来自不同地区,不同来源的Cp的耐药谱存在一定差异,这可能与先前的促生长剂使用以及治疗用药不同有关。
在日本、美国、比利时等国都有关于Cp耐药性的体外研究[20]。越来越多研究表明Cp分离株呈现多重耐药特征,张娜等[22]发现78%的Cp对一种以上抗生素耐药。据报道,2017年在泰国仔猪腹泻中,分离的67.2%的Cp为多重耐药性株[23]。来自于禽产品和零售环境中Cp表现出至少对两种抗生素的耐药性,多重耐药的菌株达到90.1%[24]。与先前研究相比较,牛源的多重耐药率最高,其次是鸡源,羊源。值得注意的是一株牛源分离株能够对10种抗生素同时呈现耐药性并且耐受美罗培南和万古霉素,从而加剧了可能成为“超级细菌”的风险。耐药基因的传播是导致Cp耐药的重要原因之一,研究表明鸭源及人源Cp分离株中均能够检测到四环素耐药基因tetA,阳性率分别为34.60%、66.70%[25]。Elizabeth等[26]在犬源Cp检测到tetA和tetB基因(41%),同时亦能够检测到大环内酯类耐药基因ermC和氯霉素耐药基因cat。Rooa等[27]报道了猪源Cp对氯霉素的耐药状况,并检测到cat基因。本研究中四环素耐药基因tetA的检出率最高达94.23%,其次是tetB、tetM检出率分别为65.38%、17.31%。鸡和牛源分离株均携带tetA及tetB(82.76%),远高于其他动物源及人源的携带率;与鸡、牛源相比,羊源所携带的qnrS最高(50.00%),暂未检测到大环内酯类ermC、cat基因。四环素耐药基因包括tetA和核糖体pro保护蛋白tetB参与外排四环素,耐药基因检出率提示四环素类耐药基因已在动物和人源Cp中广泛存在。结合多重耐药、耐药基因型分析发现不同来源分离株中,牛源的普遍耐药情况相较鸡和羊源更为严重,这与牛养殖场中疾病类型不同导致临床抗生素的使用情况更为复杂有一定相关性,而鸡源耐药基因携带率较高,暗示了畜禽养殖场中潜在的治疗挑战[28]。耐药表型与耐药基因对比因药物的不同,符合率存在差异,这可能与该类药物存在多种耐药机制有关,不同的耐药基因表现出相同的耐药表型,也可能与不同来源的Cp有关。畜禽养殖场中的Cp耐药基因比较复杂,这些细菌可能具有潜在的耐药性,也可能成为耐药基因的主动传播者或存在耐药移动元件,这有助于进一步了解细菌耐药性演变。本研究为明确畜禽源Cp耐药现状分析提供可靠的参考依据,并且为畜禽养殖场有效控制由Cp引起的疾病提供规范用药参考,同时促进畜禽养殖业的健康发展,保证食品安全和人类健康。

