体外诱导骨髓细胞向肥大细胞分化的方法学研究①
廖晗婧 郭 冉 罗扬淦 卢姿含 郝逗逗 朱枝祥(北京中医药大学中药学院,北京 100029)
肥大细胞是引起过敏性疾病的重要效应细胞,过敏反应又称为Ⅰ型变态反应,主要由患者体内肥大细胞激活而诱发。目前认为肥大细胞驱动的Ⅰ型变态反应主要通过肥大细胞表达IgE 高亲和力FcεRⅠ受体,与过敏原特异性IgE 抗体结合形成IgE-FcεRⅠ复合物,过敏原刺激后,肥大细胞被活化,导致多种炎症介质和细胞因子释放,从而引起Ⅰ型变态反应[1-3]。因此,获取大量高质量的肥大细胞对进一步研究其在Ⅰ型变态反应进程中的作用及抗过敏药物的药效和作用机制具有重要意义。
目前过敏反应研究的体外细胞模型大多使用大鼠肿瘤化RBL-2H3 细胞株,这种细胞虽保留了肥大细胞和嗜碱性粒细胞的多种功能,能够用于抗过敏药物初步筛选,但仍与原代细胞有很大差异,不能完全满足抗过敏药物药效评价和机制研究需求[4-5]。体外原代培养的肥大细胞具备更完整的成熟肥大细胞特性,因此获得大量原代培养的肥大细胞对肥大细胞及抗过敏药物研究至关重要[6]。通过体外诱导培养获取高质量的肥大细胞还缺乏系统性的方法学研究,已有方法学研究缺乏细胞表型和功能鉴定,严重制约了抗过敏药物的研发进程[7-9]。本研究通过体外培养骨髓造血干细胞和祖细胞,利用不同细胞因子诱导肥大细胞分化,比较各种诱导方法对肥大细胞分化的影响,初步建立一种高效可行的原代肥大细胞培养方法,从而为肥大细胞功能调节药物的药效和作用机制研究提供高质量的肥大细胞。
1 材料与方法
1.1 材料
1.1.1 实验动物 8周龄SPF 级雄性C57BL/6小鼠9 只,购自北京斯贝福生物技术有限公司,动物合格证号:1100112011044776,饲养于北京中医药大学动物房屏障环境。饲养环境恒温恒湿,室温(24±1)℃,湿度(50±5)%,光照黑暗交替12 h,适应性饲养1周后用于实验。所有动物实验经北京中医药大学动物实验伦理委员会审批(BUCM-4-2020082503-3075)。
1.1.2 主要试剂 RPMI1640 细胞培养液购自美国Cytiva 公司;青霉素和链霉素混合液、胎牛血清购自美国Corning 公司;Hank´s 平衡盐溶液(Hank´s balanced salt solution,HBSS)购自美国ThermoFisher公司;红细胞裂解液购自北京佰瑞达生物科技有限公司;FITC 标记的大鼠抗小鼠CD117 抗体、PE 标记的大鼠抗小鼠CD49b 抗体、APC 标记的大鼠抗小鼠FcεRⅠ抗体、7-氨基放线菌素D(7-AAD)死细胞染色液购自美国BD Biosciences 公司;干细胞因子(stem cell factor,SCF)、IL-3 购自美国PeproTech 公司;牛血清白蛋白、偶联牛血清白蛋白的二硝基苯(DNP-BSA)、抗DNP 的IgE 抗体、β-己糖胺酶底物4-硝基苯基N-乙酰基-β-D-氨基葡萄糖购自美国Sigma-Aldrich 公司;磷脂酶C(phospholipase C,PLC)抑制剂U73122、蛋白激酶C(protein kinase C,PKC)抑制剂Staurosporine购自美国Selleck Chemicals公司。
1.1.3 主要仪器 MCO-18AIC CO2细胞培养箱购自日本三洋公司;DM500倒置显微镜购自德国Leica公司;FACSCantoTMⅡ流式细胞仪购自美国BD 公司;Enspire多功能酶标仪购自美国PerkinElmer公司。
1.2 方法
1.2.1 肥大细胞诱导培养 颈椎脱臼处死C57BL/6小鼠,75%乙醇浸泡小鼠全身5 min,超净台无菌取小鼠股骨骨髓,利用1 ml 注射器吸取含10%胎牛血清的RPMI1640 培养基将骨髓细胞冲至15 ml 无菌离心管,室温300 g 离心5 min,弃上清;加5 ml 红细胞裂解液裂解红细胞,室温300 g 离心5 min,弃上清;加5 ml 含10%胎牛血清的RPMI1640 培养基清洗细胞,室温300 g 离心5 min,弃上清;加入含10%胎牛血清的RPMI1640 培养基重悬细胞,经细胞计数后调整细胞浓度为2×106个/ml,接种至24 孔板(500 µl/孔);设置3 种不同刺激孔:SCF 孔(终浓度50 ng/ml)、IL-3 孔(终浓度20 ng/ml)及SCF(终浓度50 ng/ml)和IL-3(终浓度20 ng/ml)联合刺激孔,培养基总体积1 ml;37 ℃、5%CO2培养4 周,每3.5 d 半量更新培养基,并重新添加1次细胞因子。
1.2.2 倒置显微镜观察细胞生长 第1、2、3、4 周取上述细胞在倒置显微镜下观察细胞形态及生长情况并进行拍照。
1.2.3 细胞计数和传代 第1、2、3、4周重悬细胞,取各孔细胞悬液10 µl与等体积台盼蓝染色液混合,吸取到细胞计数板,倒置显微镜下进行活细胞计数,根据细胞增殖情况按适当比例传代培养。
1.2.4 流式细胞术分析肥大细胞 第1、2、3、4 周取各孔部分细胞至2 ml 离心管,4 ℃、300 g 离心5 min 后弃上清,并利用200 µl 流式染色缓冲液(含0.2%牛血清白蛋白的磷酸盐缓冲液,pH=7.2)重悬;各样本中加入FTIC标记的大鼠抗小鼠CD117抗体、PE 标记的大鼠抗小鼠CD49b 抗体、APC 标记的大鼠抗小鼠FcεRⅠ抗体和死细胞染色液7-AAD,终浓度均为1 µg/ml,冰浴染色30 min;加入1 ml 流式染色缓冲液清洗细胞,4 ℃、300 g 离心5 min 后弃上清,加入400 µl流式染色缓冲液重悬细胞,流式细胞仪检测细胞表面FcεRⅠ和CD117表达。
1.2.5 肥大细胞功能测定 将上述各孔诱导培养4 周的细胞收集至15 ml 离心管,离心去上清,利用含10%胎牛血清的RPMI1640 培养基调整细胞浓度为1.5×106个/ml,100 µl/孔接种至96 孔板,设置对照组、模型组及模型+给药组;将细胞置于37 ℃、5%CO2培养,6 h后模型组及模型+给药组50 µl/孔加入抗DNP 的IgE 抗体,其余孔加入等体积含10%胎牛血清的RPMI1640 培养基,37 ℃、5%CO2孵育过夜;弃上清,100 µl/孔加入HBSS缓冲液孵育10 min,模型+给药组50 µl/孔加入U73122(终浓度1 µmol/L)或Staurosporine(终浓度1 µmol/L),其余孔加入等体积HBSS,孵育15 min,模型组及模型+给药组各孔加入50 µl DNP-BSA 至终浓度1 µg/ml,孵育1 h,取出96孔板,每孔吸50 µl细胞上清至另一96孔板,向上清中50 µl/孔加入4-硝基苯基N-乙酰基-β-D-氨基葡萄糖(pH=4.5 的0.05 mol/L 柠檬酸缓冲液配制,浓度为1 mmol/L)孵育1 h,加入200 µl 0.05 mol/L碳酸盐缓冲液(pH=10.0)终止反应,酶标仪于405 nm处测定OD值。
1.3 统计学处理 利用FlowJo 7 软件分析流式细胞检测的源文件,分析活细胞中肥大细胞和嗜碱性粒细胞比例。定量数据利用表示,GraphPad Prism 5.0 软件进行统计学分析,数据间比较采用单因素方差分析及后续Dunnett 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 细胞生长状态 倒置显微镜下观察发现,体外培养3 d 时,开始铺板的部分细胞死亡碎片化,SCF 刺激孔仅剩余少量细胞,IL-3 单独刺激孔、SCF和IL-3 联合刺激孔有明显细胞增殖;1 周时,SCF 刺激孔细胞有少量增殖,IL-3 单独刺激孔、SCF 和IL-3联合刺激孔出现较快细胞增殖;2 周时,SCF 刺激孔细胞仍有少量增殖,IL-3 单独刺激孔、SCF 和IL-3 联合刺激孔细胞增殖很快,体积较大的增殖期细胞较多;3周时,SCF 刺激孔细胞基本停止增殖,IL-3单独刺激孔、SCF 和IL-3联合刺激孔细胞增殖仍很快,体积较大的增殖期细胞较多;4 周时,SCF 刺激孔细胞明显减少,细胞碎片增多,IL-3 单独刺激孔、SCF 和IL-3 联合刺激孔细胞增殖仍很快,SCF 和IL-3 联合刺激孔细胞相比IL-3 单独刺激孔增殖期细胞比例更高(图1)。

图1 细胞体外培养照片(×100)Fig.1 Pictures of cultured cells in vitro(×100)
2.2 活细胞计数 根据细胞计数结果和传代数量及比例统计不同培养时间各刺激组细胞总数,结果显示不同细胞因子处理孔细胞增殖情况存在较大差异,SCF 刺激孔细胞增殖速度最慢,SCF 和IL-3 联合刺激孔细胞增殖速度最快。体外培养2 周后,IL-3刺激孔细胞数量相比SCF 单独刺激孔显著增加(P<0.05);体外培养1 周后SCF 和IL-3 联合刺激孔细胞数量相较SCF 刺激孔和IL-3 刺激孔显著增加(P<0.05,图2)。

图2 各诱导条件对活骨髓细胞总数的影响Fig.2 Effects of different induction conditions on total numbers of live bone marrow cells
2.3 BMMC 分化 骨髓细胞培养的第1、2、3、4 周,收集经各种诱导条件处理的细胞进行流式分析,FlowJo 软件分析7-AAD-细胞中CD117 和FcεRⅠ表达,结果显示随着诱导时间增长,SCF刺激孔、IL-3刺激孔、SCF 和IL-3 联合刺激孔中7-AAD-CD117+FcεRⅠ+肥大细胞在7-AAD-细胞中占比也逐渐升高。细胞培养4 周流式图可见,SCF 单独刺激孔和IL-3 单独刺激孔仍具有明显分群的杂细胞,SCF 和IL-3 联合刺激孔中主要为单一细胞群,根据统一的设门标准,BMMC 比例为52%左右,其他细胞可能为幼稚期肥大细胞(图3A)。根据各刺激孔中活细胞总数和7-AAD-CD117+FcεRⅠ+BMMC 比例,计算各孔中BMMC 总数,结果显示3 种诱导条件均可使BMMC 比例及总数上升,IL-3 单独刺激孔BMMC 比例最高(P<0.05),SCF 和IL-3 联合孔BMMC 总数显著高于SCF 单独刺激孔和IL-3 单独刺激孔(P<0.05,图3B、C)。
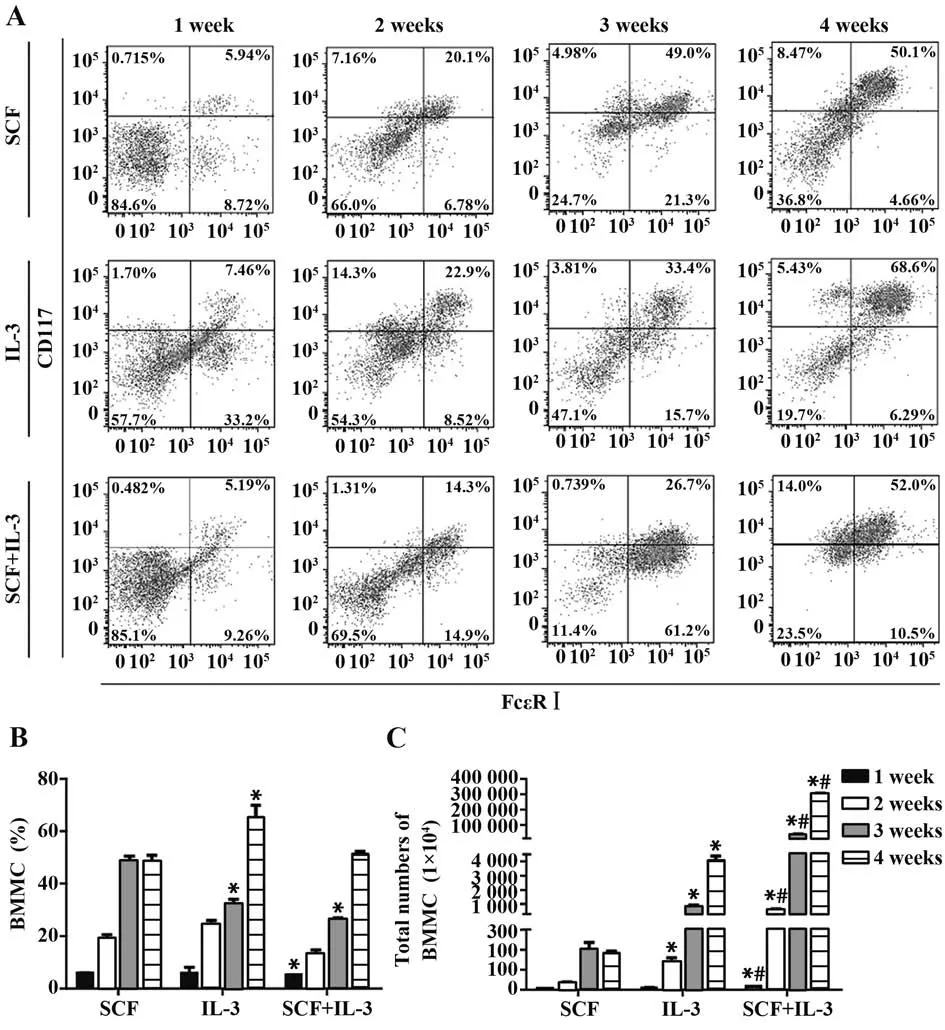
图3 流式细胞术分析BMMC分化Fig.3 Analysis of BMMC differentiation by flow cytometry
2.4 嗜碱性粒细胞分化 分析BMMC 分化同时,本研究也分析了嗜碱性粒细胞分化,通过分析7-AAD-细胞CD49b和FcεRⅠ表达,分析不同诱导条件下7-AAD-CD49b+FcεRⅠ+嗜碱性粒细胞在7-AAD-细胞中的占比,结果显示SCF 刺激孔嗜碱性粒细胞比例始终非常低;IL-3 刺激孔嗜碱性粒细胞比例最高,但随着诱导时间增长,嗜碱性粒细胞比例不断下降;SCF 和IL-3 联合刺激孔同样是初期有一定比例嗜碱性粒细胞,但随着时间增长比例逐渐降低(图4A)。根据各种诱导条件刺激孔活细胞总数和7-AAD-CD49b+FcεRⅠ+嗜碱性粒细胞比例,计算各孔嗜碱性粒细胞总数,结果显示在3 种诱导条件下的嗜碱性粒细胞比例及总数有显著差异,IL-3 刺激孔嗜碱性粒细胞比例1 周起即显著高于SCF 刺激孔及SCF 和IL-3 联合刺激孔(P<0.05);SCF 和IL-3 联合刺激孔嗜碱性粒细胞比例一开始显著高于SCF刺激孔(P<0.05),但4周后嗜碱性粒细胞比例降低,与SCF 刺激孔差异无统计学意义。IL-3 刺激孔嗜碱性粒细胞总数从1 周起显著高于SCF 刺激孔(P<0.05);SCF 和IL-3联合刺激孔嗜碱性粒细胞总数从1 周起即显著高于SCF 刺激孔,2 周起显著高于IL-3刺激孔(P<0.05,图4B、C)。
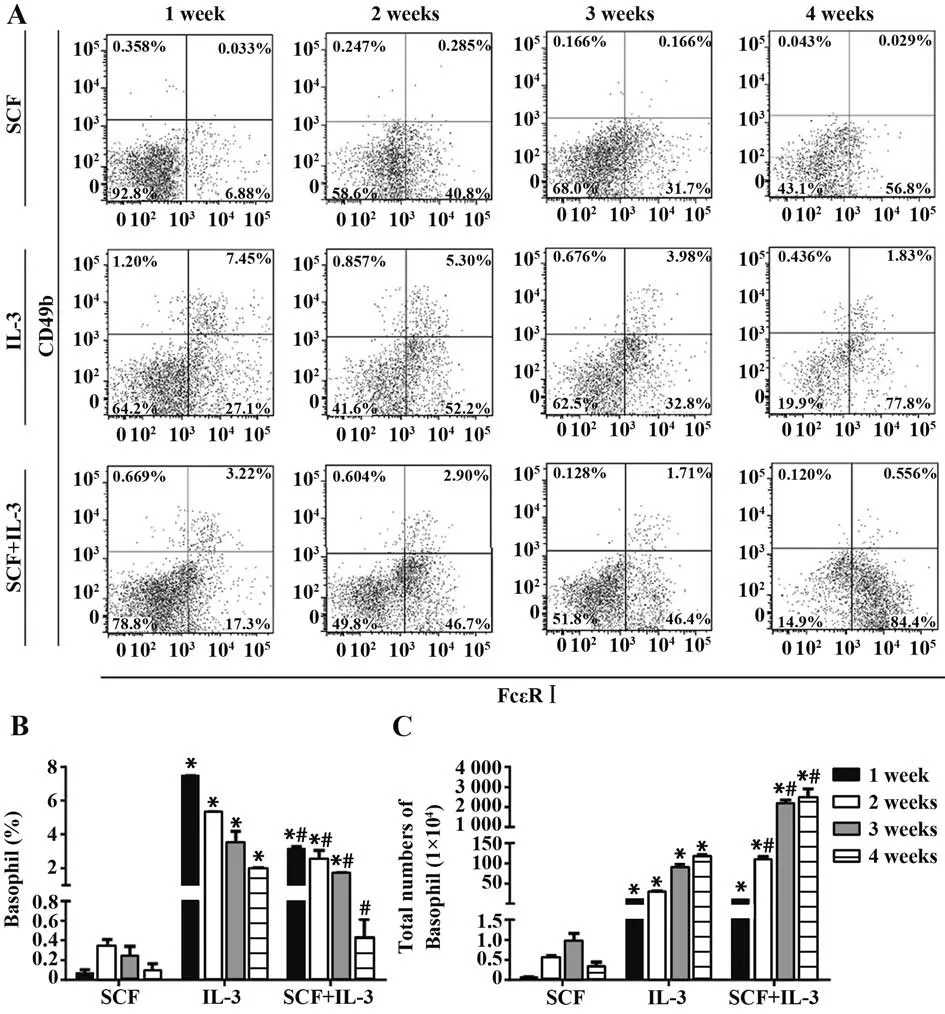
图4 流式细胞术分析嗜碱性粒细胞分化Fig.4 Analysis of basophil differentiation with flow cytometry
2.5 BMMC的释放功能 根据流式分析,诱导培养4 周,SCF 和IL-3 联合刺激孔细胞主要为BMMC,收集该细胞,利用抗DNP 的IgE 抗体致敏BMMC,加入DNP-BSA 刺激BMMC 释放颗粒,测定β-己糖胺酶释放量评价BMMC 释放功能,结果显示诱导培养4 周后,SCF 和IL-3 联合刺激孔BMMC 经抗DNP 的IgE抗体致敏和DNP-BSA 刺激后β-己糖胺酶释放量较对照组显著升高(P<0.05)。同时分析了BMMC 活化和颗粒释放中需要的PLC 和PKC 抑制剂对其释放β-己糖胺酶的调节作用,结果显示PLC 抑制剂U73122 和PKC 抑制剂Staurosporine 处理组相比模型组均能显著抑制β-己糖胺酶释放(P<0.05,图5)。

图5 BMMC释放β-己糖胺酶分析Fig.5 Analysis of β-hexosaminidase release of BMMC
3 讨论
SCF 及其受体c-Kit 在造血干细胞和祖细胞发育中发挥重要作用,对肥大细胞发育发挥不可替代的作用,SCF 或c-Kit 基因突变均会导致肥大细胞大幅度减少,皮下注射外源SCF 则会导致注射部位肥大细胞大幅度增加[10-12]。IL-3 同样对早期造血祖细胞和部分晚期祖细胞发育发挥重要作用,体内注射IL-3 能够导致肥大细胞和嗜碱性粒细胞显著增加[13]。目前常用的肥大细胞原代培养方法有SCF/IL-3 单独诱导以及SCF 和IL-3 联合诱导,肥大细胞的原代培养方法尚无确定标准[14-18],因此本研究比较了不同诱导方式对肥大细胞分化的影响,确定肥大细胞诱导培养的最适宜方法和时间,初步建立了一种高效可行的原代肥大细胞培养方法。
本研究显示SCF 单独诱导可促进肥大细胞分化,提高肥大细胞比例,但对肥大细胞分化过程中的细胞增殖促进作用较弱,获得的肥大细胞总数较少,表明SCF 单独诱导可能仅能促进晚期肥大细胞祖细胞增殖和分化,获得的肥大细胞纯度和数量均有限。IL-3单独诱导相较于SCF 单独诱导不仅促进了肥大细胞分化,提升肥大细胞比例,同时也促进了肥大细胞分化过程中的细胞增殖,培养4 周获得的肥大细胞总数是SCF 单独诱导培养的10 倍,可能由于IL-3 对能够分化为肥大细胞祖细胞的早期造血细胞增殖和分化具有促进作用。SCF 和IL-3联合诱导相对于SCF单独诱导肥大细胞纯度和总数均有显著提高;SCF 和IL-3 联合诱导相对于IL-3 单独诱导培养得到的肥大细胞纯度有所降低,但总数是IL-3 单独诱导的100 倍,表明SCF 和IL-3 联合诱导能够促进多个层次造血祖细胞增殖和分化为肥大细胞,显著提高获得的肥大细胞质量和数量。虽然SCF 和IL-3 联合诱导4 周获得的肥大细胞中有较多幼稚细胞,但获得的肥大细胞纯度和数量非常可观。
IL-3能够诱导嗜碱性粒细胞产生[13]。本研究同时分析了嗜碱性粒细胞分化,结果表明SCF 单独诱导未提高嗜碱性粒细胞比例和总数。IL-3单独诱导可较强地促进骨髓细胞向嗜碱性粒细胞分化,嗜碱性粒细胞比例最高的时间为诱导后第1周。随着体外培养时间延长,嗜碱性粒细胞比例不断下降,总数增加幅度也非常有限,可能由于IL-3 仅能促进晚期造血祖细胞分化为嗜碱性粒细胞,同时嗜碱性粒细胞存活时间较短。SCF 和IL-3联合诱导各时间点嗜碱性粒细胞比例均低于IL-3单独诱导,SCF和IL-3联合诱导的嗜碱性粒细胞总数在第2 周后高于IL-3单独诱导,但数量远低于肥大细胞。因此,SCF 和IL-3 联合诱导骨髓细胞4 周可获得大量高纯度的肥大细胞。
获得大量高纯度的肥大细胞后,本研究进一步利用抗DNP 的IgE 抗体致敏和DNP-BSA 刺激肥大细胞脱颗粒反应,通过检测释放的β-己糖胺酶活性评价肥大细胞功能[14-15],结果表明SCF 和IL-3 联合诱导骨髓细胞4 周获得的肥大细胞经抗DNP 的IgE抗体致敏和DNP-BSA 刺激后,β-己糖胺酶释放量较对照组显著升高,表明SCF 和IL-3 联合诱导培养4 周的肥大细胞具有完整功能。另外本研究分析了PLC 抑制 剂U73122 和PKC 抑制剂Staurosporine 对肥大细胞β-己糖胺酶释放的调节作用,结果显示两种阳性抑制剂均能显著抑制肥大细胞释放β-己糖胺酶,表明SCF 和IL-3 联合诱导培养4 周的肥大细胞可用于抗过敏药物的药效和作用机制研究。
综上,本研究发现SCF 和IL-3 联合诱导骨髓细胞4 周能够获得大量高纯度且功能完整的肥大细胞,可用于后续通过调节肥大细胞功能用于抗过敏药物的药效和作用机制研究。

