人参皂苷Rg1 对脓毒症所致心肌损伤大鼠NF-κB 磷酸化水平及炎症相关通路的影响
荆 忻 胡 文 沈 佳 罗彩琴 杨 波 荆 忱
(深圳市前海蛇口自贸区医院重症医学科,深圳 518000)
脓毒症是机体对各种感染反应失调而引起的全身炎症反应,导致危及生命的器官功能障碍,具有发病率和病死率高、发病机制复杂、病情严重的特点,严重时会造成休克[1-2]。心肌功能障碍是脓毒症的常见并发症,临床主要表现为心室扩张、舒张和收缩功能障碍[3]。但其发病机制尚不明确,目前认为可能与氧化应激、炎症反应、细胞凋亡、内毒素及能量代谢等有关[4-6]。研究显示心肌炎症及炎症信号持续激活是脓毒症心功能障碍的起始环节[7]。Toll 样受体4/核因子-κB(Toll-like receptor 4/nuclear factor-κB,TLR4/NF-κB)信号通路在免疫应答和炎症反应早期扮演重要角色,尤其与心肌炎症性损伤密切相关,NF-κB 通过诱导促炎因子IL-6、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)表达造成心肌损伤[8]。由于脓毒症所致心肌损伤致死率高,同时缺乏安全有效的治疗药物,因此探讨脓毒症所致心肌损伤的发病机制和寻找治疗药物至关重要。人参皂苷Rg1是人参、三七的主要活性成分,具有抗炎、抗感染、抗肿瘤及免疫功能调节等作用[9]。大量研究表明人参皂苷Rg1 对脓毒症具有很好的治疗效果[10]。如卿城等[11]发现人参皂苷Rg1通过抑制IL-6、TNF-α表达保护脂多糖(lipopolysaccharide,LPS)诱导的小鼠心肌细胞损伤。张振波等[12]发现人参皂苷Rg1单独或联合抗生素亚胺培南均能治疗脓毒症小鼠急性肺损伤,改善小鼠肺组织炎症性浸润、降低肺泡灌洗液NF-κB、IL-6、IL-1β、TNF-α水平。ZOU等[13]发现人参皂苷Rg1通过减弱脓毒症小鼠炎症反应及淋巴细胞凋亡提高小鼠存活率。人参皂苷Rg1对脓毒症所致心肌损伤的保护机制仍未阐明,能否作为脓毒症心肌损伤的治疗用药也需进一步研究。
因此,本研究通过盲肠结扎穿孔(cecal ligation and perforation,CLP)法构建大鼠脓毒症心肌损伤模型及LPS 构建体外脓毒症细胞模型,探究人参皂苷Rg1 对NF-κB 磷酸化水平及炎症相关通路的影响,为进一步研究人参皂苷Rg1作为心肌功能障碍的治疗用药提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级8周龄雄性SD大鼠60只,体质量200~230 g,购自北京生物制品研究所有限责任公司,生产许可证号:SYXK(京)2020-0031。饲养环境为室温23~25 ℃、标准湿度55%~60%、12 h/12 h昼夜交替、正常饲料饮水、分笼饲养。饲养1周后用于实验。本研究经深圳市前海蛇口自贸区医院伦理委员会批准(20201521)。
1.1.2 主要试剂和仪器 人参皂苷Rg1(宝鸡市晨光生物科技有限公司);瑞沙托维(TAK-242,上海源叶生物科技有限公司);LPS(北京索莱宝生物科技有限公司);Annexin V-FITC/PI双染色法凋亡检测试剂盒(大连宝生物工程有限公司);IL-6、IL-1β、TNF-α ELISA 试剂盒(武汉博士德生物工程有限公司);肌钙蛋白Ⅰ(cardiac troponin Ⅰ,cTnⅠ)、肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactate dehydrogenase,LDH)、天冬氨酸转氨酶(aspartate aminotransferase,AST)ELISA 试剂盒(默沙克生物科技有限公司);TLR4、NF-κB p65、p-NF-κB p65、p38 丝裂原活化蛋白激酶(p38 mitogen activated protein kinase,p38MAPK)、p-p38MAPK、核苷酸结合寡聚化结构域样受体蛋白3(nucleotide binding oligomerization domain-like receptor protein 3,NLRP3)抗体(美国Selleck 公司);二抗(北京博尔西科技有限公司);RIPA 裂解液、BCA 蛋白浓度测定试剂盒(北京中杉金桥生物技术有限公司);Thermo 酶标仪(上海热电仪器有限公司);组织包埋机(德国Leica公司);台式冰冻离心机(美国Beckman 公司);Bio-Rad蛋白电泳仪、转膜仪、凝胶成像仪(美国伯乐公司);光学显微镜(日本Olympus公司)。
1.2 方法
1.2.1 大鼠分组及模型制作 60 只大鼠随机分为6 组:假手术组(sham 组)、脓毒症模型组(CLP 组)、人参皂苷Rg1 低剂量组(CLP+Rg1L组)、人参皂苷Rg1 中剂量组(CLP+Rg1M组)、人参皂苷Rg1 高剂量组(CLP+Rg1H组)、TLR4 信号通路抑制剂瑞沙托维(TAK-242)组(CLP+TAK-242 组),每组10 只。各组大鼠腹腔注射3%戊巴比妥钠麻醉,固定后沿腹白线切开约2 cm,打开腹腔并找到盲肠,用3-0 丝线结扎盲肠远端,22 号针头穿刺两处,轻轻挤压盲肠将少量粪便挤至腹腔,还纳盲肠,逐层缝合腹壁切口。sham 组仅探查盲肠不进行盲肠结扎穿孔。各组大鼠术后腹腔注射30 ml/kg 生理盐水进行复苏。48 h后大鼠出现活动减少、食欲减退,解剖发现肠腔粘连、水肿、出血,即为造模成功。CLP+Rg1L组、CLP+Rg1M组、CLP+Rg1H组腹腔注射5、10、20 mg/kg 人参皂 苷Rg1[14],CLP+TAK-242 组腹腔注射3 mg/kg TAK-242;sham 组、CLP 组腹腔注射等量生理盐水,于造模2 h、26 h、50 h 各给药1 次,各组于末次给药2 h 后麻醉大鼠测定血流动力学参数,随后处死大鼠,检测相应指标。
1.2.2 细胞分组及模型制作 将心肌细胞随机分为6 组:对照组(control 组)、心肌细胞损伤组(LPS组)、LPS+Rg1L组、LPS+Rg1M组、LPS+Rg1H组、LPS+TAK-242 组。LPS+Rg1L组、LPS+Rg1M组、LPS+Rg1H组、LPS+TAK-242 组细胞培养基中分别加入终浓度为25、50、100 µmol/L 的人参皂苷Rg1 及10 µg/ml TAK-242预处理12 h,随后与LPS组同时加入10 mg/L LPS 共培养6 h。control 组不进行药物干预。培养结束后各组分别收集细胞和上清,检测相应指标。
1.2.3 血流动力学参数测定 各组大鼠麻醉处理,右颈总动脉插管,PowerLab 系统测定平均动脉压(mean arterial blood pressure,MABP)、左心室发展压(left ventricular development pressure,LVDP)、心率(heart rate,HR)、左心室压力最大上升/下降速率(maximal increase/decrease rate of left ventricular pressure,±dp/dtmax)。
1.2.4 HE 染色观察大鼠心肌组织病理学改变
取出4%多聚甲醛固定的心肌组织,石蜡包埋,切3 µm 片,二甲苯脱蜡、苏木精-伊红染色、乙醇梯度脱水、二甲苯透明、中性胶封固,显微镜(×400)下观察心肌细胞结构及排列情况。
1.2.5 Annexin V-FITC/PI 双染法检测大鼠心肌组织和H9C2 细胞凋亡 取大鼠心肌组织和H9C2 细胞,加入适量胰蛋白酶消化,70 µm 滤网过滤制成单细胞悬液,加入500 µl Binding Buffer 悬浮细胞,再各加入10 µl Annexin V-FITC 和PI避光孵育30 min,流式细胞仪检测细胞凋亡,NovoExpressTM软件分析。
1.2.6 ELISA检测大鼠血清和H9C2细胞心肌酶指标及炎症因子含量 取各组大鼠腹主动脉血和H9C2细胞,腹主动脉血离心后分离上清,H9C2细胞中加入1.0 ml PBS 冰上研磨,离心取上清,按ELISA试剂盒操作说明书进行包被、加样、加抗体、显色、终止反应,同时稀释标准品,绘制标准曲线,酶标仪于450 nm 处检测吸光度,代入曲线计算CK、LDH、AST、cTnⅠ、TNF-α、IL-6、IL-1β含量。
1.2.7 CCK-8 及EdU 染色检测H9C2 细胞增殖能力 分别于24 h、48 h、72 h 取出培养的H9C2 细胞,10 µl/孔加入 CCK-8 溶液,每孔设3 个复孔,37 ℃培养2 h,酶标仪于450 nm 处检测吸光度。调整细胞密度为3×105个/孔并接种于24孔板,培养24 h,按照EdU 染色试剂盒说明进行染色、固定、封片,LAS AF Lite图像处理软件进行统计分析。
1.2.8 RT-qPCR 检测心肌组织TLR4、NF-κB p65、p38MAPK mRNA 表达 取大鼠心肌组织,采用Trizol法提取总RNA。将RNA 反转录为cDNA,采用SBRY super Mix 进行扩增,β-actin 作为内参。反应条件:95 ℃ 10 min,95 ℃ 30 s,60 ℃ 60 s,共40 个循环。2-ΔΔCt计算TLR4、NF-κB p65、p38MAPK mRNA相对表达。PCR 引物序列TLR4 F:5´-ACTGCTCTGATATGATCGATAGCTAT-3´;TLR4 R:5´-TCGATAGCTAGATCGATTAGCTATGATCTAG-3´;NF-κB p65 F:5´-TGTTTCCCCTCATCTTTCC-3´,NF-κB p65 R:5´-GTGGTATCTGTGCTTCTCTCC-3´。p38MAPK F:5´-TACGCTAGATTTAGCTATAGCTAGGCGAACTC-3´,p38MAPK R:5´-ATCGCTAGATCGATATATCGATCGTAGCTAGCTA-3´。β-actin F:5´-GGAGATTACTGTTAGGCTCCTA-3´;β-actin R:5´-GACTCATCGTACTCCTGCTTGCTG-3´。
1.2.9 Western blot 检 测心肌 组织TLR4、NF-κB p65、p-NF-κB p65、p38MAPK、p-p38MAPK、NLRP3蛋白表达 取冻存的心肌组织,加入RIPA 裂解液,超声匀浆提取总蛋白,BCA 蛋白检测试剂盒测定蛋白浓度。将蛋白沸水浴变性,取等量变性蛋白进行SDS-PAGE 电泳,湿转至PVDF 膜,5%脱脂牛奶封闭2 h,加入一抗TLR4、NF-κB p65、p-NF-κB p65、p38MAPK、p-p38MAPK、NLRP3(1∶2 000)4 ℃孵育过夜,TBST漂洗3次,加入二抗(1∶10 000)室温孵育2 h,ECL化学发光剂显影,以β-actin为内参,Image J软件分析发光结果灰度。
1.3 统计学分析 采用SPSS16.0 软件统计数据,Graphpad5.0 软件制图,计量资料以表示,数据间比较采用独立t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 人参皂苷Rg1对心肌损伤大鼠的保护作用
2.1.1 各组大鼠MABP 和心功能变化 心功能指标检测结果显示,与sham 组相比,CLP 组大鼠MABP、LVDP×HR 和±dp/dtmax绝对值明显降低(P<0.05);与CLP 组相比,CLP+Rg1L组、CLP+Rg1M组、CLP+Rg1H组和CLP+TAK-242 组大鼠MABP、LVDP×HR 和±dp/dtmax绝对值均明显升高(P<0.05,图1、表1),且呈剂量依赖性。
表1 各组大鼠血流动力学参数比较(,n=10)Tab.1 Comparison of hemodynamic parameters of rats in each group(,n=10)

表1 各组大鼠血流动力学参数比较(,n=10)Tab.1 Comparison of hemodynamic parameters of rats in each group(,n=10)
Note:Compared with sham group,1)P<0.05;compared with CLP group,2)P<0.05.

图1 各组大鼠心功能变化比较Fig.1 Comparison of changes in cardiac function of rats in each group
2.1.2 各组大鼠心肌组织病理学比较 HE 染色结果显示,心肌细胞染成紫红色,细胞核染成蓝色。sham 组大鼠心肌细胞排列整齐,组织结构分布正常,未见间质水肿及炎症细胞浸润;CLP组心肌纤维排列紊乱、断裂,束间隔增宽,细胞肿胀及坏死,可见大量炎症细胞浸润;CLP+Rg1L组、CLP+Rg1M组、CLP+Rg1H组和CLP+TAK-242 组上述病理损伤明显减轻,心肌纤维排列稍紊乱,存在少量炎症细胞浸润,且人参皂苷Rg1剂量越高,心肌损伤缓解越明显(图2)。
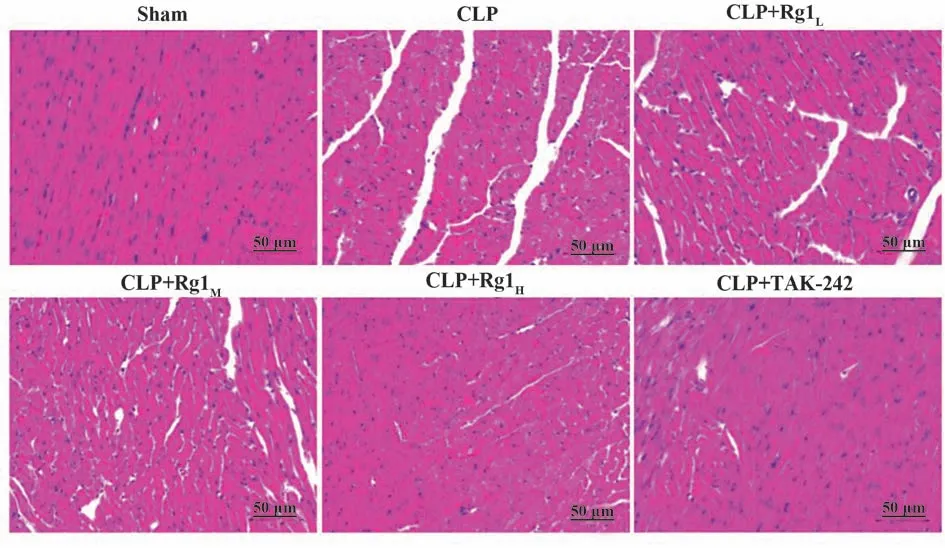
图2 各组大鼠心肌组织病理学比较(×400)Fig.2 Histopathological comparison of myocardial tissues of rats in each group(×400)
2.1.3 各组大鼠心肌组织细胞凋亡比较 Annexin V-FITC/PI 双染法结果显示,与sham 组相比,CLP 组大鼠细胞凋亡水平明显升高(P<0.05);与CLP 组相比,CLP+Rg1L组、CLP+Rg1M组、CLP+Rg1H组和CLP+TAK-242 组大鼠细胞凋亡水平明显降低(P<0.05,图3),且呈剂量依赖性。

图3 各组大鼠心肌组织细胞凋亡比较Fig.3 Comparison of apoptosis in cardiomyocytes of rats in each group
2.1.4 各组大鼠血清心肌酶及肌钙蛋白水平比较 ELISA结果显示,与sham组相比,CLP组大鼠血清CK、LDH、AST 活力、cTn Ⅰ水平明显升高(P<0.05);与CLP 组相比,CLP+Rg1L组、CLP+Rg1M组、CLP+Rg1H组和CLP+TAK-242组大鼠血清CK、LDH、AST 活力、cTnⅠ水平明显降低(P<0.05,表2),且呈剂量依赖性。
表2 各组大鼠心肌酶及肌钙蛋白比较(,n=10)Tab.2 Comparison of myocardial enzymes and troponin of rats in each group(,n=10)
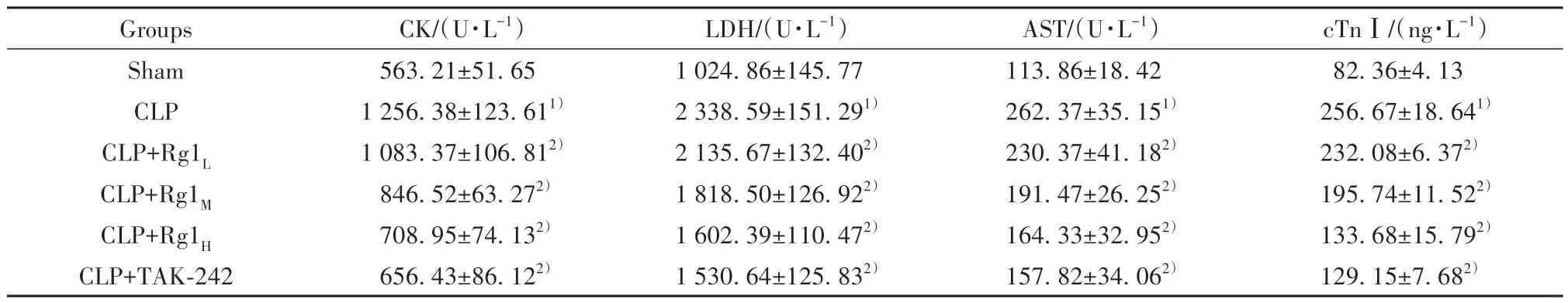
表2 各组大鼠心肌酶及肌钙蛋白比较(,n=10)Tab.2 Comparison of myocardial enzymes and troponin of rats in each group(,n=10)
Note:Compared with sham group,1)P<0.05;compared with CLP group,2)P<0.05.
2.1.5 各组大鼠血清炎症因子水平比较 ELISA结果显示,与sham 组相比,CLP 组大鼠血清TNF-α、IL-1β、IL-6水平明显升高(P<0.05);与CLP 组相比,CLP+Rg1L组、CLP+Rg1M组、CLP+Rg1H组 和CLP+TAK-242 组TNF-α、IL-1β、IL-6 水平明显降低(P<0.05,表3),且呈剂量依赖性。
表3 各组大鼠血清炎症因子水平比较(,n=10,pg/ml)Tab.3 Comparison of serum inflammatory factors levels of rats in each group(,n=10,pg/ml)

表3 各组大鼠血清炎症因子水平比较(,n=10,pg/ml)Tab.3 Comparison of serum inflammatory factors levels of rats in each group(,n=10,pg/ml)
Note:Compared with sham group,1)P<0.05;compared with CLP group,2)P<0.05.
2.2 人参皂苷Rg1对损伤心肌细胞的保护作用
2.2.1 各组细胞增殖能力比较 CCK-8结果显示,与control组相比,LPS组细胞存活能力明显降低(P<0.05);与LPS 组相比,LPS+Rg1L组、LPS+Rg1M组、LPS+Rg1H组和LPS+TAK-242 组细胞存活能力明显升高(P<0.05,图4A)。EdU 染色结果(图4B)显示,与control 组相比,LPS 组细胞EdU 阳性比例明显降低(P<0.05);与LPS 组相比,LPS+Rg1L组、LPS+Rg1M组、LPS+Rg1H组和LPS+TAK-242组细胞EdU 阳性比例明显升高(P<0.05),且呈剂量依赖性。

图4 各组细胞存活能力比较Fig.4 Comparison of cell viability in each group
2.2.2 各组细胞凋亡能力比较 Annexin V-FITC/PI双染法结果显示,与control 组相比,LPS 组细胞凋亡水平明显升高(P<0.05);与LPS 组相比,LPS+Rg1L组、LPS+Rg1M组、LPS+Rg1H组和LPS+TAK-242组细胞凋亡水平明显降低(P<0.05,图5),且呈剂量依赖性。

图5 各组细胞凋亡能力比较Fig.5 Comparison of cell apoptosis ability in each group
2.2.3 各组细胞炎症因子水平比较 ELISA 结果显示,与control 组相比,LPS 组细胞TNF-α、IL-1β、IL-6 水平明显升高(P<0.05);与LPS 组相比,LPS+Rg1L组、LPS+Rg1M组、LPS+Rg1H组和LPS+TAK-242组TNF-α、IL-1β、IL-6水平明显降低(P<0.05,表4),且呈剂量依赖性。
表4 各组细胞炎症因子水平比较(,n=10,pg/ml)Tab.4 Comparison of inflammatory factors levels in cells of each group(,n=10,pg/ml)
Note:Compared with control group,1)P<0.05;compared with LPS group,2)P<0.05.
2.3 人参皂苷Rg1 对大鼠心肌组织NF-κB 磷酸化水平及炎症相关通路的影响 RT-qPCR 检测各组大鼠心肌组织TLR4、NF-κB p65、p38MAPK mRNA表达,Western blot 检测TLR4、p-NF-κB p65/NF-κB p65、p-p38MAPK/p38MAPK、NLRP3 蛋白水平发现,与sham 组相比,CLP 组TLR4、NF-κB p65、p38MAPK mRNA和TLR4、p-NF-κB p65/NF-κB p65、p-p38MAPK/p38MAPK、NLRP3 蛋白水平明显上调(P<0.05);与CLP 组相比,CLP+Rg1L组、CLP+Rg1M组、CLP+Rg1H组和CLP+TAK-242 组TLR4、NF-κB p65、p38MAPK mRNA和TLR4、p-NF-κB p65/NF-κB p65、p-p38MAPK/p38MAPK、NLRP3蛋白水平明显下调(P<0.05,表5、表6、图6),且呈剂量依赖性。
表5 各组大鼠心肌组织TLR4、NF-κB p65、p38MAPK mRNA表达比较(,n=10)Tab.5 Comparison of TLR4,NF-κB p65,p38MAPK mRNA expressions in myocardial tissues of rats in each group(,n=10)

表5 各组大鼠心肌组织TLR4、NF-κB p65、p38MAPK mRNA表达比较(,n=10)Tab.5 Comparison of TLR4,NF-κB p65,p38MAPK mRNA expressions in myocardial tissues of rats in each group(,n=10)
Note:Compared with sham group,1)P<0.05;compared with CLP group,2)P<0.05.
表6 各组大鼠心肌组织TLR4、p-NF-κB p65/NF-κB p65、p-p38MAPK/p38MAPK、NLRP3蛋白表达比较(,n=10)Tab.6 Comparison of protein expressions of TLR4,p-NF-κB p65/NF-κB p65,p-p38MAPK/p38MAPK and NLRP3 in myocardial tissues of rats in each group(,n=10)

表6 各组大鼠心肌组织TLR4、p-NF-κB p65/NF-κB p65、p-p38MAPK/p38MAPK、NLRP3蛋白表达比较(,n=10)Tab.6 Comparison of protein expressions of TLR4,p-NF-κB p65/NF-κB p65,p-p38MAPK/p38MAPK and NLRP3 in myocardial tissues of rats in each group(,n=10)
Note:Compared with sham group,1)P<0.05;compared with CLP group,2)P<0.05.

图6 各组大鼠心肌组织TLR4、p-NF-κB p65/NF-κB p65、p-p38MAPK/p38MAPK、NLRP3蛋白表达Fig.6 Expressions of TLR4,p-NF-κB p65/NF-κB p65,pp38MAPK/p38MAPK,NLRP3 protein in myocardial tissues of rats in each group
2.4 人参皂苷Rg1 对脓毒症所致心肌损伤的作用机制 给予CLP处理的心肌组织和LPS处理的心肌细胞不同剂量人参皂苷Rg1,观察人参皂苷Rg1 对心肌组织细胞凋亡、心功能、心肌酶及炎症相关通路的影响,分析人参皂苷Rg1 治疗脓毒症所致心肌损伤的可能机制,发现人参皂苷Rg1 能够促进心肌细胞增殖并抑制凋亡;通过升高MABP、LVDP×HR和±dp/dtmax绝对值改善心脏功能;降低心肌酶CK、LDH、AST 活力及cTnⅠ水平减轻心肌损伤;降低TNF-α、IL-1β、IL-6、NLRP3水平抑制炎症反应;同时NF-κB p65、p38MAPK 磷酸化水平降低。推断人参皂苷Rg1 通过调控TLR4/NF-κB、p38MAPK 信号通路缓解脓毒症所致心肌损伤(图7)。

图7 人参皂苷Rg1对脓毒症所致心肌损伤的作用机制Fig.7 Mechanism of action of ginsenoside Rg1 on sepsisinduced myocardial injury
3 讨论
脓毒症是机体对感染反应失调,导致危及生命的组织损伤和器官功能障碍,其中心肌损伤是脓毒症的常见器官功能障碍,但其发病机制复杂,涉及氧化应激、炎症反应、免疫功能障碍及线粒体功能障碍等[15-17]。目前临床常用脑钠肽(brain natriuretic peptide,BNP)、cTnⅠ水平及超声心动图识别脓毒症所致心肌功能障碍,尚无抑制心肌损伤的靶向药物。人参皂苷Rg1 具有抑制炎症反应、调节免疫功能及促进组织和血管再生等功效,广泛用于各种心肌损伤疾病治疗[18]。如重症肺炎中,人参皂苷Rg1通过抑制TLR4/NF-κB 信号通路减轻炎症反应和细胞凋亡,从而保护大鼠心肌组织[14]。心肌缺血再灌注损伤中,人参皂苷Rg1 通过抑制心肌细胞凋亡和调节能量代谢减轻心肌损伤和改善心脏功能[19]。糖尿病心肌病中,人参皂苷Rg1 通过抑制心肌细胞凋亡和炎症反应改善糖尿病大鼠心肌功能[20]。本研究通过CLP 法构建大鼠脓毒症心肌损伤模型及LPS 构建体外细胞脓毒症模型,发现人参皂苷Rg1能阻断心肌细胞凋亡,减轻细胞炎症水平,增强心功能,从而改善心肌损伤。说明人参皂苷Rg1 对脓毒症所致心肌损伤具有积极意义。
心肌纤维损伤坏死可增强心肌细胞膜通透性,大量释放心肌酶进入血液,使CK、LDH、AST、cTnⅠ等心肌损伤标志物水平升高,其中CK、LDH 常作为反映心肌损伤程度的敏感指标,cTnⅠ是心肌收缩的调节蛋白,是检测心肌损伤的重要指标;MABP、LVDP×HR 和±dp/dtmax等功能性指标水平降低,MABP 反映血管张力变化,HR×LVDP 代表心脏做功,±dp/dtmax绝对值大小反映心脏收缩和舒张功能强弱[21-22]。如李赓等[23]研究表明人参皂苷Rg1 能够降低D-半乳糖所致小鼠心肌梗死面积和CK-MB、LDH 水平,有效防止心肌损伤。陈延勋等[24]发现人参皂苷Rg1通过平衡血管舒缩功能提高机体抗氧化酶活性,改善冠状动脉粥样硬化大鼠心功能。本研究中人参皂苷Rg1 能降低大鼠血清CK、LDH、AST活力、降低cTnⅠ水平,升高MABP、LVDP×HR 和±dp/dtmax水平,且呈剂量依赖性。说明人参皂苷Rg1能减轻心肌损伤,改善心功能。
脓毒症中/晚期,大量炎症因子释放导致免疫细胞活性降低,其中TLR 通路研究最为广泛,TLR4/NF-κB信号通路是脓毒症致心肌损伤的重要通路之一。TLR4 受病原微生物携带的LPS 等物质刺激后可激活IL-1 受体相关激酶、TNF 受体相关因子6,进一步激活NF-κB 诱导酶使活化的NF-κB 发生核位移,诱导细胞释放TNF-α、IL-1β、IL-6 等促炎因子。TNF-α、IL-6 能够抑制Ca2+转运、降解cTnⅠ、促进细胞凋亡、影响线粒体功能等,在心肌组织炎症反应中扮演重要角色。另外,TLR4也可激活下游炎症反应指标p38MAPK 磷酸化,活化的p38MAPK 不但能够促进白细胞聚集、活化,促进细胞因子合成,还能调控炎症级联反应,最终参与脓毒症介导的心肌损伤[25]。国内外也有大量报道证实TLR4/NF-κB、p38MAPK 信号通路活化参与脓毒症肺损伤、心肌损伤及肾损伤等疾病发生[26-27]。如刘杰等[28]发现毛蕊异黄酮调控TLR4/p38MAPK 通路抑制心肌炎症反应,减轻心肌病理改变,从而缓解脓毒症大鼠心肌损伤。赵俊泉等[29]发现白果内酯通过抑制TLR4/NF-κB 信号通路,调节辅助性T 细胞1/2(helper T cell 1/2,Th1/Th2)平衡,减少炎症介质释放,改善脓毒症大鼠急性肺损伤。ZHONG 等[30]发现TNF 超家族成员LIGHT 通过激活TLR4 Myd88 NF-κB 信号通路加重LPS诱导的脓毒症相关急性肾损伤炎症并促进肾脏损伤。本研究中人参皂苷Rg1能降低大鼠受损心肌组织和细胞炎症因子TNF-α、IL-1β、IL-6 及NLRP3 水平,同时抑制NF-κB p65、p38MAPK 蛋白磷酸化水平,说明人参皂苷Rg1 通过调节TLR4/NF-κB、p38MAPK 信号通路减轻损伤心肌组织和细胞炎症程度。
综上,人参皂苷Rg1 能够抑制心肌组织细胞凋亡及炎症水平,提高心功能,从而减轻脓毒症所致心肌损伤,其机制可能与TLR4/NF-κB、p38MAPK 信号通路有关。

