荞麦黄酮通过下调HMGB1抑制高糖诱导的人视网膜微血管内皮细胞损伤的研究
袁小波 彭小珊 周丽丽 唐 静(湘潭市第一人民医院医学转化中心,湘潭 411100)
糖尿病视网膜病变是糖尿病的常见并发症,也是导致成年人失明的主要原因之一[1]。目前,糖尿病视网膜病变的发病机制尚不明确,研究认为,持续的高血糖造成的人视网膜微血管内皮细胞(human retinal microvascular endothelial cells,HRMECs)损伤是其发生发展的关键,因此,抑制高糖引起的HRMECs损伤对于糖尿病视网膜病变的治疗尤为重要[2]。荞麦黄酮是荞麦的主要活性成分,具有降血糖、降脂、抗炎等功效[3]。有报道称,荞麦黄酮可抑制高糖诱导的肾小球系膜细胞炎症因子表达和纤维化,其作用机制与下调细胞中长链非编码RNA(long non-coding RNA,lncRNA)远端缺失同源盒6反义RNA1(distal-less homeobox 6 antisense RNA1,DLX6-AS1)表达有关[4]。然而,荞麦黄酮能否影响HRMECs 损伤还未知。高迁移率族蛋白1(high mobility group box 1,HMGB1)是一种炎症因子,除参与调控炎症反应外,还对细胞凋亡、氧化损伤等具有调控作用[5]。研究显示,HMGB1 在糖尿病大鼠视网膜组织及高糖诱导的HRMECs 中均表达升高,敲减HMGB1 可通过抑制半胱天冬酶-3(caspase-3)活化及促进B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白表达,减少高糖诱导的HRMECs 凋亡[6-7]。本研究建立高糖诱导的HRMECs 损伤模型,旨在观察荞麦黄酮对高糖诱导的HRMECs 损伤的影响及其能否通过调控HMGB1 发挥作用,以期为其用于糖尿病视网膜病变的治疗提供一定实验依据。
1 材料与方法
1.1 材料 HRMECs(上海信裕生物科技有限公司,批号:220518);DMEM 培养液、膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒、细胞计数试剂盒-8(cell counting kit-8,CCK-8)试剂盒(北京索莱宝,批号:2022061211、2022270509、2022051627、2022041408);聚合酶链式反应(polymerase chain reaction,PCR)实验试剂盒、胎牛血清(浙江天杭,批号:220425、220503);蛋白质印迹实验所需抗体(中国Abcam 公司,批号:20220408);引物序列、HMGB1过表达载体(pcDNA-HMGB1)和空载体(pcDNA)(上海生工,批号:20220517、20220515、20220426);LipofectamineTM2000试剂盒(美国Invitrogen公司,批号:2022051611);丙二醛(malondialdehyde,MDA)、乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6 和IL-10 试剂盒(南京建成,批 号:220415、220520、220504、220328、220501、220408)。
1.2 方法
1.2.1 制备荞麦黄酮 参照文献[3]方法制备荞麦黄酮:将购买并经鉴定的荞麦花叶进行干燥,以1∶7(质量∶体积)添加50%乙醇,60 ℃回流2 h,提取3 次,合并滤液。将滤液用AB-8 打孔吸附树脂分离,用水洗柱子,用50%乙醇解吸被吸附的提取物即为荞麦黄酮。
1.2.2 细胞培养和转染 复苏HRMECs,用完全培养液(含10 %胎牛血清的DMEM 培养液)置于CO2培养箱中培养。于6 孔板中接种2.5 ml HRMECs(5.0×104个/ml),培养24 h 后,利用LipofectamineTM2000 试剂盒分别转染pcDNA、pcDNA-HMGB1,转染时间为12 h,将转染后的细胞用于后续实验。
1.2.3 CCK-8 检测细胞增殖活性 ①于96 孔板中接种0.2 ml HRMECs(5.0×104个/ml),培养4 h 后,分别用含0、0.125、0.25、0.5、1、1.25、1.5、1.75、2 mg/ml 荞麦黄酮的培养液培养24 h。②于96 孔板中接种0.2 ml HRMECs(5.0×104个/ml),培养4 h后,分为正常对照(NC)组、HG 组、HG+低荞麦黄酮组、HG+中荞麦黄酮组和HG+高荞麦黄酮组,NC 组细胞用常规培养液培养24 h,HG 组细胞用含30 mmol/L 葡萄糖的培养液培养24 h[7],HG+低荞麦黄酮组、HG+中荞麦黄酮组和HG+高荞麦黄酮组细胞分别用0.5、1.0、2.0 mg/ml 荞麦黄酮和30 mmol/L葡萄糖的培养液共同培养24 h[4]。③于96孔板中接种0.2 ml 转染pcDNA、pcDNA-HMGB1 的HRMECs(5.0×104个/ml),均按照HG+高荞麦黄酮组进行处理,并分别记为HG+荞麦黄酮+pcDNA 组和HG+荞麦黄酮+pcDNA-HMGB1 组。各组细胞培养结束后,向每孔中加10 µl CCK-8,孵育细胞2 h,置于酶标仪卡槽中,设置波长450 nm,检测各孔光密度(OD)值。细胞抑制率(%)=(1-OD实验组/OD对照组)×100%。
1.2.4 流式细胞术检测细胞凋亡 于6 孔板中接种2.5 ml HRMECs 或转染pcDNA、pcDNA-HMGB1的HRMECs,培养4 h 后,按照上述1.2.3 中②和③分别分组培养。各组细胞培养结束后,PBS 清洗细胞。加500 µl结合缓冲液重悬细胞,加10 µl Annexin V-FITC,避光孵育15 min,再加5 µl PI,避光孵育5 min后,利用流式细胞仪检测各组细胞凋亡。
1.2.5 比色法检测MDA、LDH 和SOD 细胞接种和培养同1.2.4。各组细胞培养结束后,将细胞用PBS 清洗后,加裂解液裂解,3 500 r/min 离心10 min后,取上清液,分别利用MDA、SOD 试剂盒检测上清液中MDA含量、SOD 活性。将各组细胞培养上清液3 500 r/min离心10 min,取上清液,利用LDH 试剂盒检测LDH漏出量。
1.2.6 ELISA 检测TNF-α、IL-6和IL-10 细胞接种和培养同1.2.4。各组细胞培养结束后,收集细胞培养上清液,3 500 r/min 离心10 min。取上清液,分别采用TNF-α、IL-6 和IL-10 ELISA 试剂盒检测其水平。
1.2.7 蛋白质印迹法检测蛋白表达 细胞接种和培养同1.2.4。各组细胞培养结束后,将细胞用PBS清洗。用RIPA 试剂获取细胞中总蛋白,BCA 试剂盒检测蛋白浓度。用SDS-PAGE 实验分离总蛋白,并转至PVDF膜,用5%脱脂奶粉封闭2 h。于4 ℃冰箱中分别用B 淋巴细胞瘤-2 相关蛋白(Bcl-2-associated X protein,Bax)(1∶500)、Bcl-2(1∶500)、HMGB1(1∶1 000)和内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(1∶1 000)一抗孵育过夜,洗膜后,再用山羊抗兔二抗(1∶2 000)于37 ℃孵育1 h。加显影液显影,曝光拍照,Image J软件分析Bax、Bcl-2 和HMGB1 相 对GAPDH 的 表达量。
1.2.8 RT-PCR 检测HMGB1 mRNA 表达 细胞接种和培养同1.2.4。各组细胞培养结束后,采用RNA 提取试剂盒提取各组细胞中总RNA,逆转录为cDNA 后,进行扩增。引物序列:HMGB1正向5´-TGCAGATGACAAGCAGCCTT-3´,反 向5´-GCTGCATCAGGCTTTCCTTT-3´;GAPDH 正 向5´-GGAGCGAGATCCCTCCAAAAT-3´,反 向5´-GGCTGTTGTCATACTTCTCATGG-3´。2-ΔΔCt法计 算HMGB1 mRNA 相对GAPDH的表达量。
1.3 统计学分析 采用SPSS22.0软件进行统计分析。各检测指标均符合正态分布,以xˉ±s 表示。两组间比较采用独立样本t检验;多组间比较先用单因素方差进行分析,使用LSD-t检验进行组间两两比较。以P<0.05表示差异有统计学意义。
2 结果
2.1 荞麦黄酮对HRMECs活性的影响 与0 mg/ml荞麦黄酮组比较,不同剂量(0.125、0.25、0.5、1、1.25、1.5、1.75、2 mg/ml)荞麦黄酮组HRMECs 抑制率无显著变化,说明此剂量范围内的荞麦黄酮对HRMECs活性无显著影响。见图1。

图1 荞麦黄酮对HRMECs抑制率的影响Fig.1 Effect of buckwheat flavone on inhibition rate of HRMECs
2.2 荞麦黄酮对高糖诱导的HRMECs 凋亡的影响 与NG 组比较,HG 组HRMECs 抑制率、凋亡率、细胞中Bax 蛋白表达升高(P<0.05),Bcl-2 蛋白表达降低(P<0.05)。与HG 组比较,HG+低荞麦黄酮组、HG+中荞麦黄酮组和HG+高荞麦黄酮组HRMECs抑制率、凋亡率、细胞中Bax 蛋白表达降低(P<0.05),Bcl-2 蛋白表达升高(P<0.05),且HG+低荞麦黄酮组、HG+中荞麦黄酮组和HG+高荞麦黄酮组各检测指标比较差异均有统计学意义(P<0.05)。见图2、表1。
表1 荞麦黄酮对HRMECs凋亡的影响(,n=3)Tab.1 Effects of buckwheat flavone on HRMECs apoptosis(,n=3)
Note:Compared with NG group,1)P<0.05;compared with HG group,2)P<0.05;compared with HG+low buckwheat flavone group,3)P<0.05;compared with HG+middle buckwheat flavone group,4)P<0.05.

图2 荞麦黄酮对HG 诱导的HRMECs 凋亡及Bax、Bcl-2蛋白表达的影响Fig.2 Effects of buckwheat flavone on HG-induced HRMECs apoptosis and expressions of Bax and Bcl-2 protein
2.3 荞麦黄酮对高糖诱导的HRMECs 氧化应激的影响 与NG 组比较,HG 组HRMECs 中MDA 含量、LDH 漏出量升高(P<0.05),SOD 活性降低(P<0.05)。与HG 组比较,HG+低荞麦黄酮组、HG+中荞麦黄酮组和HG+高荞麦黄酮组HRMECs 中MDA含量、LDH 漏出量降低(P<0.05),SOD活性升高(P<0.05),且HG+低荞麦黄酮组、HG+中荞麦黄酮组和HG+高荞麦黄酮组各检测指标比较差异均有统计学意义(P<0.05)。见表2。
表2 荞麦黄酮对高糖诱导的HRMECs 氧化应激的影响(,n=3)Tab.2 Effects of buckwheat flavone on high glucose-induced oxidative stress of HRMECs(,n=3)
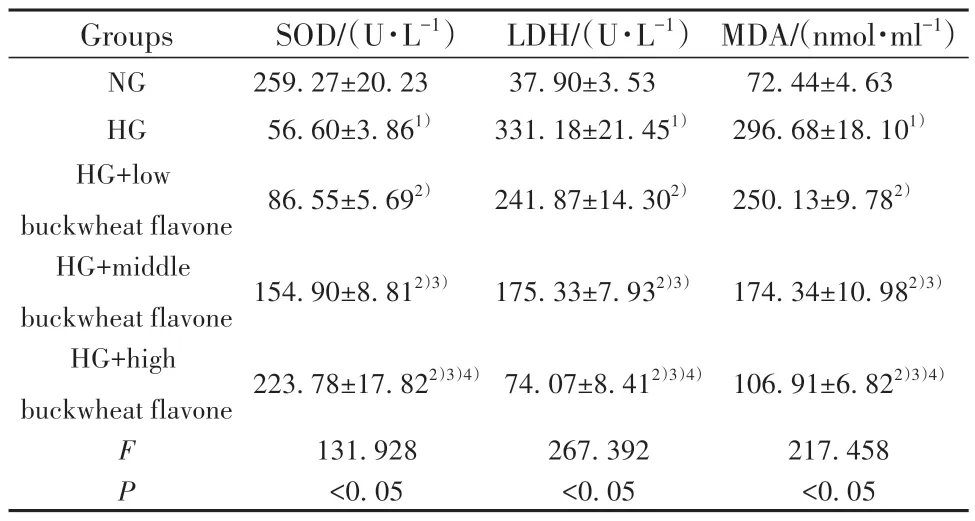
表2 荞麦黄酮对高糖诱导的HRMECs 氧化应激的影响(,n=3)Tab.2 Effects of buckwheat flavone on high glucose-induced oxidative stress of HRMECs(,n=3)
Note:Compared with NG group,1)P<0.05;compared with HG group,2)P<0.05;compared with HG+low buckwheat flavone group,3)P<0.05;compared with HG+middle buckwheat flavone group,4)P<0.05.
2.4 荞麦黄酮对高糖诱导的HRMECs 炎症因子表达的影响 与NG 组比较,HG 组IL-6 和TNF-α 水平升高(P<0.05),IL-10水平降低(P<0.05)。与HG 组比较,HG+低荞麦黄酮组、HG+中荞麦黄酮组和HG+高荞麦黄酮组IL-6 和TNF-α 水平降低(P<0.05),IL-10 水平升高(P<0.05),且HG+低荞麦黄酮组、HG+中荞麦黄酮组和HG+高荞麦黄酮组各检测指标比较差异均有统计学意义(P<0.05)。见表3。
表3 荞麦黄酮对高糖诱导的HRMECs炎症因子表达的影响(,n=3,pg/ml)Tab.3 Effects of buckwheat flavone on expressions of inflammatory factors in HRMECs induced by high glucose(,n=3,pg/ml)
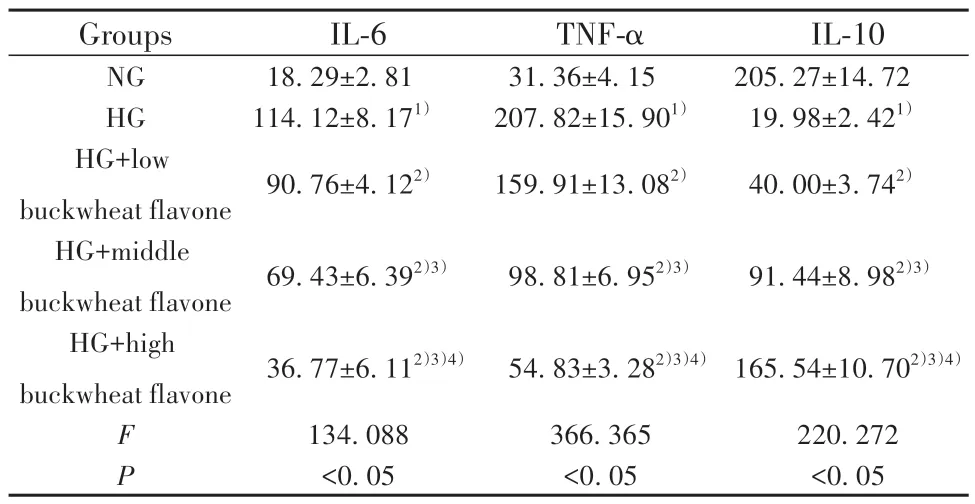
表3 荞麦黄酮对高糖诱导的HRMECs炎症因子表达的影响(,n=3,pg/ml)Tab.3 Effects of buckwheat flavone on expressions of inflammatory factors in HRMECs induced by high glucose(,n=3,pg/ml)
Note:Compared with NG group,1)P<0.05;compared with HG group,2)P<0.05;compared with HG+low buckwheat flavone group,3)P<0.05;compared with HG+middle buckwheat flavone group,4)P<0.05.
2.5 荞麦黄酮对高糖诱导的视网膜微血管内皮HRMECs 细胞中HMGB1 表达的影响 与NG 组比较,HG 组HMGB1 mRNA 和蛋白表达水平升高(P<0.05)。与HG 组比较,HG+低荞麦黄酮组、HG+中荞麦黄酮组和HG+高荞麦黄酮组HMGB1 mRNA 和蛋白表达水平降低(P<0.05),且HG+低荞麦黄酮组、HG+中荞麦黄酮组和HG+高荞麦黄酮组各检测指标比较差异均有统计学意义(P<0.05)。见图3、表4。
表4 荞麦黄酮对HG 诱导的HRMECs 中HMGB1 表达的影响(,n=3)Tab.4 Effects of buckwheat flavone on expression of HMGB1 in HG-induced HRMECs(,n=3)
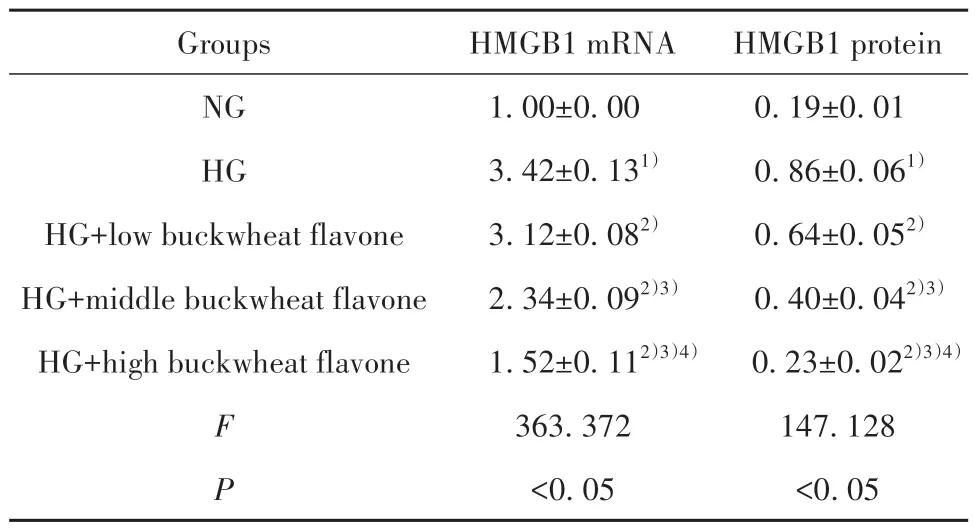
表4 荞麦黄酮对HG 诱导的HRMECs 中HMGB1 表达的影响(,n=3)Tab.4 Effects of buckwheat flavone on expression of HMGB1 in HG-induced HRMECs(,n=3)
Note:Compared with NG group,1)P<0.05;compared with HG group,2)P<0.05;compared with HG+low buckwheat flavone group,3)P<0.05;compared with HG+middle buckwheat flavone group,4)P<0.05.

图3 荞麦黄酮对HG 诱导的HRMECs 中HMGB1 蛋白表达的影响Fig.3 Effects of buckwheat flavone on expression of HMGB1 protein in HG-induced HRMECs
2.6 过表达HMGB1 逆转荞麦黄酮对高糖诱导的HRMECs 凋亡的影响 HG+荞麦黄酮+pcDNAHMGB1组HRMECs中HMGB1 mRNA和蛋白表达量均高于HG+荞麦黄酮+pcDNA组(P<0.05)。与HG+荞麦黄酮+pcDNA 组比较,HG+荞麦黄酮+pcDNAHMGB1 组HRMECs 抑制率、凋亡率、Bax 蛋白表达均升高(P<0.05),Bcl-2 蛋白表达降低(P<0.05)。见图4、表5。
表5 过表达HMGB1逆转荞麦黄酮对HRMECs凋亡的影响(,n=3)Tab.5 Overexpression of HMGB1 reverses effect of buckwheat flavone on HRMECs apoptosis(,n=3)
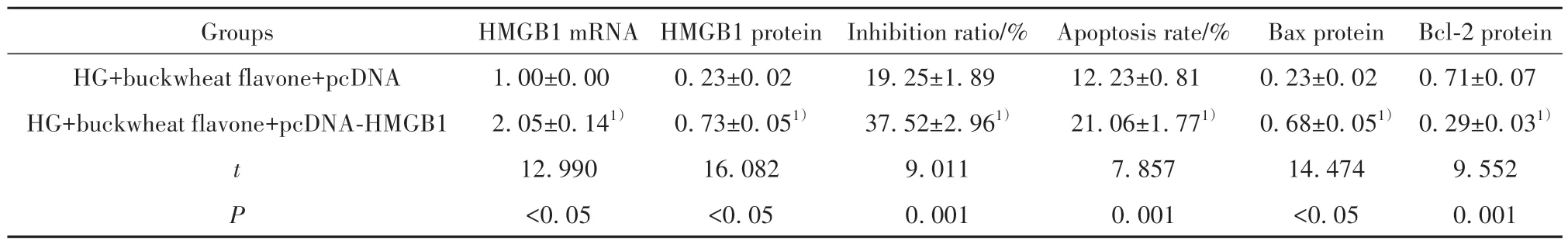
表5 过表达HMGB1逆转荞麦黄酮对HRMECs凋亡的影响(,n=3)Tab.5 Overexpression of HMGB1 reverses effect of buckwheat flavone on HRMECs apoptosis(,n=3)
Note:Compared with HG+buckwheat flavone+pcDNA group,1)P<0.05.
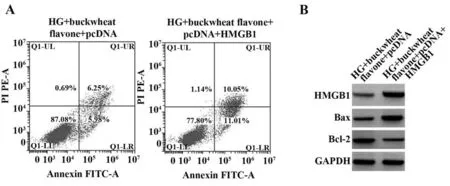
图4 过表达HMGB1 逆转荞麦黄酮对HRMECs 凋亡及HMGB1、Bax、Bcl-2蛋白表达的影响Fig.4 Overexpression of HMGB1 reversed effects of buckwheat flavone on HRMECs apoptosis and protein expressions of HMGB1,Bax,Bcl-2
2.7 过表达HMGB1 逆转荞麦黄酮对高糖诱导的HRMECs 氧化应激和炎症因子表达的影响 与HG+荞麦黄酮+pcDNA 组比较,HG+荞麦黄酮+pc-DNA-HMGB1 组HRMECs 中MDA 含量、LDH 漏出量升高(P<0.05),SOD 活性降低(P<0.05),IL-6 和TNF-α 水平升高(P<0.05),IL-10 水平降低(P<0.05)。见表6。
表6 过表达HMGB1逆转荞麦黄酮对HG诱导的HRMECs氧化应激和炎症因子表达的影响(,n=3)Tab.6 Overexpression of HMGB1 reverses effects of buckwheat flavone on HG-induced oxidative stress and inflammatory factors expressions in HRMECs(,n=3)

表6 过表达HMGB1逆转荞麦黄酮对HG诱导的HRMECs氧化应激和炎症因子表达的影响(,n=3)Tab.6 Overexpression of HMGB1 reverses effects of buckwheat flavone on HG-induced oxidative stress and inflammatory factors expressions in HRMECs(,n=3)
Note:Compared with HG+buckwheat flavone+pcDNA group,1)P<0.05.
3 讨论
近年来,由于居民饮食结构的改变,糖尿病发病率呈增长趋势[8]。作为糖尿病的并发症之一,糖尿病视网膜病变的发病率也随之升高[9]。糖尿病患者长期处于高血糖状态,高血糖可诱发HRMECs 产生过度的氧化应激、炎症反应甚至凋亡,这也是糖尿病视网膜病变发生发展的重要原因。因此,抑制高糖诱导的HRMECs 损伤对糖尿病视网膜病变的治疗尤为重要。本研究发现,不同浓度的荞麦黄酮对HRMECs 活性无显著影响,将适量浓度的荞麦黄酮作用于高糖诱导的HRMECs,结果显示,荞麦黄酮能够呈剂量依赖性地增强高糖诱导的HRMECs 活性,并减少细胞凋亡,提示其对HRMECs 发挥保护作用。Bax 是一种促凋亡分子,其表达增加时促进细胞凋亡;Bcl-2 则发挥抗凋亡作用,其表达增加对细胞凋亡起抑制作用[10]。本实验数据显示,荞麦黄酮抑制了高糖诱导的HRMECs 中Bax 蛋白表达,促进了Bcl-2蛋白表达,说明其发挥抗高糖诱导的HRMECs凋亡与调控Bax/Bcl-2有关。
持续的高血糖可诱导HRMECs 氧自由基生成增加,自由基进一步与细胞膜脂质、细胞内蛋白质及核酸发生一系列氧化反应,造成细胞氧化损伤[11]。MDA 是脂质过氧化产物,其水平高低可间接反映细胞氧化应激水平[12]。SOD 是机体内重要的抗氧化酶,可清除自由基,减轻自由基对机体组织的氧化损伤[13]。在细胞受损时,细胞膜通透性发生改变,LDH 被释放。因此,细胞培养上清液中LDH漏出量越高,说明细胞受损越严重[14]。本实验数据显示,荞麦黄酮降低了高糖诱导的HRMECs 中MDA含量和LDH 漏出量,提高了细胞中SOD 活性,且呈剂量依赖性,提示荞麦黄酮能够减轻高糖诱导的HRMECs 氧化损伤。此外,持续的高血糖还可诱导HRMECs 发生炎症反应,分泌过量炎症因子促进糖尿病视网膜病变的发展。研究显示,糖尿病视网膜病变患者视网膜组织中IL-6 和TNF-α 呈高表达,促进该疾病的发展[15]。IL-10属于抗炎因子,对IL-6和TNF-α 等促炎因子具有抵抗作用,可缓解糖尿病视网膜病变患者炎症状态[16]。本实验数据显示,荞麦黄酮抑制了高糖诱导的HRMECs分泌IL-6和TNF-α,而促进其分泌IL-10,且呈剂量依赖性,这说明荞麦黄酮可减轻高糖诱导的HRMECs炎症损伤。
HMGB1是一种炎症因子,其参与调控细胞炎症反应、氧化应激及细胞凋亡等生理或病理过程。研究显示,miR-205-5p 可通过靶向下调HMGB1 减轻缺氧复氧诱导的海马神经元炎症反应和氧化应激,减轻脑缺血再灌注损伤[17]。既往研究显示,HMGB1也参与糖尿病视网膜病变的发生发展,抑制HMGB1基因表达能够改善糖尿病视网膜病变大鼠视网膜中央动脉的血流,并抑制炎症反应及细胞凋亡[18]。本研究结果显示,荞麦黄酮呈剂量依赖性抑制高糖诱导的HRMECs 中HMGB1 mRNA 和蛋白表达,而过表达HMGB1 则逆转了荞麦黄酮对高糖诱导的HRMECs增殖活性、凋亡、氧化应激及炎症反应的影响,进一步提示荞麦黄酮可能通过下调HMGB1 抑制高糖诱导的HRMECs 凋亡、氧化应激及炎症反应。
综上,一定剂量的荞麦黄酮对高糖诱导的HRMECs 凋亡、氧化应激及炎症反应具有显著抑制作用,其作用机制可能与下调细胞中HMGB1 表达有关。HMGB1 受上游miRNA 调控,而miRNA 又受环状RNA 和lncRNA 调控,因此,荞麦黄酮可能通过作用于环状RNA 或lncRNA 进而靶向miRNA 来调控HMGB1 表达,从而减轻高糖诱导的HRMECs 损伤,其具体作用的环状RNA 或lncRNA 及miRNA 有待进一步探究。

