BMP9调控Notch、TLR4信号通路诱导主动脉瓣间质细胞成骨样分化
钱 磊 季爱华 张文剑(潍坊市益都中心医院心脏大血管外科,潍坊 262500)
钙化性主动脉瓣疾病(calcified aortic valve disease,CAVD)的主要特点为主动脉瓣纤维增厚和钙化,能够引起主动脉瓣狭窄,最终导致慢性心力衰竭[1]。随着人口的老龄化,CAVD 的发生率逐年升高,并成为常见的心脏瓣膜病[2]。CAVD 病理过程复杂,包括内皮功能障碍、脂质沉积、慢性炎症、细胞成骨分化等,最终导致瓣膜钙化。其中炎症细胞浸润十分关键[3]。目前临床治疗CAVD 只能通过主动脉瓣膜置换术,而缺乏有效药物。因此在CAVD的致病机制上寻找治疗靶点十分重要。骨形态发生蛋白(bone morphogenetic protein,BMP)是转化生长因子超家族成员,不但可以诱导骨、软骨,以及皮下、肌肉的异位骨形成,还能调节细胞的增殖、分化和器官形成[4]。在CAVD 的进展中,主动脉瓣膜间质细胞(aortic valve interstitial cells,AVICs)会呈成骨样分化,在分化过程中,碱性磷酸酶(alkaline phosphatase,ALP)、骨桥蛋白(osteopontin,OPN)、骨钙蛋白(osteocalcin,OCN)表达升高[5]。BMP2、BMP4在钙化瓣膜组织中表达升高[6]。而BMP9 与BMP2、BMP4 功能类似,促成骨能力很强[7]。在脂多糖(lipopolysaccharide,LPS)诱导的炎症环境中,BMP9促进人牙周膜干细胞的成骨分化,上调炎症标志物表达[8]。在动脉粥样硬化中,BMP9可驱动血管平滑肌细胞的增殖和迁移,造成局部动脉粥样硬化[9]。但BMP9在CAVD中的作用研究鲜有报道。
本研究的实验前期发现BMP9 在CAVD 患者组织中表达升高,推测BMP9 可能促进瓣膜钙化。由于心脏瓣膜钙化的关键环节是AVICs 的成骨分化,因此本研究以猪AVICs 为研究对象,探讨BMP9 对AVICs 成骨分化的影响,为CAVD 的治疗提供理论和实验依据。
1 材料与方法
1.1 材料
1.1.1 人瓣膜组织和猪AVICs 来源 选择潍坊市益都中心医院的主动脉夹层患者为non-CAVD 组,主动脉钙化患者为CAVD组。取患者主动脉瓣膜组织,一部分于4%多聚甲醛固定,另一部分于液氮保存。所有患者及家属均签署知情同意书。
于潍坊市青州市动物检疫定点屠宰场收集家猪(8~10 月龄,体质量120~150 kg)主动脉瓣膜组织,体外分离培养原代AVICs。本研究通过潍坊市益都中心医院伦理委员会批准(20200512)。
1.1.2 主要试剂及仪器 BMP9 干扰RNA(si-BMP9)、阴性对照干扰RNA(si-RNA)购自广州锐博公司;重组腺病毒BMP7(recombinant adenovirus BMP7,Ad-BMP7)和携带绿色荧光蛋白基因的重组腺病毒(recombinant adenovirus carrying green fluorescent protein gene,Ad-GFP)购自上海汉恒公司;胎牛血清、胰蛋白酶、雄激素受体(androgen receptor,AR)染色试剂盒、ALP 染色试剂盒购自上海碧云天公司;M199培养基购自美国Hyclone公司;α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、Vimentin、血小板内皮细胞黏附分子-1(platelet endothelial cell adhesion molecule-1,PECAM-1,CD31)抗体购自万类公司;BMP9、Runx2、OCN、OPN 抗体购自美国CST 公司;Notch2、发状分裂相关增强子1(hairy and enhancer of split 1,Hes1)、Notch 胞内域(Notch intracellular domain,NICD)、Toll 样受体-4(Toll-like receptor-4,TLR4)、核因子κB p65(nuclear factor κB p65,NF-κB p65)抗体购自深圳市豪地华拓公司;二喹啉甲酸(Bicinchoninic acid,BCA)蛋白浓度测定试剂盒购自北京中杉金桥公司;冷冻离心机购自美国Beckman 公司;组织包埋机购自德国Leica 公司;蛋白电泳仪、转膜仪购自美国伯乐公司;电子显微镜购自日本Olympus公司。
1.2 方法
1.2.1 免疫组织化学染色 取出4%多聚甲醛固定的主动脉瓣膜组织并制成石蜡切片,经烘片、二甲苯脱蜡、梯度乙醇脱洗、枸橼酸钠缓冲液抗原修复、3%H2O2封闭、血清室温封闭、一抗4 ℃孵育过夜、二抗室温30 min,3,3´-二氨基联苯胺(3,3´-Diaminobenzidine,DAB)显色、苏木素复染,后经梯度乙醇脱水、透明、封片、显微镜(×200)下观察。
1.2.2 猪AVICs 的分离、培养与鉴定 AVICs 的分离、培养:离体主动脉瓣膜用含双抗的PBS漂洗后保存于新鲜M199培养基中,PBS漂洗后用Ⅰ型胶原酶消化组织,将瓣膜剪成小块,于胶原酶中消化过夜。次日离心收集细胞,加入含10%胎牛血清的M199培养基于37 ℃、5%CO2条件中培养,每3 d换液1次。待细胞密度达到80%时消化传代。
免疫荧光鉴定细胞表型:猪AVICs 接种于24 孔板的爬片,待细胞密度达到50%时用4%多聚甲醛固定,0.5% Triton-X100 破膜,3%H2O2封闭,血清室温封闭,加入α-SMA、Vimentin 和CD31 一抗(1∶50)4 ℃孵育过夜,加入荧光染料标记的二抗(1∶200)室温避光孵育2 h,DAPI 复染细胞核,于荧光显微镜(×200)下观察α-SMA、Vimentin和CD31表达。
1.2.3 猪AVICs 的成骨分化诱导 取对数生长期的AVICs于M199培养基中培养,待细胞密度约50%时向培养基中加入10 mmol/L β-甘油磷酸钠、50 µg/ml维生素C、100 nmol/L 地塞米松诱导AVICs细胞成骨分化。
1.2.4 BMP9 处理及实验分组 取对数生长期的AVICs,以2×105个/孔密度铺于6 孔板中,待细胞密度达到约70%时,构建BMP9 基因沉默及过表达体系。转入siRNA,分为control 组(未转染siRNA 的AVICs 细胞)、si-control 组(转染阴性对照siRNA 的AVICs细胞)、si-BMP9组(转染BMP9-siRNA的AVICs细胞)。转染重组腺病毒,分为Ad-GFP组(转染GFP腺病毒的AVICs 细胞)、Ad-BMP9 组(转染BMP9 腺病毒的AVICs细胞)。转染48 h后,提取细胞总RNA用于qPCR 检测;提取细胞总蛋白质用于Western blot检测。
1.2.5 ALP 染色 将转染后的AVICs 细胞接种于24 孔板,各组细胞加入钙盐培养基培养7 d,然后用PBS 洗涤3 次,4%多聚甲醛室温固定后,加入NBT/BCIP 溶液行ALP 染色,避光30 min 后观察染色结果。ALP 染色如细胞质中出现蓝色轮廓,提示细胞内ALP与染料结合。
1.2.6 AR 染色 将转染后的AVICs 细胞接种于24孔板,各组细胞加入钙盐培养基培养14 d,PBS洗涤3 次,4%多聚甲醛室温固定后,加入0.4% AR 染液染色,采用去离子水终止反应,显微镜下观察钙盐沉积情况。茜素红染色细胞外出现深红色钙化结节,提示产生钙质。
1.2.7 qRT-PCR 检测AVICs 中BMP9 及相关成骨指标的mRNA 表达 采用Trizol 法提取AVICs 细胞总RNA。将RNA 反转录为cDNA,并使用SYBR Green 进行扩增,GAPDH 用作内参。反应条件:95 ℃ 5 min,95 ℃ 10 s,62 ℃ 30 s,共40 个循环。使用2-ΔΔCt公式计算BMP9、Runx2、OPN、OCN mRNA 的相对表达水平。BMP9-F:5´-ACGATCTGTTTCCCCTCATCT-3´,BMP9-R:5´-ATGCAGGGATGATGTTCTG-3´。Runx2-F:5´-GCACTACCCAGCCACCTTTA-3´,Runx2-R:5´-TATGGAGTGCTGCTGGTCTG-3´。OPN-F:5´-GAGCAAACAGACGATGTGGA-3´,OPN-R:5´-GACCAGCTCATCGGATTCAT-3´。OCN-F:5´-TCACACTGCTTGCCCTACTG-3´,OCN-R:5´-TGCCATAGAAGCGCCGATAG-3´。GAPDH-F:5´-GGTGAAGGTCGGAGTGAACG-3´,GAPDH-R:5´-CGTGGGTGGAATCATACTGGA-3´。
1.2.8 Wertern blot 检 测CAVD 组织和AVICs 中BMP9、相关成骨指标及Notch、TLR4 信号通路蛋白表达 取部分CAVD 组织和AVICs,加入适量RIPA组织裂解液进行总蛋白提取,并测定各组蛋白浓度,缓冲液稀释后进行SDS-PAGE 分离蛋白,电泳完毕后迅速转至PVDF 膜,于TBST 中室温封闭2 h,分别加入BMP9、Runx2、OPN、OCN、Notch2、NICD、Hes1、TLR4、NF-κB p65 一抗(1∶2 000)4 ℃孵育过夜。TBST 洗涤3 次后,加入二抗(1∶10 000)室温孵育2 h,最后避光加入ECL显色剂显色,Bio-Rad凝胶成像仪记录蛋白灰度并拍照,以GAPDH 作为对照,对各组蛋白表达进行相对定量分析。
1.3 统计学处理 采用SPSS16.0软件进行统计分析。计量资料用表示。两组间比较采用t检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 Runx2、BMP9 在CAVD 组织中的表达 免疫组化结果(图1A)及Western blot(图1B)结果显示,与non-CAVD 组相比,CAVD 组中Runx2、BMP9 蛋白表达水平显著升高(P<0.05)。说明BMP9能够促进瓣膜钙化,且在CAVD的进展中起重要作用。
2.2 猪AVICs 的形态及表型鉴定 接种24 h 后,AVICs 细胞呈长梭形,形态趋于一致,呈放射状(图2A);免疫荧光染色结果显示,α-SMA(图2B)、Vimentin(图2C)阳性表达;而CD31阴性表达(图2D)。说明原代猪AVICs分离成功。

图2 猪AVICs的形态及表型鉴定(×200)Fig.2 Morphology and phenotype identification of pig AVICs(×200)
2.3 BMP9促进猪AVICs的成骨分化 ALP染色结果(图3A)显示,与si-control组相比,si-BMP9组蓝紫色染色结节明显减少,ALP 活性降低(P<0.05);与Ad-GFP 组相比,Ad-BMP9 组蓝紫色染色结节明显增多,ALP 活性升高(P<0.05)。茜素红染色结果(图3B)显示,与si-control组相比,si-BMP9组红色钙化结节明显减少,茜素红浓度降低(P<0.05);与Ad-GFP 组相比,Ad-BMP9 组深红色钙化结节明显增多,茜素红浓度升高(P<0.05)。qRT-PCR(图3C)和Western blot(图3D)结果显示,与si-control 组相比,si-BMP9组BMP9、Runx2、OPN和OCN mRNA和蛋白表达水平明显降低(P<0.05);与Ad-GFP 组相比,Ad-BMP9 组BMP9、Runx2、OPN 和OCN mRNA 和蛋白表达水平明显升高(P<0.05)。提示BMP9能够促进AVICs成骨分化,并提高成骨指标表达。
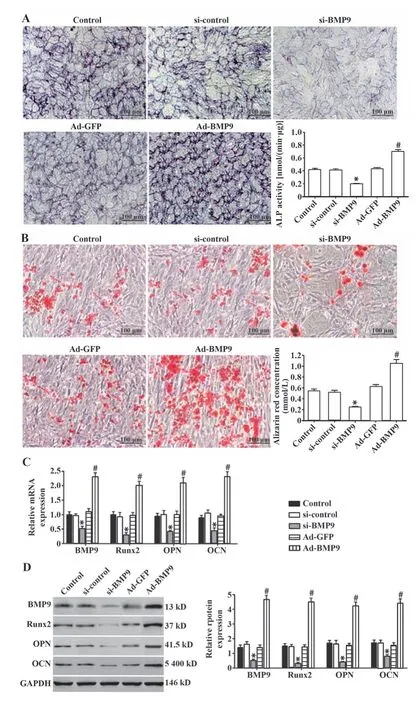
图3 BMP9促进猪AVICs的成骨分化Fig.3 BMP9 promotes osteogenic differentiation of pig AVICs
2.4 BMP9对Notch、TLR4信号通路的影响 Western blot结果(图4)显示,与si-control组相比,si-BMP9组Notch2、NICD、Hes1、TLR4、NF-κB p65 蛋白表达水平明显降低(P<0.05);与Ad-GFP 组相比,Ad-BMP9组Notch2、NICD、Hes1、TLR4、NF-κB p65 蛋白表达水平明显升高(P<0.05)。说明BMP9 可能通过Notch 和TLR4 信号通路调节AVICs 细胞的成骨样分化。

图4 BMP9对Notch、TLR4信号通路的影响Fig.4 Influence of BMP9 on Notch and TLR4 signaling pathway
3 讨论
CAVD 是一种活跃的、细胞驱动的退行性疾病。健康瓣膜中AVICs 保持静止,维持成纤维细胞样特征,但在CAVD 中AVICs 会呈成骨样分化,并伴有Runx2、OPN、OCN 和ALP 表达升高[10-11]。在骨形成及心脏瓣膜发育中,BMPs 起重要作用。研究发现BMP2、BMP4、BMP7 在CAVD 中表 达升 高,表明BMPs 家族与CAVD 相关[12-14]。BMP2 的主要作用为直接诱导钙化,而BMP9 主要参与内皮病变。瓣膜钙化过程中,最初表现为内皮细胞损伤和上皮-间质转化,但最终将转化为AVICs 表型[15]。研究发现,BMP9 可诱导VCAM-1 和ICAM-1 表达,引起血管炎症,进而诱导局部的动脉粥样硬化,且BMP9 也能使血管平滑肌细胞发生钙化,表明BMP9 在钙化过程中发挥关键作用[16-17]。本研究证实,在CAVD 组织中BMP9 表达升高,推测BMP9可能在CAVD 中起重要作用。通过构建低表达和过表达BMP9 的AVICs发现敲减BMP9后,Runx2、OPN、OCN 等成骨指标表达降低,同时ALP 染色变浅,钙盐沉积减少;BMP9过表达后,Runx2、OPN、OCN 表达增加,ALP 染色变深,钙盐沉积增加,说明BMP9 能够促进AVICs 成骨分化。
Notch 信号通路能够调控细胞的增殖、分化及凋亡等生理过程,同时Notch 信号通路在诱导成骨细胞分化及内皮细胞钙化中起重要作用。如谢正松等[18]发现过表达BMP4通过激活Notch 信号通路,促进骨髓基质细胞成骨分化。MAJUMDAR 等[19]发现Notch 信号通路可促进血管平滑肌细胞钙化。ZENG 等[20]研究表明Notch 信号通路在人心脏瓣膜间质细胞钙化过程中发挥重要的促进作用。许多研究表明慢性炎症反应参与退行性瓣膜钙化。TLR4是一种模式识别受体,可表达于主动瓣膜间质细胞,能够诱导膜间质细胞的成骨分化和造成炎症反应。如ZHENG 等[21]发现主动瓣膜间质细胞中TLR4、NF-κB 水平上调,miR-214 通过激活TLR4 通路促进钙化。SHEN 等[22]发现小鼠主动瓣膜间质细胞钙化区中TLR4表达水平增加,TLR4基因敲除后,主动脉瓣间质细胞钙化程度明显减弱。本研究中敲减BMP9 后,Notch2、NICD、Hes1、TLR4、NF-κB p65 蛋白表达水平降低;过表达BMP9 后,Notch2、NICD、Hes1、TLR4、NF-κB p65 蛋白表达水平升高,说明BMP9可能通过激活Notch 和TLR4信号通路发挥促钙化作用,见图5。
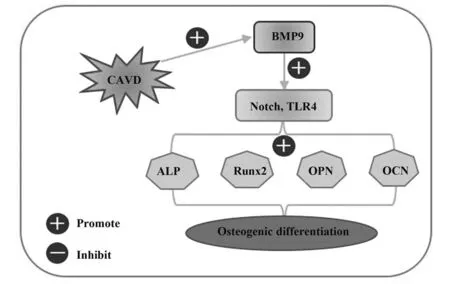
图5 BMP9诱导猪AVICs成骨分化的作用机制Fig.5 Mechanism of BMP9 inducing osteogenic differentiation of pig AVICs
综上所述,BMP9 能够促进AVICs 的成骨样分化,这一作用机制可能与Notch 和TLR4 信号通路的激活有关。为CAVD 的治疗提供了理论和实验依据。抑制AVICs BMP9 表达或阻断Notch 和TLR4 信号通路,可能会延缓瓣膜钙化进程。

