白消安处理对红鳍东方鲀性腺的影响❋
陈志伟, 孙慧邦, 金超凡, 赵 瑄, 刘金相,2,3, 张全启,2,3❋❋
(1. 中国海洋大学海洋生物遗传学与育种教育部重点实验室, 山东 青岛 266003;2. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266237;3. 中国海洋大学三亚海洋研究院, 海南省热带水产种质重点实验室, 海南 三亚 572000)
红鳍东方鲀(Takifugurubripes)隶属于硬骨鱼纲(Osteichthyes)鲀形目(Tetraodontiformes)鲀科(Tetraodontidae)东方鲀属(Takifugu)[1],其肉质鲜美、营养丰富,是中国、韩国和日本等地最重要的鲀科经济物种[2]。近年来,受船舶航行、海洋污染因素的影响,红鳍东方鲀的野生种群数量缩减,捕获量逐年减少[3]。与之相反,20世纪90年代以来,红鳍东方鲀的人工养殖产量持续增长,有报道显示其人工养殖产量在日本的已达到4 179 t,是野生捕获量的17倍[3];在中国达到了14 000 t[4]。红鳍东方鲀养殖规模的快速扩大主要归因于建立了成熟的亲鱼养殖管理、人工诱导排卵授精和良种选育体系[3],但亲鱼养殖管理仍需进一步优化。首先,红鳍东方鲀的生殖周期较长,雌鱼的最小成熟年龄为3龄,雄鱼为2龄,3~4龄为优势年龄组;其次,红鳍东方鲀的亲本大小为2~5 kg,是其销售个体体质量的(0.6~1 kg)的2~8倍。因此,亲鱼的养殖和管理需要大量的时间和空间[5],亟需新技术减少亲鱼的生长、生产时间,以加速红鳍东方鲀的良种选育进程,降低亲鱼的养殖管理成本[6]。
生殖细胞移植技术可以加速良种选育进程。该技术首先在鸟类中建立,Wentworth等将显性遗传普通鹌鹑(Coturnixcoturnix)的原始生殖细胞移植到隐性的白羽鹌鹑胚胎内,从而获得了嵌合体[7]。之后,Brinster等在小鼠(Musmusculus)中建立了生殖细胞移植体系[8]。鱼类生殖细胞移植技术首先在斑马鱼(Daniorerio)中建立[9],之后在其他鱼类中得到进一步应用。在尼罗河罗非鱼(Oreochromisniloticus)中,Lacerda等将分离到的精原细胞通过泄殖孔注射到已去除内源生殖细胞的成鱼精巢中,待其成熟后获得了供体精子,从而建立了成鱼生殖细胞移植体系[10]。在哈奇氏牙汉鱼(Odontestheshatcheri)中还实施了雌性成鱼生殖细胞移植,且成功地得到了供体卵子[11]。在鲆鲽类鱼中,Li等成功进行了生殖细胞的异种移植[12];任玉芹等在确保移植成鱼受体具有较高成活率的前提下,使用白消安实现了内源性生殖细胞较彻底的凋亡效果,同时将卵原细胞移植到雄鱼体内,成功获得了精子及供体后代[13]。成体细胞移植技术以成鱼作为受体,在较短的时间即可获得供体配子,可大幅度减少亲鱼养殖时间[14]。
生殖细胞移植的理想对象是不育受体,如果受体可育,就会影响移植效果。首先,可育受体会产生自身配子,这对供体后代的检测会产生干扰;其次,可育受体中大量的内源生殖细胞会与供体生殖细胞竞争发育所需的生态位和微环境,且通常因内源生殖细胞处于绝对优势使供体细胞缺乏生态位而定植困难,最终被受体免疫系统清除。目前,获得不育个体的手段主要包括高温-化学药物处理组合、三倍体诱导和生殖基因敲降或敲除等方法[10,15-16]。成鱼中应用最多的方法是使用化学药物(白消安)和高温混合作用来清除受体内源性生殖细胞,研究表明,该方法可以使亚成鱼或成鱼性腺退化,实现内源性生殖细胞的清除[15]。
白消安(1,4-丁二醇二甲磺酸酯)是一种双甲基磺酸酯类双功能烷化剂,为细胞周期非特异性药物。白消安不仅可以作为内源细胞的清除剂,还可以作为一种抗白血病的药物,因此对哺乳动物的作用原理和机制都相对清楚。注射白消安会导致表皮功能退化、肺损伤、肝毒性、骨髓造血抑制、晶状体混浊或白内障、病胃肠道疾病移、植物抗宿主等疾病,严重的还会导致死亡[17-20]。白消安能作用于哺乳动物的睾丸和卵巢,特别是睾丸[21]。硬骨鱼和哺乳动物的生殖细胞发育过程存在较大差异,很难预估白消安对硬骨鱼性腺的处理效果,白消安在东方鲀属中仅在星点东方鲀(Takifuguniphobles)中予以运用,并在雌雄个体中都取得了较好的效果[22],而在红鳍东方鲀中未有运用的报告,同时白消安清除鱼类生殖细胞的作用机制仍尚不清楚,未有学者研究。
本研究为获得不育红鳍东方鲀受体,使用白消安对二龄半红鳍东方鲀进行处理,通过组织学观察和转录组分析,对白消安在雌雄鱼性腺中的作用效果和机制进行探究,从分子水平提供白消安诱导性腺退化作用机制的新认知,为促进红鳍东方鲀良种选育提供参考。
1 材料与方法
1.1 实验材料
本研究的实验用鱼购自辽宁省大连市天正实业有限公司大黑石养殖场。选择体表无损伤、体型正常、健康活泼的两龄半红鳍东方鲀(体长为(30.40±1.96) cm;体质量为(1 029.5±106.4) g;,性腺质量为(5.75±2.39) g)作为实验对象。
1.2 实验方法
1.2.1 白消安注射 使用二甲基亚砜(Dimethyl sulfoxide,DMSO)作为溶剂配置30 mg/mL浓度的白消安溶液,放置在冰中备用。实验用鱼随机分为对照组和实验组,每组各30尾。将实验鱼用麻醉剂MS-222(20 mg/L)麻醉2 min后,实验组按照40 mg/kg的剂量进行白消安腹腔注射,对照组注射相同体积的DMSO。注射共进行两次,两次注射间隔两周[10,22]。
1.2.2 性腺组织取样 第二次注射结束两周后,对照组和实验组分别取6尾鱼(雌雄各3尾),使用MS-222对其进行麻醉,然后进行断椎处理,从泄殖孔剖开腹腔,取出其性腺。每个个体取一部分性腺组织,用4%多聚甲醛在室温下固定24 h,用于组织学形态观察,另一部分性腺用剪刀剪成3 mm3大小的组织块放入RNA-wait中,4 ℃过夜后在-80 ℃长期保存,用于RNA提取。
1.2.3 性腺组织切片观察 将保存在4%多聚甲醛中的性腺组织梯度乙醇脱水后,经石蜡包埋制备组织切片,厚度为4~5 μm[23]。经HE染色(Hematoxylin-eosin staining)后,在尼康AZ100荧光显微成像系统下进行组织形态观察与拍照。
1.2.4 性腺组织总RNA提取 按说明书用Trizol(TaKaRa)法提取对照组和处理组性腺组织RNA,使用Bioanalyzer 2100系统对RNA进行RIN值检测,确保RNA无污染、无降解、符合RNA-seq建库标准。
1.2.5 转录组分析
1.2.5.1 转录组测序(RNA-seq) 以通过RIN值检测的RNA为模板,使用Illumina的NEBNext® UltraTM RNA Library Prep Kit建库试剂盒进行文库构建,处理组及对照组的雌雄鱼各设3个平行以满足生物学重复,共建立12个cDNA文库。文库构建完成后,使用Qubit2.0 Fluorometer进行初步定量,使用Bioanalyzer 2100系统进行文库插入片段长度检测;使用qPCR对文库有效浓度进行准确定量。RNA-seq测序由北京诺禾致源公司完成,测序平台为Illumina Novaseq 6000,测序读长为150 bp。
1.2.5.2 转录组数据质控和处理 使用Fastp (https://github. com/OpenGene/fastp. git) 软件对原始数据进行测序质量评估,评估内容主要为Q20、Q30、GC含量和测序重复率等;然后使用Trimmomatic v0.36软件对原始数据进行质控[24],质控内容主要包括去除原始数据中的接头、含N(无法确定碱基信息)的reads和低质量的reads,质控完成后的数据为clean data;再使用Hisat2(v2.1.0)软件构建参考基因组的索引文件用作数据比对模板[25],使用的参考基因组文件和基因注释文件为红鳍东方鲀基因组(NCBI, TakRub1. 2_genomic. gff:GCF_901000725. 2)。将clean reads与索引文件进行比对;比对上的reads用Stringtie软件进行拼接[26],并用FPKM (Fragments Per Kilobase of exon model per Million mapped fragments)值对转录本的表达量进行标准化。
1.2.5.3 差异表达基因分析与功能富集 通过主成分分析(Principal component analysis,PCA)对所有个体表达谱的整体相似性和差异进行可视化。用DEseq2软件进行处理组和对照组之间的差异表达分析[27]。对差异表达基因(Differentially expressed genes,DEGs)进行筛选,标准为p<0.05同时|log2FoldChange|≥1。差异表达分析结果用热图和火山图显示。使用AnnotationHub软件包对白消安处理产生的红鳍东方鲀生殖腺的差异表达基因进行基因名转化[28],然后使用ClusterProfiler软件包进行GO(Gene Ontology)条目和KEGG(Kyoto Encyclopedia of Genes and Genomes)通路的富集分析[29],GO条目的富集标准是富集结果p-adjust和q-value均小于0.4;KEGG通路的富集标准是p-adjust和q-value均小于0.1。结果用柱状图、气泡图显示。使用ClusterProfiler软件包进行基因集富集分析(Gene set enrichment analysis,GSEA)探究KEGG中相关信号通路的调控趋势[29],p值的阈值设定为0.05,结果使用pathview软件包进行可视化[30]。
1.2.6 实时荧光定量PCR 使用All-in-One 5×RT MasterMix(abm),37 ℃ 15 min,60 ℃ 10 min对建库使用的RNA进行反转录。对6个重要的显著差异表达基因进行定量验证,使用dld作为内参基因,用Primer5设计定量PCR引物,引物序列见表1。使用2×SYBR Green PCR Master Mix试剂(TaKaRa)和Lightcycler 480 PCR仪(Roche)进行实时荧光定量PCR(Real-time quantitative PCR,qPCR)扩增。结果采用2-ΔΔCt方法进行分析,显著性使用 SPSS 20 软件进行分析,分析方法为独立样本T检验,当p<0.05时认定为具有显著性差异。

表1 本研究所用引物
2 结果与分析
2.1 白消安处理对性腺组织结构的影响
组织学观察显示,白消安处理对红鳍东方鲀雌雄性腺的影响效果存在显著差异,白消安处理引起的红鳍东方鲀的精巢退化明显,而卵巢退化不明显。在雄鱼中,白消安处理组精巢发生明显退化,曲细精管横截面中的大部分精小囊显示为空洞结构,其中的大部分生殖细胞被清除,空腔周边仅存在少量精原细胞和支持细胞;虽仍有部分精小囊中充满各种分化时期的生殖细胞,但这些不同的生殖细胞均聚集于精小囊中央(见图1A)。与此相比,对照组精巢为正常的Ⅲ期发育状态,精小囊中以初级精母细胞、次级精母细胞为主,精小囊周边含有少量精原细胞,而小囊内侧有少量分化的精细胞,但少有聚集于小囊空腔中央的精子(见图1C)。在雌鱼中,白消安处理组卵巢未出现明显退化,卵巢内充满各期生殖细胞,以卵母细胞和前卵母细胞为主(见图1B),对照组卵巢表现出正常的Ⅱ期发育形态,第Ⅲ时相卵母细胞占大部分,且含有少量的第Ⅱ时相卵母细胞,大部分卵母细胞呈圆形或不规则多边形,细胞大小不一,具有皮质液泡和卵黄颗粒(见图1D)。实验组和对照组的卵巢在组织形态上无显著差异,但对照组卵母细胞的染色为嗜碱性的蓝色,而白消安处理组则为嗜酸性的粉红色。
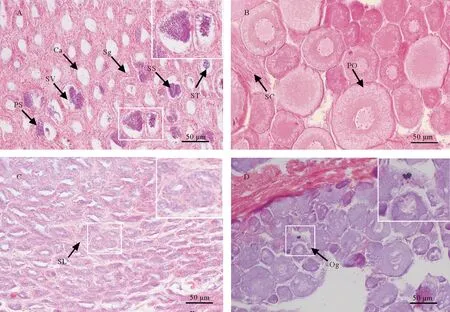
(A: 白消安处理组精巢 Testis from the busulfan treated group; B: 白消安处理组卵巢 Ovary from the busulfan treated group; C: 对照组精巢 Testis from the control group; D: 对照组卵巢 Ovary from the control group。Ca: 白消安处理后产生的空腔 Cavities formed after busulfan treatment; PS: 初级精母细胞 Primary spermatocyte; SV: 精小囊 Seminal vesicle; Sg: 精原细胞 Spermatogonium; SS: 次级精母细胞 Secondary spermatocyte; ST: 精细胞 Spermatid; SC: 支持细胞 Sertoli cell; PO: 初级卵母细胞 Primary oocytes; SL: 精小叶 Seminal lobule; Og: 卵原细胞 Oogonium。 N=3。)
2.2 测序数据的质控
经过高通量测序,在精巢组中平均获得原始数据为4 470万条,在卵巢组中平均获得原始数据为4 840万条;使用Fastp和Trimmomatic v0.36软件对得到的原始数据进行评估和质控,在精巢组和卵巢组分别得到平均为4 390万和4 710万个clean reads(见表2)。所有样本数据的Q20均在97.8%以上、Q30均在94.2%以上、Mapping rate均在96.6%以上(见表2)。数据质量符合要求,可用于后续分析。
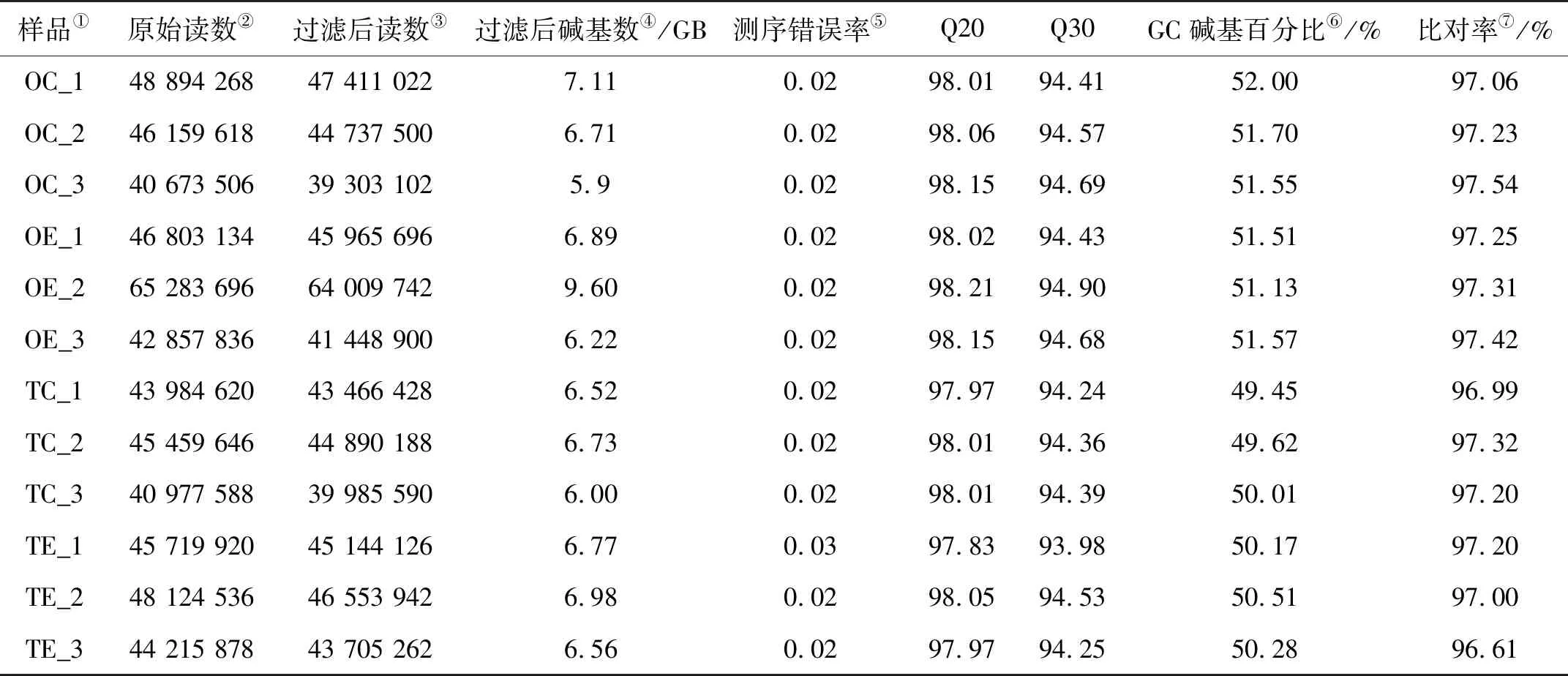
表2 12个样本的质控数据和序列比对结果统计
2.3 样本关系分析
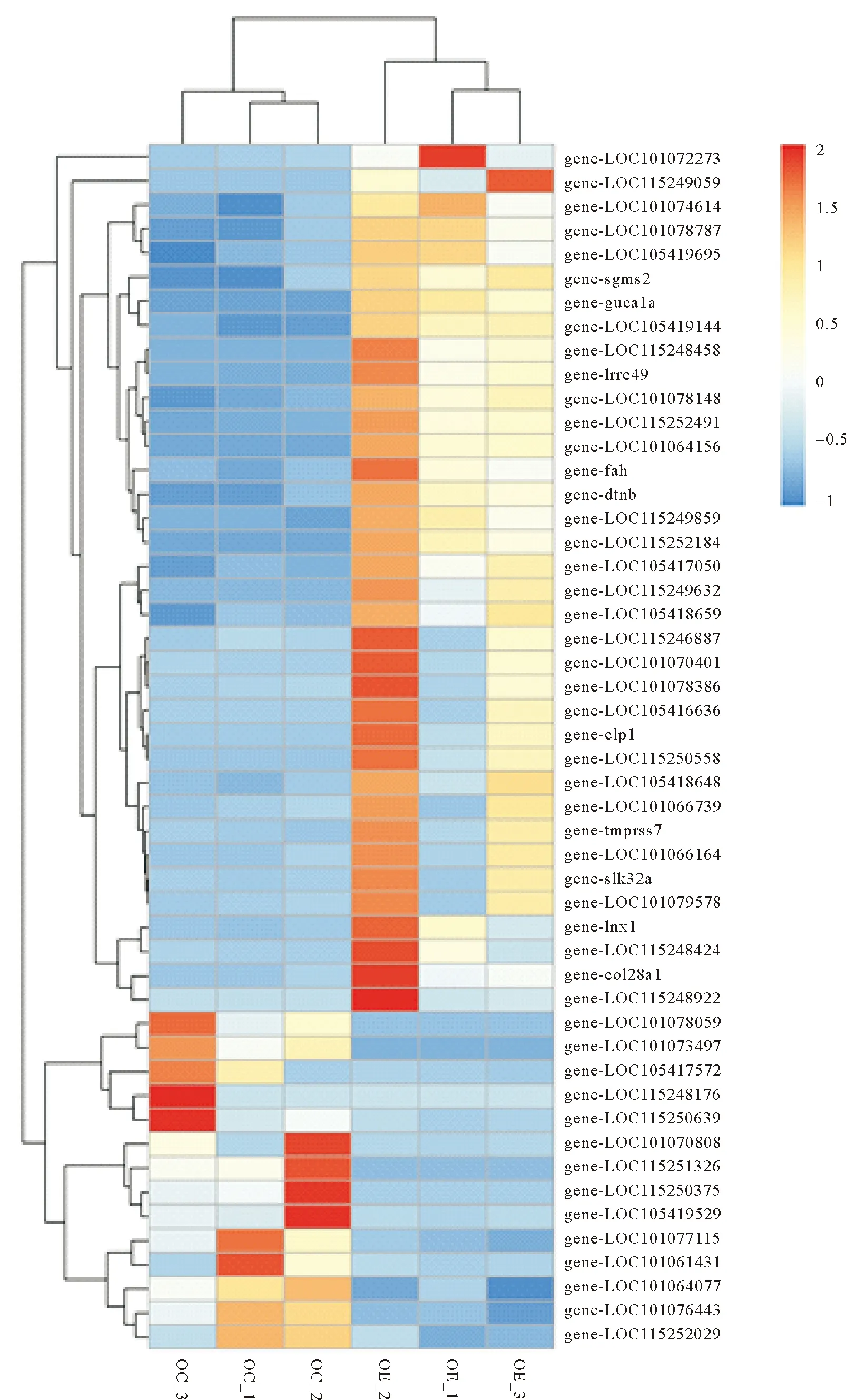
通过PCA对数据降维进行样本相关性分析,结果显示雌雄样本的主成分1(Dim1 47.5%)分开并各自聚为一类,说明性别引起的差异大于白消安处理产生的差异(见图2)。在主成分2(Dim2 14.8%)中,卵巢样本全部聚类在一起,说明卵巢的处理组和对照组样本之间差异较小;精巢处理组样本全都聚类在一起,说明处理组样本之间差异较小,白消安处理精巢获得了较为一致的处理效果,而精巢对照组样本聚类分离,说明对照组精巢样本之间存在差异,可能是雄性个体间发育过程不够一致(见图2)。为了判断精巢对照组样本的个体差异是否会对实验结果产生干扰,分别选择精巢和卵巢间、精巢对照组和处理组间及卵巢对照组和处理组间的差异基因进行样本间聚类分析,选择标准为p值最小的前50个基因(见图3—5)。结果显示,白消安处理组和对照组雄性个体各自聚为一枝,且在总样本分析中分枝最远(见图3和4);卵巢处理组和对照组间出现了聚类混乱(见图3),雌性个体OE1对聚类结果和差异基因的影响比较大(见图3和5),而雄性样本中不存在差异较大的个体。差异基因聚类分析说明PCA分析主成分2(Dim2 14.8%)中显示的精巢对照组样本差异主要由不响应白消安处理的基因引起,其差异对白消安处理结果影响不大,对后续分析干扰较小。

(圆圈代表置信圈 Circle represents confidence circle。 OC: 卵巢对照组 Ovarian control group; OE: 卵巢处理组 Ovarian treatment group; TC: 精巢对照组 Testis control group; TE: 精巢处理组 Testis treatment group。)

(OC: 卵巢对照组 Ovarian control group; OE: 卵巢处理组 Ovarian treatment group; TC: 精巢对照组 Testis control group; TE: 精巢处理组 Testis treatment group。每一列代表一个个体,每一行代表一个基因。红色代表该个体中基因上调,蓝色代表该个体中基因下调,颜色越深代表上下调程度越强。Each column represents an individual, and each row represents a gene. Red represents the upregulation of genes in the individual, blue indicates the downregulation of genes in the individual. The deeper the color, the stronger the degree of upregulation or downregulation.)

(TC: 精巢对照组 Testis control group; TE: 精巢处理组 Testis treatment group。每一列代表一个个体,每一行代表一个基因。红色代表该个体中基因上调,蓝色代表该个体中基因下调,颜色越深代表上下调程度越强。 Each column represents an individual, and each row represents a gene. Red represents the upregulation of genes in the individual, blue indicates the downregulation of genes in the individual. The deeper the color, the stronger the degree of upregulation or downregulation.)
(OC: 卵巢对照组 Ovarian control group; OE: 卵巢处理组 Ovarian treatment group。每一列代表一个个体,每一行代表一个基因。红色代表该个体中基因上调,蓝色代表该个体中基因下调,颜色越深代表上下调程度越强。Each column represents an individual, and each row represents a gene. Red represents the upregulation of genes in the individual, blue indicates the downregulation of genes in the individual. The deeper the color, the stronger the degree of upregulation or downregulation.)
2.4 表达量差异分析
使用DEseq2软件进行差异表达分析,在雄性白消安处理组和对照组中共筛选出25 876个unigenes,其中DEGs共576个,包括223个下调表达基因和353个上调表达基因(见图6A)。在雌性白消安处理组和对照组中共筛选出22 757个unigenes,其中DEGs共74个,包括23个下调表达基因,51个上调表达基因(见图6B)。雌雄样本的显著差异表达基因的数目差异说明白消安处理对精巢基因的转录水平影响大于卵巢。
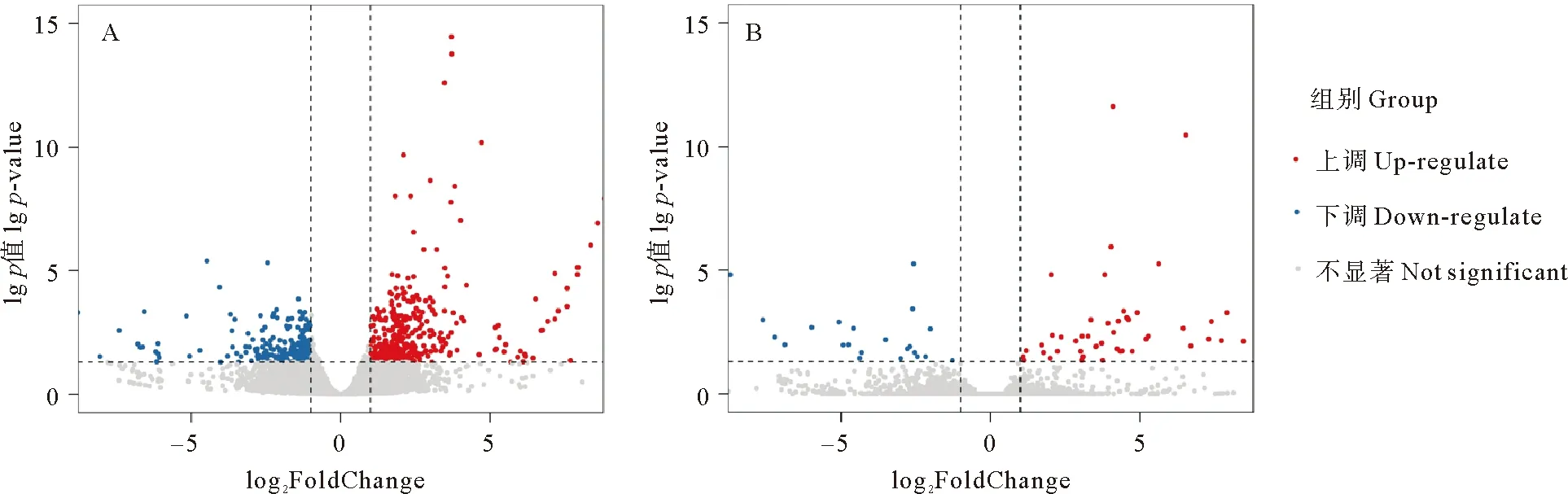
(log2 FoldChange代表白消安处理组与对照组间各基因表达量的比值,对其取以2为底的对数。蓝色代表显著下调的基因,灰色代表未达到差异基因筛选的显著性标准的基因,红色代表显著上调的基因。log2 FoldChange represents the ratio of gene expression levels between the busulfan treatment group and the control group, which calculated by taking the logarithm of the ratio using a base of 2. Blue indicates genes that were significantly down-regulated, gray represents genes that did not meet the significance criteria for differential gene selection, and red indicates genes that were significantly up-regulated.)
2.5 精巢差异表达基因的富集分析
比较精巢处理组和精巢对照组共筛选出25 876个unigenes,去除重复和无效基因后共获得23 221个差异基因,进行基因名转化后共获得18 676个EntrezID用于富集分析。GO条目富集到119个子类别,其中在分子功能模块中,发现连接酶活性(GO:0016874)、氧化还原酶活性(GO:0016491)、作用于配对供体的氧化还原酶活性,掺入或还原分子氧(GO:0016705)、双加氧酶活性(GO:0051213)、单加氧酶活性(GO:0004497)等条目被显著富集(见图7)。KEGG通路富集分析显示,差异基因被显著富集到氧化代谢、DNA修复和错配修复等过程,其中与DNA修复和错配修复通路包括:同源重组(Homologous recombination, tru03440)、范可尼贫血通路(Fanconi anemia pathway, tru03460)、DNA复制(DNA replication, tru03030)、核苷酸切除修复(Nucleotide excision repair,tru03420)、错配修复(Mismatch repair, tru03430)等,而氧化代谢通路包括氧化磷酸化(Oxidative phosphorylation, tru00190)(见图8)。GSEA分析结果显示,同源重组通路、范可尼贫血通路、错配修复通路相关基因的表达模式和enrichment score得分大于0,说明这些通路在白消安处理后受到上调;而核苷酸切除修复和DNA复制通路相关基因的表达模式和enrichment score得分小于0,说明这些通路在白消安处理后受到下调(见图9)。
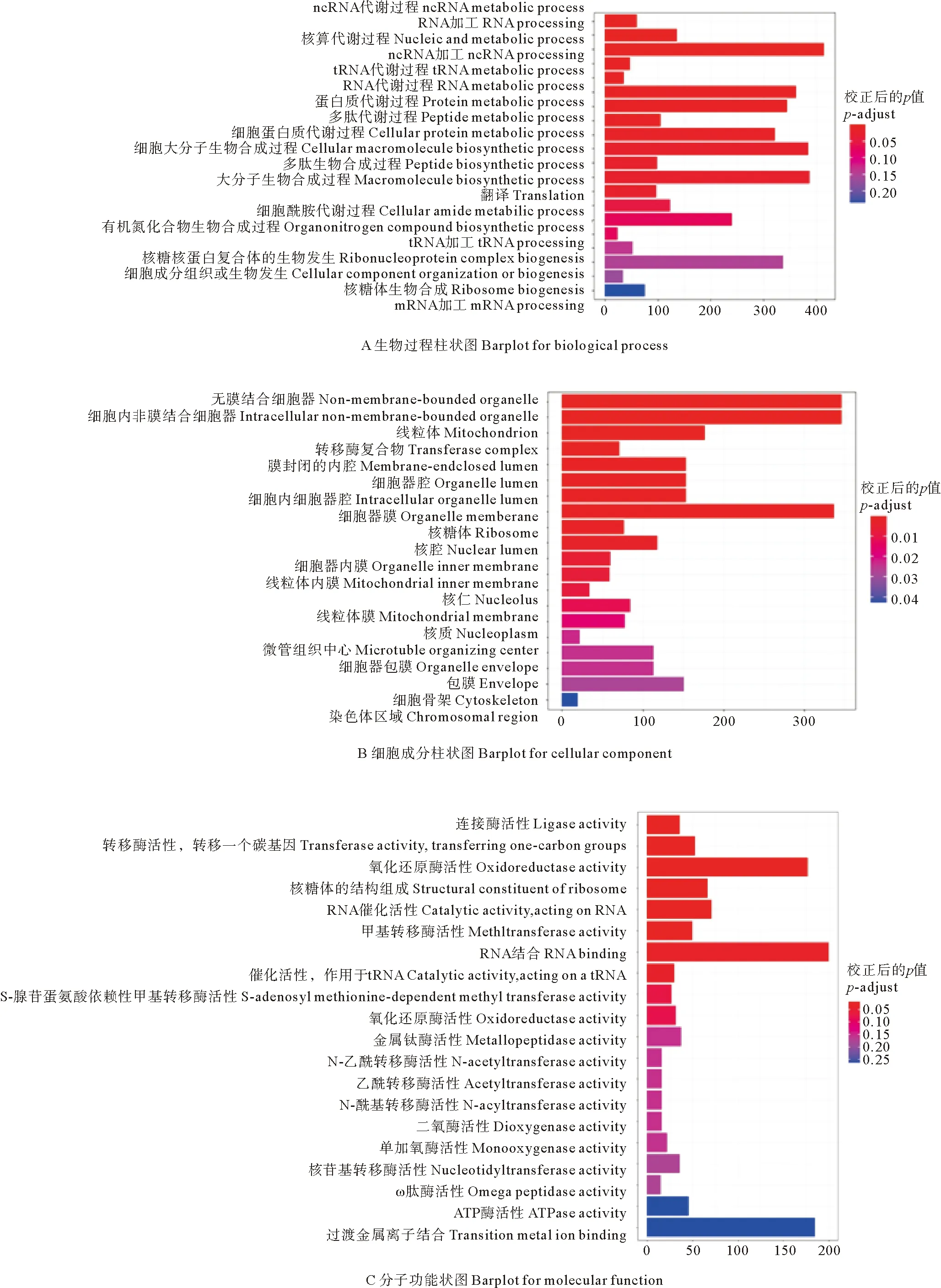
图7 雄性白消安处理组和对照组差异基因的结果在生物过程(A)细胞成分(B)和分子功能(C)中最富集的20个GO条目

图8 雄性白消安处理和对照组差异基因的KEGG通路气泡图
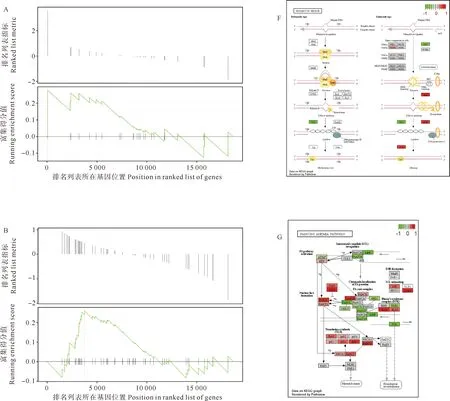
(A和F分别是错配修复通路的GSEA和通路图,显示通路为上调;B和G分别是范可尼贫血通路的GSEA和通路图,显示通路为上调;C和 H 分别是核苷酸切除修复通路的GSEA和通路图,显示通路为下调;D和I分别是同源重组通路的GSEA和通路图,显示通路为上调;E和J分别是DNA复制通路的GSEA和通路图,显示通路为下调。A and F represent the Gene Set Enrichment Analysis (GSEA) and Pathview diagram of the Mismatch repair pathway, showing an upregulation of this pathway. B and G represent the GSEA and Pathview diagram for Fanconi anemia pathway, showing an upregulation of this pathway. C and H represent the GSEA and Pathview diagram for the Nucleotide excision repair pathway, showing a downregulation of this pathway. D and I represent to the GSEA and Pathview diagram for the Homologous recombination pathway, showing an upregulation of this pathway. E and J represent the GSEA and Pathview diagram for the DNA replication pathway, showing a downregulation of this pathway.)
2.6 精巢差异表达基因的qRT-PCR验证
为验证RNA-seq的准确性,使用qPCR对hbae5、lnx1、mnat1、rpa3、wdr48、xrn2等差异表达基因进行定量检测。定量结果显示,hbae5、mnat1、rpa3基因在白消安处理后表达显著下调,与对照组相比,倍数分别是31.19、2.59和3.56倍;lnx1、wdr48、xrn2基因在白消安处理后表达显著上调,与对照组相比,倍数分别是3.63、2.61和48.84倍;这些基因的表达趋势与RNA-seq结果均一致(见图10),证明测序数据可信度较高。

(A: hbae5; B: lnx1; C: mnat1; D: rpa3; E: wdr48; F: xrn2。同一图中,左侧为qPCR结果,右侧为RNA-Seq 中的FPKM值。**号代表差异极显著,p<0.01。 In the same figure, the left side represents the qPCR results, while the right side shows the FPKM values from RNA-Seq. ** highly significant difference,p<0.01.)
3 讨论
鱼类生殖细胞移植技术的方法不同于哺乳动物、鸟类。在哺乳动物和鸟类中,化疗、X射线、γ射线以及高温都可以促进内源性生殖细胞凋亡[21,31-32]。而对于鱼类,其性腺、生殖系统都包被在腹腔中,难以使用放射疗法对性腺进行处理,因此鱼类多使用高温或多次注射白消安来对成鱼受体生殖细胞进行清除。这一方法在多种鱼类中都有应用,如高身丽脂鲤 (Astyanaxaltiparanae)[33]、哈奇氏牙汉鱼(O.hatcheri)[11]、褐牙鲆(Paralichthysolivaceus)[34]、尼罗河罗非鱼(Oreochromisniloticus)[10]、塞内加尔鳎(Soleasenegalensis)[35]等。
硬骨鱼和哺乳动物的生殖细胞发育过程存在较大差异,很难预估白消安对硬骨鱼性腺的处理效果,如在褐牙鲆中白消安对精巢产生了较强的作用效果[34],而在塞内加尔鳎中对卵巢有更强的作用效果[35],因此,在不同鱼类中使用白消安时需要摸索。为了探究白消安对红鳍东方鲀性腺退化的作用,我们通过性腺组织细胞水平观察和转录组分析对白消安处理效果和分子作用机制进行探讨。
有研究表明[36],在白消安处理过程中,小鼠睾丸激素水平保持恒定,小鼠的类固醇激素生成环境未改变,且在所有的时间点内,包括塞尔托利氏细胞(Sertoli cell)和莱迪希细胞(Leydig cell)在内的体细胞在大小、形状和定位上均表现正常,这表明白消安的作用不是通过介导内环境激素水平变化或破坏内环境造成的。这与我们在形态学观察结果相符,在白消安处理红鳍东方鲀精巢后,曲细精管横截面的精小囊中生殖细胞几乎被完全清除,最终形成空洞结构,而体细胞表现基本正常。
色谱研究结果表明,白消安通过鸟嘌呤-鸟嘌呤桥在DNA中产生交联或在嘌呤碱基处产生单烷基化,其中交联损伤可能比单烷基化更难修复[37]。由于DNA受到攻击,细胞周期容易被阻断在G2期[17],因此,具有细胞分裂活性、DNA活动剧烈的细胞更容易受到白消安作用的影响。我们在KEGG通路中富集的途径包含范可尼贫血通路(FA,tru03460),FA途径在协调复制和转录中起重要作用,这归因于FA途径的主要功能是去除DNA链间交联, 而链间交联衍生的双链断裂常通过同源重组途径(Homologous recombination,tru03440)实现修复,该通路同样被富集且显示为上调表达。Mehta等认为FA途径可能与白消安作用有关[38],我们的结果也支持这一假设。FA途径的Pathview可视化图显示,跨损伤合成(Translesion synthesis,TLS)处差异基因被富集且特异性上调,DNA复制、核苷酸切除修复通路下调;这暗示TLS可能在白消安引起的DNA损伤修复中起着重要的作用。
有报道证实,白消安可能通过对正常DNA的鸟嘌呤和腺嘌呤N7位进行烷基化[39],产生H2O2,诱导细胞进入凋亡途径,从而产生细胞毒性。此外,白消安还可以与谷胱甘肽形成缀合物导致谷胱甘肽消耗诱导氧化应激(Oxidative stress,OS)或通过抑制硫氧还蛋白还原酶调节细胞OS[40]。这些因素都能导致活性氧(Reactive oxygen species, ROS)增加和氧化应激的产生。本研究中,GO富集分析发现了多个氧化还原酶系统相关的分子功能条目,例如:氧化还原酶活性(GO:0016491),作用于配对供体、掺入或还原分子氧(GO:0016705),双加氧酶活性(GO:0051213),单加氧酶活性(GO:0004497)等;在KEGG分析中富集到氧化磷酸化通路(tru00190)。
关于白消安对精巢的作用原理,Kim等认为是由于精原细胞对白消安具有相对较高的抗性,而单倍体细胞如圆形精子细胞阶段对烷化剂如环磷酰胺极为敏感。因此,包括精原细胞和精母细胞在内的二倍体细胞可以抵抗白消安的细胞毒性,而单倍体生殖细胞如次级精母细胞、精子细胞、圆形精子、成熟精子等则被耗尽[40]。在本研究中,基于组织学观察和转录组分析结果,我们提出另外一种解释,可能有两种途径共同作用于阻止精子发生。一方面,白消安在G2期阻滞具有有丝分裂增值能力的精原细胞,干扰精原细胞分化因子,从而影响精原细胞的分化,促进精原细胞的休眠,进而在精子发生的源头产生遏制。另一方面,白消安会导致产生ROS,ROS可以攻击生物分子导致酶失活、遗传毒性损伤、细胞功能障碍和细胞死亡。同时,白消安的Ⅱ期代谢产物g-谷氨酰脱氢丙氨酸甘氨酸(g-glutamyldehydroalanylglycine, EdAG)是具有亲电部分的谷胱甘肽的脱氢丙氨酸类似物,其可能与蛋白质结合并破坏蛋白质的生物学功能[19]。因此,白消安及其代谢产物都会导致谷胱甘肽消耗,进一步增加ROS,最终造成了ROS浓度的大幅度增长,ROS浓度超过了自由基清除和抗氧化系统的承受范围,最终导致氧化应激(OS)[41-42]。而精子和精细胞DNA的压缩程度更高,DNA损伤防御和修复有限,导致精子和精细胞对OS高度敏感,剧烈增加的OS可能就会诱导精细胞进入细胞凋亡,但具体结果尚需进一步研究予以验证。
综上所述,白消安作用于所有类型细胞,但精原细胞分裂分化受到DNA损伤修复的影响,精细胞受到OS的影响,从而在不影响睾酮水平和支持细胞变化的前提下清除了受体体内的内源生殖细胞[36, 43-47]。此外,白消安处理两周后精巢组织虽然在组织形态学上为生殖细胞移植提供了生态位的空缺,但是组织内环境仍然处于氧化应激态,这种氧化应激态可能同样会攻击移植的生殖细胞,从而阻碍供体细胞的定植。因此,此时的组织仍然不适合立即进行生殖细胞移植,应继续拉长恢复期或在白消安后补充还原性的药剂如氨磷汀、谷胱甘肽来帮助组织恢复内环境稳态。
关于白消安处理在哺乳动物和鱼类卵巢的作用效果差异,可能与鱼类卵子发生模式有关。大多数哺乳动物雌性在胎儿期间就丧失了生殖细胞更新的能力,卵母细胞储备量固定[48];多年生硬骨鱼类与之不同,其生殖周期是以年为单位循环。卵巢根据其卵子发生模式可分为三种类型:全同步性、副同步性和非同步性。关于白消安对鱼类卵巢的作用效果差异,可能与处理性腺的分化阶段和发育时期有关。在褐牙鲆中,白消安处理对卵巢的作用效果弱于精巢[34];而在塞内加尔鳎幼鱼中,白消安处理对卵巢的作用效果强于精巢[35]。因为塞内加尔鳎幼鱼时期的雌性性腺发育速度快于雄性性腺,推测快速发育期的卵巢对白消安更敏感[35]。红鳍东方鲀卵巢为副同步性,其在卵子发生过程同时存在两个以上的不同卵母细胞阶段,且雌鱼每年产卵一次[1]。在本研究中采用白消安处理两龄半的亚成熟红鳍东方鲀雌鱼,此时卵巢处于非快速发育阶段,处理效果不佳。由于鱼类的精原细胞具有很强的发育可塑性并显示出双向分化潜能[49],因此,在XY性别决定型鱼类中,当将雄性生殖细胞成功移植到雌性受体中时,理论上就可以在受体后代中获得YY超雄鱼。而红鳍东方鲀雄鱼性腺具有更高的经济价值,培育超雄鱼进行全雄性育种可以显著增加养殖的经济效益。为获得白消安对卵巢更好的处理效果,需对处理时卵巢的发育时期、白消安处理的剂量和次数等进一步探究。
4 结语
本研究采用白消安处理红鳍东方鲀,使其雄鱼精巢中的生殖细胞被大量清除,可作为生殖细胞移植的理想受体,用于借腹生子和良种选育;从分子水平提供了对白消安诱导性腺退化作用机制的新认知,为在其他经济鱼类中应用细胞移植技术提供了实验依据。

