CCAAT增强子结合蛋白β在骨关节炎中对基质金属蛋白酶表达调控的研究进展
王泽宇,梁志宇,吴龙火,王妙飞,施伟梅
(1. 赣南医学院康复学院;2. 赣南医学院药学院,江西 赣州 341000)
骨关节炎(Osteoarthritis, OA)是一种多因素、进展缓慢且普遍见于65 岁以上人群的退行性关节疾病,其患病率和患病人数均居于世界首位,造成了严重的健康、经济和社会问题[1-2]。OA 最突出的特征是关节软骨降解导致滑膜、软骨下骨、半月板和关节周围软组织损伤,临床表现为关节不稳定、疼痛、僵硬、畸形等[3]。其中,OA 软骨中的基质金属蛋白酶(Matrixmetallo proteinases, MMPs)增多是引起细胞外基质进行性降解进而导致以上症状的主要原因之一[4]。MMPs 主要作用是分解代谢大部分细胞外基质成分,例如胶原蛋白、纤连蛋白和蛋白聚糖等,并参与细胞表面受体切割[5],其表达受到多种蛋白调控,如RUNX2、LEF1、AP-1、ELF-3、C/EBPβ等[6]。其中,CCAAT 增强子结合蛋白β(CCAAT enhancer-binding protein-beta,C/EBPβ)调控细胞各种生理学或病理学变化,也介入OA 的多种病理过程,包括细胞外基质降解、炎症反应、氧化应激等[7]。ZHANG M 等[4]研究表明,C/EBPβ 在OA 软骨和正常软骨中存在差异表达的现象。
1 关节软骨的结构
关节软骨是一层薄的结缔组织,由软骨细胞和细胞外基质组成,具有浅层、中层、深层和钙化软骨区四层结构[8]。其中,由软骨细胞分泌的细胞外基质的合成与降解处于动态平衡,也是OA 中主要被破坏的靶组织。细胞外基质的主要结构成分由胶原蛋白(约占干重的75%)和蛋白聚糖(约占干重的20%)以及其他含量较低的成分组成[9]。Ⅱ型胶原蛋白是软骨的主要结构蛋白,与Ⅵ、Ⅸ、Ⅺ型胶原蛋白相互连接,相互缔合,构成复杂的三维矩阵网络[10]。而蛋白聚糖则与连接蛋白和透明质酸一起形成大型复合物,填补胶原网络结构中的空隙[11-12]。
2 MMPs对关节软骨的影响
MMPs是一个Zn2+依赖性蛋白水解酶家族,可以降解关节软骨细胞外基质的所有成分。目前已确定了大约25 种MMPs。根据底物特异性,MMPs 可分为胶原酶、明胶酶、基质溶解素和膜型基质金属蛋白酶。胶原酶可以在生理pH 下切割完整的胶原纤维,明胶酶可以消化变性的胶原蛋白,基质溶解素能够分解多种细胞外基质成分,包括明胶[13-14]。
MMPs 在正常关节中通常以低水平表达,然而在OA 中MMPs 表达量会显著增多。MMPs 的7 个家族成员MMP-1、MMP-2、MMP-3、MMP-8、MMP-9、MMP-13 和 MMP-14 在关节软骨中都有其独特的功能且在不同状态下的关节软骨中呈现出不同的表达[15]。
MMP-1 是MMPs 中最受关注的蛋白酶,在多种关节细胞中表达,如软骨细胞、成纤维细胞和成骨细胞。在OA 中有大量的MMP-1 生成[16],并且具有通过在胶原纤维上依次移动来降解胶原的能力。单个MMP-1 分子也具有在不同点位切割多个胶原蛋白链的能力。所以MMP-1是导致OA 中软骨细胞外基质不可逆降解进而使关节软骨受损的主要介质之一[17]。
MMP-2(明胶酶A)可以参与Ⅰ、Ⅳ、Ⅴ、Ⅶ和Ⅺ型胶原蛋白以及蛋白聚糖的分解代谢[18]。MMP-2在正常关节软骨中的表达较低,而在OA 中表达量则显著增多,且一旦MMP-2 被完全激活,可能会导致关节软骨严重退化[19]。
MMP-3 参与Ⅱ、Ⅲ、Ⅳ、Ⅸ和Ⅹ型胶原蛋白、蛋白聚糖、纤连蛋白和弹性蛋白等的分解代谢。蛋白聚糖是第一个被MMP-3降解的蛋白[20]。MMP-3还可通过裂解Gln80-Phe81 键缓慢激活MMP-1、MMP-13等胶原酶原,生成Mr=41 000的完全活性胶原酶。胶原酶原MMP-1 在被MMP-3 蛋白水解激活前只有其最大胶原蛋白水解活性的10%~20%[21]。BLOM A B等[22]通过把MMP-3 敲除的小鼠进行OA 造模后发现,与对照组小鼠相比,关节软骨严重损伤的发生率减少了67%。
MMP-8(胶原酶2)是Ⅰ、Ⅱ和Ⅲ型胶原蛋白的主要降解酶,并可加速OA 软骨退化期间的ECM 分解[23]。MMP-8 还参与三螺旋纤维状胶原蛋白的降解,此为胶原蛋白变性的早期阶段[24]。
MMP-9(明胶酶B)主要在骨骺板的血管生成和软骨细胞凋亡中表达[16]。在OA 软骨中,MMP-9 主要降解Ⅰ和Ⅲ型胶原蛋白,且其表达量与关节软骨的病变程度有关[25]。
MMP-13 是迄今为止在软骨病理学中被研究最多的MMPs家族成员,其被认为是OA发展过程中的关键酶之一。MMP-13 在分解Ⅱ型胶原蛋白方面的活性比MMP-1 高5~10 倍[26],由于其对Ⅱ型胶原蛋白强大的分解能力,被认定为是导致OA 中关节软骨退行性病变的主要分解代谢因子。MMP-13 还能降解其他细胞外基质分子,如明胶Ⅰ、Ⅲ、Ⅳ、Ⅸ、Ⅹ和Ⅺ型胶原蛋白、生腱蛋白和蛋白聚糖等。在OA中,受C/EBPβ 影响,MMP-13 表达量显著增加,导致关节软骨中细胞外基质的降解程度更高[27]。
MMP-14(MT1-MMP)主要通过激活MMP-13 和MMP-2 调节胶原蛋白的降解。KNAPINSKA A M等[28]通过瞬时转染证实MMP-14 可以加工并激活MMP-2。而被激活的MMP-2又可与MMP-14共同提高MMP-13的激活率[13]。
3 C/EBPβ的生物学特性
CCAAT增强子结合蛋白(CCAAT-enhancer-binding proteins, C/EBP)是一个转录因子家族,包含6个结构相似但基因和功能不同的成员,即C/EBPα、C/EBPβ、C/EBPγ、C/EBPδ、C/EBPε 和C/EBPζ。其相似的结构域包括反式激活域、调节结构域及亮氨酸拉链区(bZIP)等。可参与许多生理活动,包括能量代谢、组织分化、造血、免疫反应、抗菌防御和压力反应等[29]。
不同于其家族的其他成员,C/EBPβ[也称为IL-6诱导的核因子(NFIL-6)/IL-6 诱导的DNA 结合蛋白(IL-6-DBP)]在其参与的转录活动范围方面表现出显著的可塑性,且C/EBPβ 功能的多样性可以通过调节C/EBPβ 的生物活性和亚细胞分布的信号依赖性翻译后修饰而进一步增加[30]。C/EBPβ 表达为3种N 末端结构域不同的蛋白质亚型,LIP(一种跨显性阻遏物)和LAP*、LAP(两者为转录激活剂),每一种都在各种细胞进程中表现出独特功能。C/EBPβ蛋白结构N 端部分的特点是:主要包含多达三个反式激活结构域(TAD1-3;LIP 中不存在)和两个调节结构域(LAP*和LAP 中的RD1 和2;在LIP 中,RD2区域是完整的,而RD1 以截断形式存在)。C/EBPβ和其他C/EBP 蛋白共享一个高度保守的C 末端,它包含一个与亮氨酸拉链型二聚化结构域相邻的基本DNA 结合结构域。而C/EBPβ 的活化需要通过亮氨酸拉链区结构域进行二聚化,或与另一个C/EBPβ分子或通过与任何其他C/EBP家族成员或某些具有兼容bZIP结构域的转录因子进行异二聚化[30-31]。此外,乙酰化和甲基化等翻译后修饰均在C/EBPβ 的结合、转录活性等调控中起着至关重要的作用[30]。
4 C/EBPβ在OA中对MMPs家族的调控作用
虽然OA 的发病机制尚无定论,但炎症和炎症反应被认为是导致OA 病理发展的主要因素。炎症细胞因子(如IL-1β 和TNF-α)密切参与异常代谢并促进OA 中软骨组织分解代谢[32]。GOLDRING M B等[33]研究表明,C/EBPβ结合基序存在于许多促炎细胞因子的启动子中,包括IL-1β、IL-6、IL-8、TNF-α、粒细胞集落刺激因子(G-CSF)等。与正常软骨相比,在OA患者的软骨中,由于促炎细胞因子IL-1β等增多,导致C/EBPβ 的表达量明显增加[7]。因此,IL-1β 会显著促进OA 的软骨破坏,这与软骨细胞中C/EBPβ的上调有关。RAYMOND L 等[34]通过研究确定了人MMP-1 启动子中位于-2 921 bp 的是IL-1β 和C/EBP共有的结合位点,并且C/EBPβ 是在IL-1β 刺激的软骨细胞中募集到该位点的主要转录因子。该位点有助于软骨细胞中IL-1β的诱导转录,若该位点缺失会降低MMP-1 启动子的整体转录活性,并显著降低IL-1β 对MMP-1 的诱导效果。且OA 软骨细胞中的C/EBPβ 经过IL-1β 刺激后增加了与MMP-1 中C/EBP位点的结合数量。C/EBPβ 是IL-1β 刺激的软骨细胞中ERK 通路的靶点,这表明C/EBPβ 可诱导MMP-1基因的反式激活。WB 结果显示,OA 软骨细胞中的IL-1β 刺激苏氨酸235 上的C/EBPβ 磷酸化,并且ERK通路抑制剂PD98059降低了这种磷酸化[34]。
TSUSHIMA H 等[35]通过免疫组化显示C/EBPβ和MMP-3 共定位于OA 滑膜和软骨中,表明C/EBPβ参与了MMP-3 表达的调节。通过免疫共沉淀结果发现,C/EBPβ 的核心结合位点位于人类MMP-3 启动子的-108~-100 bp 之间,并且直接与MMP-3 的启动子结合。过表达C/EBPβ 后发现,C/EBPβ 可显著诱导软骨细胞中的MMP-3活性增加,并且MMP-3和MMP-13 mRNA表达也明显增加。而通过siRNA敲除C/EBPβ后,软骨细胞中MMP-3、MMP-13 mRNA表达都明显减少。将含有人MMP-3启动子2 011 bp的荧光素酶报告基因构建体与C/EBPβ pCMV-LAP 表达载体共同转染到C28/I2 细胞,MMP-3 的启动子活性以剂量依赖的方式上调。
HAYASHIDA M 等[36]发现,C/EBPβ 和MMP-13均在OA 已耗尽蛋白聚糖的软骨层软骨细胞中表达,并且C/EBPβ 和MMP-13 的基因表达在载玻片中的分布相似,这一现象表明,C/EBPβ 和MMP-13 在退行性软骨中存在共表达。COIP结果显示MMP-13的启动子中C/EBPβ 反应元件的位置在-981 bp 和936 bp 之间,并且C/EBPβ 在刺激MMP-13的表达中起核心作用。此外,在经TNF-α 刺激后,C/EBPβ 与MMP-13启动子区的结合由-1 081 bp增加到-650 bp。过表达C/EBPβ 后发现,MMP-13 表达量高达正常组的32倍。HA Y J等[37]通过IL-1β刺激过表达和敲减C/EBPβ的细胞证实了其对MMP-13的正调控作用。HIRATA M 等[38]通过研究发现,C/EBPβ 还可以与RUNX2 形成最有效的转录伴侣,并进一步增加MMP-13的表达。此外,MMP-3在早期退行性软骨中表达上调,而在晚期OA 中表达下调。MMP-13 则在晚期OA软骨中表达上调[39]。这一现象提示C/EBPβ功能可能与OA的分期有关。
上述实验结果证明,C/EBPβ的过表达通过刺激活性蛋白水解酶MMP-1、MMP-3、MMP-13 的表达,促进细胞外基质降解(图1)。
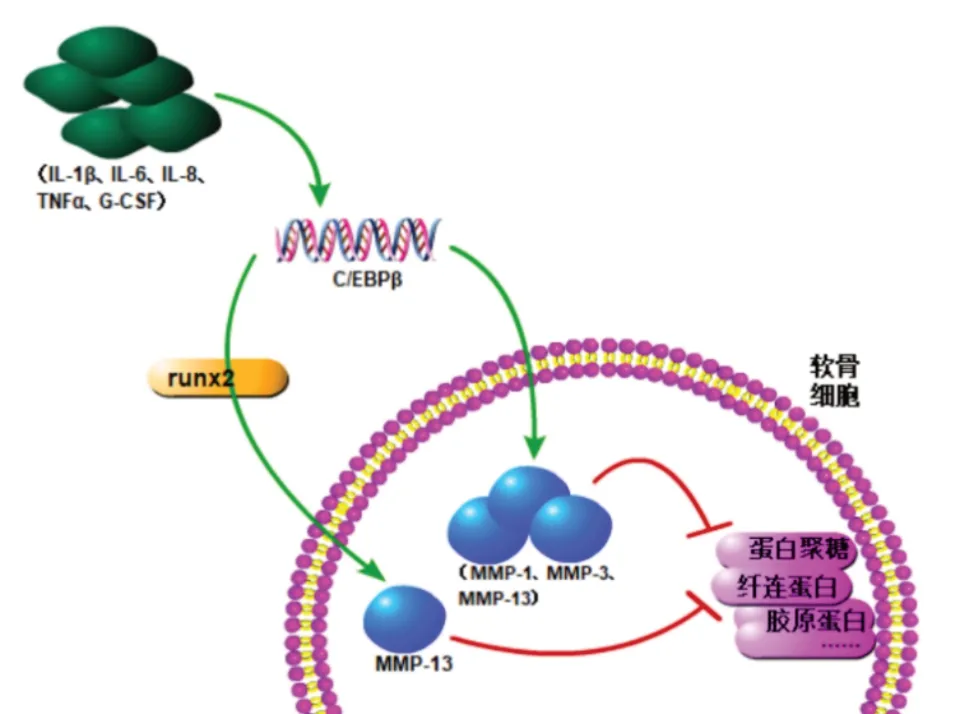
图1 C/EBPβ在骨关节炎中对MMPs表达调控示意图
5 小结与展望
OA 是一种严重危害患者日常机能和生活质量的关节疾病。因其会导致疼痛、疲劳、睡眠障碍、抑郁和残疾等,使患者的身心遭受巨大痛苦,并且对患者家庭和社会经济造成巨大负担。目前关于OA的发病机制尚不明确,但大部分学者认为,关节软骨的完整性是由合成代谢和分解代谢过程之间的平衡来维持,任何破坏这种平衡的因素都可能导致OA形成,而已有研究证明,C/EBPβ通过调控MMP-1、MMP-3、MMP-13 破坏OA 关节软骨合成代谢和分解代谢活性之间的平衡,并导致细胞外基质的不可逆降解,这表明C/EBPβ 有望成为治疗OA 的新靶点,并为OA 的防治提供新的治疗思路。当然,目前关于OA中C/EBPβ对MMPs调控的研究仍限于其家族中的MMP-1、MMP-3、MMP-13 成员,这只是OA 复杂的发生机制中的一部分,其他方面如其他蛋白对MMPs 家族成员的调控及软骨细胞的凋亡、自噬也值得后续的深入研究。

