丹参和降香配伍协同改善骨关节炎炎症微环境作用的计算机模拟研究
赵金阁,杨燕妮,付长龙,马德尊,叶锦霞,郑春松
(1. 福建中医药大学中西医结合研究院;2. 福建中医药大学药学院;3. 福建省中西医结合老年性疾病重点实验室,福建 福州 350122)
骨关节炎(Osteoarthrtis,OA)是一种以软骨损伤为主要病理特征的骨科常见疾病,其发病机制复杂,迄今许多软骨修复方法均未能得到令人满意的长期修复效果[1],寻求一种有效修复软骨损伤的疗法成为OA 研究领域的难点。既往研究发现,OA 中炎症微环境,可导致软骨细胞大量死亡及增殖、迁移能力受限,进而不能保证体内持续的组织修复[2-3],因此,改善OA 炎症微环境对软骨损伤修复至关重要。
丹参和降香是临床常用的活血化瘀相使药对,是复方丹参注射液的核心组成部分[4]。临床研究证实了复方丹参注射液能有效缓解OA 症状,而且,还发现OA 患者关节腔注射复方丹参注射液可减少炎性渗出和局部炎性因子[5-6],表明了丹参和降香在改善OA 炎症微环境方面具有重要的价值。但是,目前针对两者的配伍研究多集中在药代动力学及作用物质基础[7-8],在如何改善OA 炎症微环境且如何起到相使作用等方面未见报道。为此本研究拟以中药化学成分为切入点,从计算机模拟层面[9-11],可视化研究丹参和降香之间的联系,揭示其配伍在改善OA 炎症微环境中的意义,为其在OA 软骨损伤中的临床应用和基础研究提供新思路。
1 材料与方法
1.1 实验材料丹参和降香化学成分数据集;OA炎症微环境相关靶点。
1.2 研究工具本研究是在基于Windows 系统的Discovery Studio(DS)2.0 计算模拟与数据建模平台完成的。计算过程中除非特别说明,所选用的参数均为缺省值。
1.3 方法
1.3.1 丹参和降香化学成分的搜集及结构数据集建立从北京大学天然产物库中[12],检索丹参和降香各自的化学成分,分别搜集到180 个和119 个,下载其mol 格式的文件,导入DS 模拟平台,在“Ligand Minimization”模块中,Input Forcefield 处选择MMFF(默克分子力场)优化[13],建立丹参和降香各自的化学成分三维结构数据集,保存为sd格式文件。
1.3.2 丹参和降香化学成分结构数据集的聚类分析及全局相似度计算在DS Library Analysis 模块中[11],通过Cluster Ligands功能可视化分析丹参和降香化学成分结构数据集的聚类;并在Library Design模块中,通过Compare Libraries 功能比较丹参和降香化学成分结构数据集的全局指纹,计算其相似度分值。
1.3.3 丹参和降香化学成分结构数据集的化学空间分布分析在DS QSAR 模块中,Molecular Properties 下选择碳原子数、氮原子数、氧原子数、分子量、氢键给体数目、氢键受体数目、脂水分配系数和可旋转键数目等描述符75 个[11],通过Calculate Molecular Properties 功能计算丹参和降香化学成分结构数据集各自的多维描述符值,以此构成的多维空间分别定义为两数据集的化学空间[14]。利用主成分分析降维技术[15],将上述多维数据有效映射到三维化学空间上,可视化分析丹参和降香化学成分在化学空间分布上的异同。
1.3.4 丹参和降香活性成分筛选及其化合物-靶点网络分析根据治疗靶数据库(Therapeutic Target Database)[16]和OA 炎症微环境的相关文献[2,17],确定白介素1β(Interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)、基质金属蛋白酶1(Matrix Metallopeptidase 1,MMP-1)、MMP-3、MMP-9 和MMP-13 为研究靶点,从RCSB Protein Data Bank 上[18]下载其三维结构,代码分别为3O4O、1ALU、2AZ5、3AYK、4G9L、1GKC 及3I7I;在DS 模拟平台中[19-20],蛋白结构去溶剂、去配体、加氢处理后,以其活性原配体来确定活性位点导入Input Binding Site,并在Input Control Ligands 下导入各自的原配体,通过DS LigandFit 模块研究丹参、降香化学成分和靶点的相互作用;对接成功后,分别以原配体DOCK-SCORE 为阈值,大于阈值的化合物视为丹参和降香中能改善OA 炎症微环境的潜在活性化合物。将活性化合物及其作用靶点视为节点,两者的相互作用用边表示;采用Cytoscape 软件[21],构建丹参和降香各自的化合物-靶点可视化网络,并在此软件的Network Analysis 模块下,通过分析网络核心节点,揭示丹参和降香配伍在改善OA 炎症微环境中的意义。
2 结果
2.1 丹参和降香化学成分结构数据集的聚类及全局指纹相似度可视化结果采用基于最大不相似度划分的重定位方法进行丹参和降香化学成分结构数据合集的聚类,结果显示,以3-Hydroxytanshinone、(3R)-(+)-Mucronulatol、Cyclo-(L-Pro-L-Ser)、Tanshinone IIB、3,7,11-Trimethyldodeca-1,10-Diene-3,6,7-Triol、Salvianolic acid B、(Z,Z)-9,12-Octadecadienoic acid、Isocryptotanshinone、Rel-(3S,6R,7S)-3,7,11-Trimethyl-3,6-Epoxy-1、10-Dodecadien-7-ol和Danshensu 为聚类中心,将此丹参和降香数据合集的化学成分分为10 类,而且,第1、2、3、4、5、6、8、9、10类中均存在丹参、降香的化学成分,但第7类中仅有丹参的化学成分(图1)。在此基础上,通过生成丹参和降香化学成分各自结构数据集的全局指纹后,计算Tanimoto 相似系数(Tanimoto similarity coefficient),结果显示两者的全局指纹相似度分值为0.637 5。

图1 丹参-降香化学成分结构数据集的聚类
2.2 丹参和降香化学成分结构数据集的化学空间可视化结果丹参和降香化学成分结构数据集在分子量、氢键受体数目、氢键给体数目和脂水分配系数等描述符值的分布区间均存在交集,见表1。图2 为丹参和降香化学成分结构数据集的化学空间,结果显示,相对于降香化学成分结构数据集,丹参化学成分结构数据集在化学空间上具有更好的分散性,且在后底部与降香化学成分结构数据集存在相同或相近的化学空间。
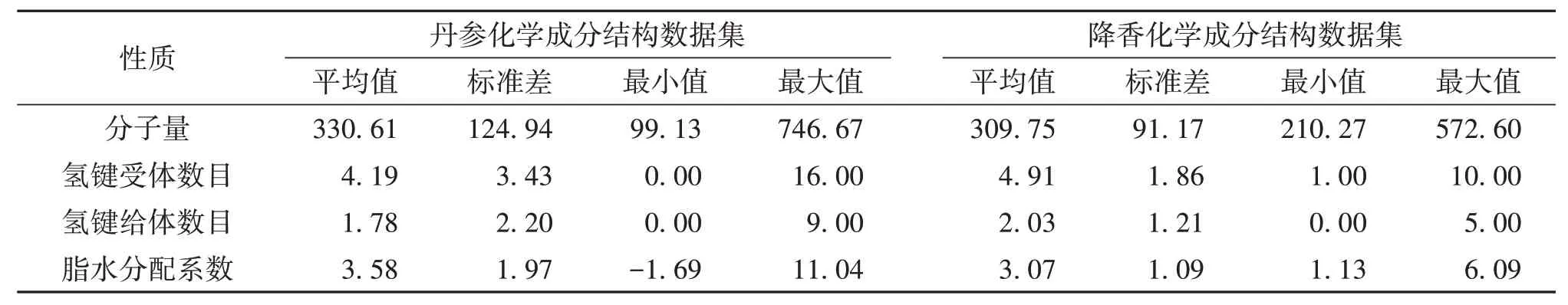
表1 丹参和降香化学成分结构数据集的重要描述符

图2 丹参和降香化学成分结构数据集的化学空间分布
2.3 丹参和降香改善OA 炎症微环境的化合物-靶点网络可视化结果丹参化合物-靶点网络显示,丹参中有32 个成分与IL-1β、IL-6、TNF-α、MMP-1、MMP-3、MMP-9和MMP-13有较好的作用(图3);降香化合物-靶点网络显示,降香中有64个成分与IL-1β、IL-6、TNF-α、MMP-1、MMP-3、MMP-9 和MMP-13 有较好的作用(图4)。而且,丹参化合物-靶点网络中含有39 个节点和91 条边,降香化合物-靶点网络中含有71 个节点和132 条边,均体现了“一对多,多对一”的特点(表2)。
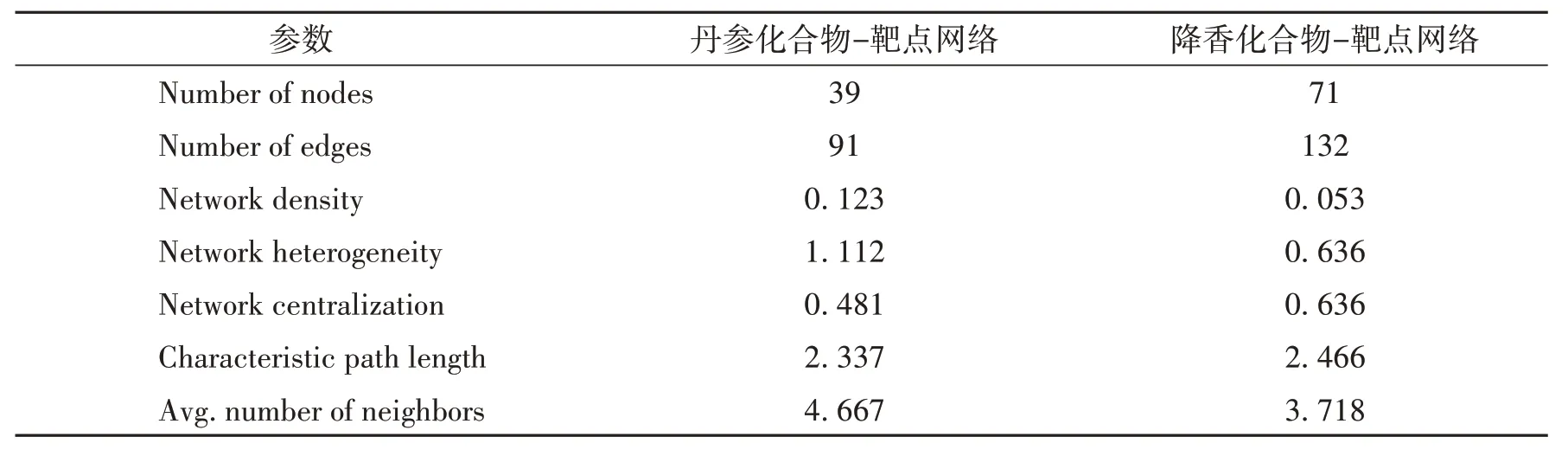
表2 丹参和降香改善骨关节炎炎症微环境的化合物-靶点网络重要参数
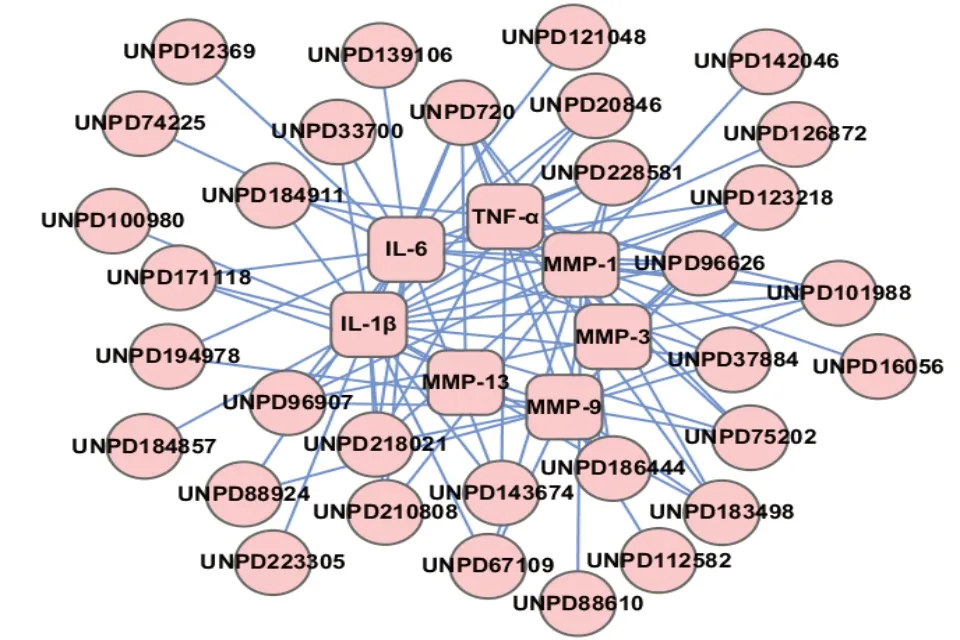
图3 丹参改善骨关节炎炎症微环境的化合物-靶点网络
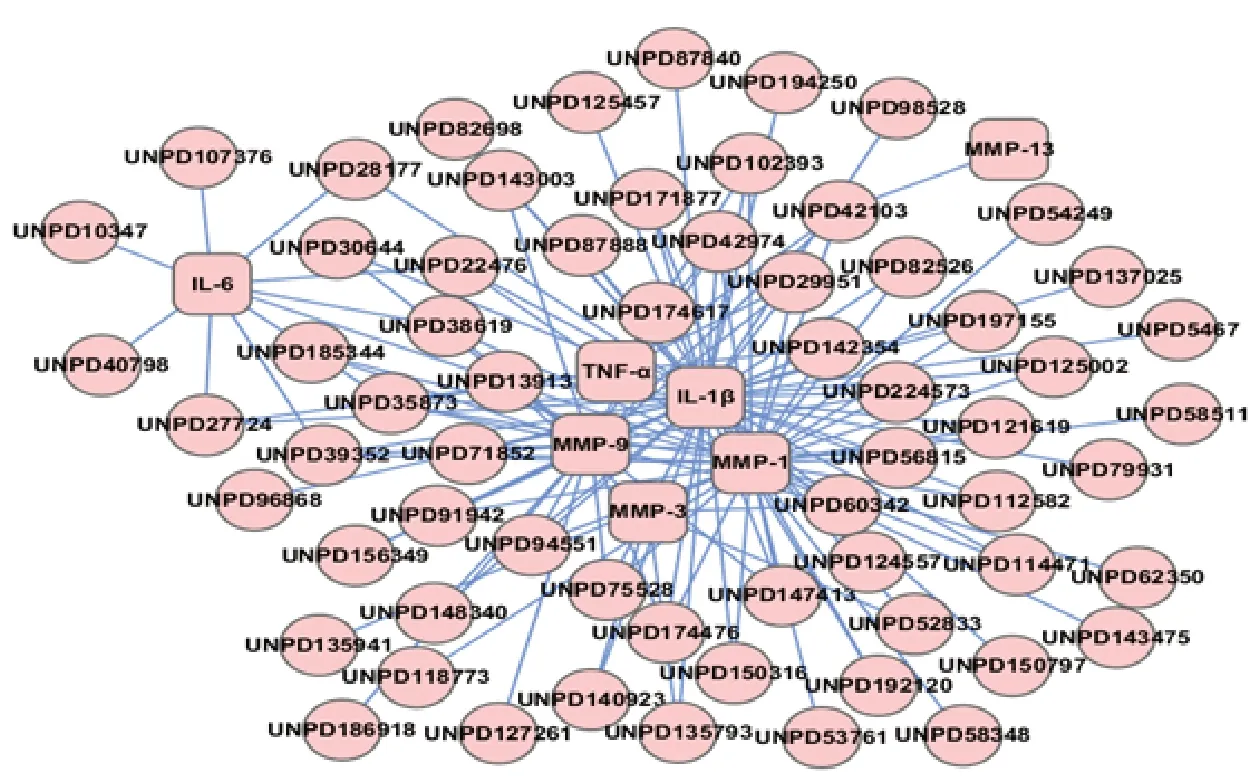
图4 降香改善骨关节炎炎症微环境的化合物-靶点网络
以节点度值(Degree)≥所有点中位数值2 倍,并满足接近中心度(Closeness Centrality)以及介数中心(Betweenness Centrality)>所有点中位数值为阈值[22],来筛选化合物-靶点网络的核心节点,结果显示丹参改善OA 炎症微环境的核心活性物质为Salvianolic acid C、Salvianolic acid D和Salvianolic acid A,属于酚酸类物质,其核心靶点为IL-1β、IL-6、TNF-α、MMP-1和MMP-9(表3);降香改善OA炎症微环境的核心活性物质为Butein、2''',4'''-Di-Me ether-(2S,3'R,4'R)-6-(2',3',4',7-Tetrahydroxyisoflavan-4-yl)-4',5,7-trihydroxyflavanone、(2S)-3',5,5',7-tetrahydroxyflavanone、(R)-2,3'-Bis-(2-hydroxy-4-methoxyphenyl)-3',4'-dihydro-4,2'H-[3,6']bichromenyl-7,7'-diol、7-Hydroxy-3-[4-hydroxy-5-((R)-7-hydroxy-chroman-3-yl)-2-methoxy-phenyl]-2-(2-hydroxy-4-methoxy-phenyl)-chromen-4-one、4',4''-(R)-Di-Me ether-2',4',7-Trihydroxy-3-(2',4',7-trihydroxyisoflavan-5'-yl)-2-flavene 和4',4'''-Di-Me-ether-(R)-2',4',7-Trihydroxy-3-(2',4',7-trihydroxyisoflavan-6-yl)flav-2-ene,属黄酮类物质,其核心靶点为IL-1β、IL-6、TNF-α、MMP-1、MMP-3和MMP-9(表4)。

表3 丹参改善骨关节炎炎症微环境的化合物-靶点网络核心节点

表4 降香改善骨关节炎炎症微环境的化合物-靶点网络核心节点
3 讨论
OA 属于传统医学痹证的范畴,王清任在《医林改错》中提出“痹证有瘀血”论,在此基础上,高世超等[23]从瘀论治OA,指出了瘀血作为重要的病理因素及致病产物贯穿于本病的始末,在OA 的发生发展中起着关键作用。现代医学从血液流变学、细胞因子、骨内高压等不同角度丰富和发展了“痹多夹瘀血”理论,且在临床实践中证实了活血化瘀药对OA 疗效确切[24]。此外,也证实了软骨细胞是OA 发生病理变化的主要介导者,其可产生TNF-α和IL-1β等前炎性细胞因子,进而刺激MMPs的合成,形成特定的炎症微环境,从而加剧OA 的发展[2],提示改善OA炎症微环境至关重要。
近年来,中医药可视化已成为国际化背景下的传统中医药发展方向[25],本文使用的DS平台是一个业界公认的药物发现与生物大分子计算模拟研究平台,其中,“Ligand Minimization”模块已用于人参等分子数据集的优化研究[9-11];Library Analysis 和Design模块已用于当归活血和止痛功效成分的关联性分析[10];QSAR 模块已用于预测人参抗炎镇痛的作用,LigandFit 模块已用于人参分子数据集与抗炎镇痛靶点的相互作用研究[9],提示DS 平台已成为中医药治病原理可视化研究的常用技术之一。而且,由于中药是众多结构各异的化合物组合,其作用机制非常复杂;若按传统的中药提取—分离—活性分析方法,难以研究中药的多组分和多靶点作用,张卫东[26]、徐筱杰[27]等提出通过计算机模拟方法(如DS软件)了解更多中药组分和疾病治疗靶标信息的基础上,再进行实验工作可能会减少人力和物力的投入。因此,本文从“活性成分到中药”的反向途径出发,建立丹参和降香的分子数据集及其构效关系,以炎症微环境靶点来建立一个整体的虚拟药理模型,并借助计算机模拟平台,研究两者改善炎症微环境中的协同作用,可为其后期的实验研究提供方向。
相似性原理是指结构相似的化合物具有潜在的相似或相同生物及药效活性[28]。本文通过分子指纹表示化合物的结构,发现丹参和降香化学成分结构数据集的全局相似度高,且丹参和降香存在相同的化学成分类别,提示两者在很大程度上具有潜在的相似或相同生物及药效活性。另外,化学空间是一系列物理化学性质组成的多维空间,相似的化学空间可能具有相似的活性性质[29];图2 显示两个数据集在特定的区域存在相近的化学空间分布,进一步说明了丹参和降香在性能功效方面有某种共性;而且,表1显示两个数据集分子量平均值<500、氢键受体数目平均值<10、氢键给体数目平均值<5 和脂水分配系数平均值<5。根据Lipinski 的五规则[30],提示两个数据集中化合物具有很好的类药性。因此,从化学结构的角度看,丹参和降香配伍后,可能起到功效上的相同或相似作用的叠加,为丹参和降香的活性成分研究提供依据。
为进一步研究丹参和降香潜在活性成分的结构和功能的相关性,构建了其活性成分群与OA 炎症微环境多个靶蛋白相互作用的可视化网络(图3和图4),表2 显示两个网络的特征路径长度(Characteristic path length)值相近,表示两个网络具有相似的全局特征[31],提示丹参和降香在改善OA 炎症微环境的作用方式上存在相似性。在此基础上,计算了其节点的度值、介数中心度和接近中心度,其中,节点的度是指连接到该节点的边数,介数中心度是指节点位于其他网络成员联系的最短路径上的次数,接近中心度是指网络规模与最短路径长度之和的比值,这3 个参数体现了节点在网络中的中心地位和作用[22,32],用于筛选丹参和降香改善OA炎症微环境的化合物-靶点网络核心节点,由此进一步揭示丹参和降香改善OA 炎症微环境中的重要作用。
从网络上化合物的核心节点分析,表3 显示丹参中有3 个化合物与≥6 个靶点存在相互作用,表4降香中有7个化合物与≥4个靶点存在相互作用,如丹参中Salvianolic acid A(节点UNPD96626)能与IL-1β、IL-6、TNF-α、MMP-1、MMP-3 和MMP-9 有较好的作用,降香中Butein(节点UNPD13913)能与IL-1β、IL-6、TNF-α、MMP-1 和MMP-9 有较好的作用,两者配伍后通过不同的化合物共同作用相同的靶点,起到功效上相同作用的叠加;另外,丹参中Methyl tanshinonate(节点UNPD88610)能与MMP-1 有较好的作用,降香中Isoliquiritigenin(节点UNPD98528)能与IL-1β 有较好的作用,两者配伍后通过不同的化合物共同作用于不同的靶点,起到功效上相似作用的叠加。其中,有文献报道,Salvianolic acid A 能降低软骨中TNF-α、IL-6、MMP-1等表达,Butein 能降低炎性软骨细胞中TNF-α、IL-6、MMP-1、MMP-3和MMP-13等表达,Isoliquiritigenin 抑制炎性软骨细胞中MMPs的产生,具有抗OA 的作用[33-35]。因此,丹参和降香改善OA 炎症微环境,主要是通过相同及不同靶点的共同作用来实现的。
另外,从靶点的功能看,软骨细胞产生IL-1β、IL-6 和TNF-α 等前炎性细胞因子,刺激MMPs 的合成[2]。其中,MMP-1、MMP-9 和MMP-13 可能是胶原降解以及关节破坏的主要介导因子,其变化最能够反映软骨细胞外基质Ⅱ型胶原的代谢变化情况[36-37],而且,MMP-3可通过对间质胶原酶的激活来降解软骨Ⅱ型胶原,并可激活MMP-13 的表达,进而诱导ADAMTS-4 和ADAMTS-5 的生成,进一步加快关节软骨的破坏[38]。即若能抑制上述因子的表达,则可能阻止OA 加剧至爆发性的炎症阶段,有助于软骨损伤的修复。表3显示丹参作用的核心靶点为IL-1β、IL-6、TNF-α、MMP-1 和MMP-9,表4 显示降香作用的核心靶点为IL-1β、IL-6、TNF-α、MMP-1、MMP-3 和MMP-9,提示丹参和降香配伍一方面主要通过对IL-1β、IL-6、TNF-α、MMP-1 和MMP-9 的共同作用起到协同延缓软骨退变的作用,另一方面可通过靶点之间的相互作用起到协同作用。因此,丹参和降香配伍可通过增强对IL-1β、IL-6、TNF-α、MMP-1、MMP-3、MMP-9 和MMP-13 表达的抑制作用,减少软骨聚蛋白多糖和Ⅱ型胶原的降解,多靶点协同减轻或修复关节软骨的损伤,延缓OA的发展进程。
综上所述,丹参和降香作为活血化瘀药对,在治疗OA 方面具有重要价值。通过研究与分析,发现丹参和降香在化学结构特征及化学空间分布上具有很大程度的相似性,存在相似或相同的生物及药效活性,其核心活性物质分别为酚酸类和黄酮类化合物;丹参和降香配伍后具有更多的潜在活性成分种类和数量、更广的化学空间分布,可通过作用于相同靶点或不同靶点在改善OA 炎症微环境中发挥协同效应。即计算机模拟实现丹参和降香配伍协同改善骨关节炎炎症微环境作用的可视化分析。在此基础上,未来课题组将开展活性成分和靶点的体内外实验验证,进一步挖掘丹参和降香之间以及其与OA 的关系,为OA 新药的开发以及复方优化提供新的思路。

