在情境中建构 在探究中认同 在应用中内化
张现霞


摘要: 开展“素养为本”的高三化学专题复习,能有效促进学生知识、能力、素养的全面发展。以“物质的定性检验模型建构与应用”为例,从单一情境的问题解决到复杂情境的问题解决,从回顾旧情境提炼分析思路到在新情境中建构认知模型,从在科学探究中完善、认同认知模型到在应用中内化、升华认知模型,初步形成基于模型认知的高三化学专题复习教学设计策略。
关键词: 模型建构与应用; 物质的定性检验; 科学探究
文章编号: 10056629(2023)10004406 中图分类号: G633.8文献标识码: B
“证据推理与模型认知”是化学学科核心素养之一,《普通高中化学课程标准(2017年版2020年修订)》对其提出了具体的课程目标,其中包括“基于证据进行分析推理,证实或证伪假设;能依据物质及其变化的信息建构模型,建立解决复杂化学问题的思维框架”[1]。基于证据推理,建立思维框架,形成认知模型,可以降低研究对象的复杂性,提高问题解决的准确率和效率。
1 设计思路
物质的检验是化学实验的重要环节之一,是为确定研究对象的组成,根据物质的某些特殊性质或特征反应进行的有针对性的检验,一般分为定性检验和定量检验。物质的定性检验可分为无干扰因素和有干扰因素两类情况。新授课中关于物质定性检验的学习常常分散在必修课程和选择性必修课程的各个单元,高三复习时往往需要对其进行汇总和再巩固。
“素养为本”的高三化学专题复习不是基础知识的简单罗列和机械堆砌,而是要在夯实基础知识的同时提炼分析方法、建构认知模型,并在运用认知模型解决实际问题的过程中对模型进行内化和升华。在进行物质定性检验的专题复习前,学生已初步建立了无干扰因素时物质定性检验的一般思路(见图1),即明确检验目标,根据目标的特殊性质或特征反应确定检验试剂,执行检验操作,根据特征实验现象,得出检验结论,但对于有干扰因素时该物质定性检验的认知模型还缺乏深层次的思考和认识。因此,本节复习课不仅要夯实基础,建构并完善物质定性检验的认知模型,更重要的是要引导学生在探究中认同模型,最终灵活应用模型解决新情境下的复杂问题。
2 教学目标
(1) 回顾两则新授课时经历的旧情境——“检验补血剂是否变质”和“探究炭与浓硫酸的反应产物”,复习“无干扰因素时物质定性检验的一般思路”,并在此基础上,形成“有干扰因素时物质定性检验的一般思路”。
(2) 在“检验Na2SO4和NaCl混合溶液中的Cl-”的新情境中,通过科学探究解决争议,建构、完善、认同物质定性检验的认知模型。
(3) 应用物质定性检验的认知模型解决新情境下的实际问题,同时对认知模型进行内化和升华。
3 教学过程
3.1 情境再现提炼思路
再现高一课堂中学生亲历的两则物质定性检验情境。
一是“检验补血剂是否变质”的情境。学生比较容易形成一致意见,即将补血胶囊内的药物取出(防止药物包裹层成分的干扰),将药物研细,加入稀硫酸溶解后过滤,取少量滤液于试管中,滴加几滴KSCN溶液,若溶液变成血红色,说明该补血剂已变质。借助该旧情境帮助学生回顾“无干扰因素时物质定性检验的一般思路”。
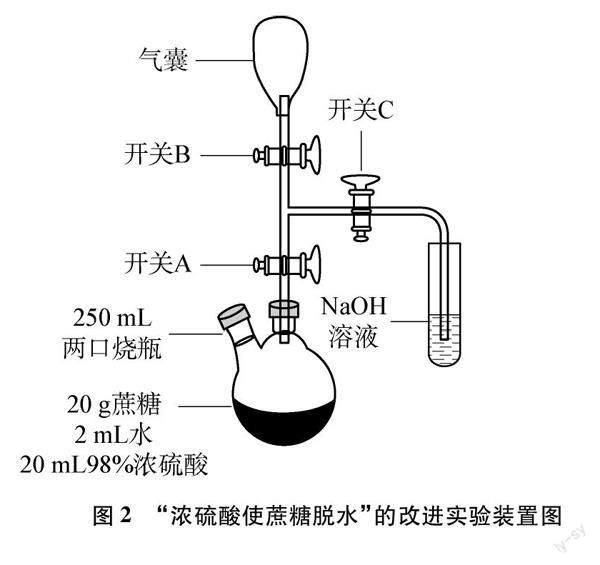
二是“探究炭与浓硫酸的反应产物”的情境。播放新授课时的课堂教学视频片断——借用“浓硫酸使蔗糖脱水”的改进实验(见图2)。回顾探究炭与浓硫酸反应产物的实验方案(不考虑水的检验),即关闭开关A,打开开关B和C,挤压气囊使气体先后通入品红溶液①、酸性高锰酸钾溶液、品红溶液②、澄清石灰水。若品红溶液①退色,说明炭与浓硫酸反应的产物中含二氧化硫;若酸性高锰酸钾溶液退色,
品红溶液②不退色,澄清石灰水变浑浊,说明炭与浓硫酸反应产物中含二氧化碳。在已有的探究实验“检验二氧化碳、二氧化硫混合气体中的二氧化碳”的基础上,提炼“有干扰因素时物质定性检验的一般思路”(见图3):明确检验目标和干扰因素,利用二者性质的差异除尽干扰因素后,再用检验试剂对检验目标进行检验,得出检验结论,确保检验目标、检验试剂、检验现象之间具有唯一性。
设计意图:回顾学生亲身经历的物质定性检验实验情境,复习无干扰因素时物质定性检验的一般思路,提炼有干扰因素时物质定性检验的一般思路,为建构物质定性检验的认知模型做铺垫。
3.2 高考题引发争论
2021年上海化学等级考第25题在题干中给出已知信息:SO2-4可能会干扰Cl-的检验,要求写出检验Na2SO4和NaCl混合溶液中的Cl-的实验方案。课堂上学生给出的方案主要集中在以下两个方向:
方案一:取少量待测液于试管中,滴加AgNO3溶液,产生白色沉淀,再加入足量的稀硝酸,若白色沉淀不完全溶解,则混合溶液中含有氯离子,若白色沉淀完全溶解,则混合溶液中不含氯离子。
理论依据:AgCl不溶于稀硝酸,Ag2SO4溶于稀硝酸。
方案二:取少量待测液于试管中,先加入足量的Ba(NO3)2溶液至不再有沉淀产生,静置;取上层清液于另一试管中,加入AgNO3溶液,若有白色沉淀产生,则原溶液中含有氯离子,若无白色沉淀产生,则原溶液中不含氯离子。
理论依据:Ag2SO4可能也不溶于稀硝酸,先将干扰因素排除后再进行氯离子的检验。
课堂上学生一时争执不休,难以形成一致意见。教师带领学生从理论与实验两方面开展科学探究。
设计意图:课堂生成具有争议的问题,在争论中引发学生对物质定性检验的深度思考,提出科学探究任务,培养科学探究意识。
3.3 科学探究解决争论
引导学生首先寻找争议的核心:一是SO2-4是否真的会干扰Cl-的检验;二是Ag2SO4是否溶于稀硝酸。然后從争议的核心出发,依据探究目的,设计探究方案,对方案进行讨论、优化,运用理论分析和化学实验等方法进行科学探究。其中实验所需溶液均用蒸馏水配制而成。
3.3.1 关于AgCl和Ag2SO4沉淀情况的探究
[理论分析]
查阅工具书,获得25℃时Ag2SO4的溶度积常数Ksp(Ag2SO4)=1.2×10-5,AgCl的溶度积常数Ksp(AgCl)=1.77×10-10[2]。由此可知,常温下AgCl在水中的溶解度远小于Ag2SO4,即AgCl比Ag2SO4更易析出。
[实验验证]
实验一:分别向1mL 0.1mol·L-1的NaCl和Na2SO4溶液中滴加1mL 0.1mol·L-1的AgNO3溶液,观察沉淀产生情况。
实验现象:向0.1mol·L-1的NaCl溶液中滴加0.1mol·L-1的AgNO3溶液,迅速产生大量白色沉淀;0.1mol·L-1的Na2SO4溶液和0.1mol·L-1的AgNO3溶液等体积混合,溶液澄清透明,无浑浊现象(见图4)。
实验二:0.5mol·L-1的AgNO3溶液与0.5mol·L-1的Na2SO4溶液等体积混合,观察实验现象。
实验现象:溶液变浑浊(如图5)。
[探究小结]
AgCl比Ag2SO4更易析出。若Na2SO4和NaCl混合溶液中SO2-4浓度较大,用AgNO3溶液检验Cl-时,SO2-4可能会干扰Cl-的检验。
设计意图:培养学生敢于质疑的意识,从理论分析和实验验证两个角度开展科学探究,建立观点、结论和证据之间的逻辑关系,促进学生高阶思维的发展,在真实情境下加深对物质定性检验中“干扰”二字的理解,为后续探究过程做铺垫。
3.3.2 关于Ag2SO4是否溶于稀硝酸的探究
学生对AgCl不溶于稀硝酸没有异议,争论点在于Ag2SO4是否溶于稀硝酸。
[理论分析]
假设Ag2SO4溶于硝酸溶液,则存在如下溶解平衡:
Ag2SO4(s)+H+(aq)2Ag+(aq)+HSO-4(aq)
以上計算说明Ag2SO4在硝酸溶液中存在溶解平衡,对比25℃时Ag2SO4的酸溶平衡常数K和水溶平衡常数Ksp,发现Ag2SO4在硝酸溶液中的溶解度比在水中大,且改变硝酸溶液的浓度会导致Ag2SO4的酸溶平衡移动。由此可预测:Ag2SO4是否溶解与硝酸溶液的浓度有很大关系。
若向Na2SO4溶液中滴加AgNO3溶液,生成Ag2SO4沉淀的量有0.1mmol,可通过计算粗略估计用于溶解Ag2SO4的硝酸浓度。假设用1mL某浓度的硝酸溶液溶解0.1mmol Ag2SO4,达到平衡后溶液中的c(H+)为xmol·L-1,则有:
[实验验证]
实验三:向五只试管中分别加入0.5mL 0.5mol·L-1的AgNO3溶液和0.5mL 0.5mol·L-1的Na2SO4溶液,形成Ag2SO4悬浊液。向五只试管中分别加入0.25mL不同浓度的硝酸溶液(浓度分别为7.2mol·L-1、 3.6mol·L-1、 1.8mol·L-1、 0.9mol·L-1、0即蒸馏水),观察Ag2SO4悬浊液溶解情况。
实验现象:当加入的硝酸溶液浓度较大(7.2mol·L-1、 3.6mol·L-1)时,Ag2SO4悬浊液变澄清,当加入的硝酸溶液浓度较小(1.8mol·L-1、 0.9mol·L-1、0即蒸馏水)时,Ag2SO4悬浊液无明显现象(见图6)。
[探究小结]
Ag2SO4是否溶于硝酸溶液与溶液的浓度大小有关,Ag2SO4溶于较浓的硝酸溶液,不溶于较稀的硝酸溶液。向可能含有AgCl或Ag2SO4的悬浊液中加入硝酸溶液,不能通过沉淀是否溶解来判断悬浊液的成分。
设计意图:从理论角度分析预测Ag2SO4是否溶于硝酸溶液,并进行实验验证,在探究中解决争议,形成一致意见,加深对“有干扰因素时物质定性检验的一般思路”中先除尽干扰因素后进行目标检验的理解和认同,为建构和完善“物质的定性检验认知模型”做铺垫。
3.4 基于探究完善模型
在以上探究过程的基础上,学生对检验Na2SO4和NaCl混合溶液中的Cl-的实验方案形成一致意见,即方案二比方案一更加科学严谨,并在无、有干扰因素时物质定性检验分析思路的基础上,建构、完善、认同如下“物质的定性检验认知模型”(见图7)。
设计意图:在无、有干扰因素时物质定性检验分析思路的基础上,建构、完善、认同“物质的定性检验认知模型”,培养提炼总结能力和模型建构能力。
3.5 应用模型解决问题
[情境问题1]实验室中有一瓶失去标签的棕黄色溶液,猜测可能是硫酸铁铵溶液,请设计实验方案进行验证。
[问题分析1]首先明确检验目标为溶液中的NH+4、 Fe3+、 SO2-4,且三者的检验互相无干扰,故形成如下检验方案:取少量溶液于试管中,加入足量的NaOH浓溶液并加热,将湿润的红色石蕊试纸置于试管口,若产生刺激性气味的气体且试纸变蓝,则溶液中含有NH+4;若产生红褐色沉淀,则含Fe3+;另取少量溶液于另一试管中,先滴加盐酸无现象,再加入BaCl2溶液,若产生白色沉淀,则溶液中含有SO2-4。
[情境问题2]丙烯醛CH2CH—CHO常温下为无色或浅黄色液体,设计实验方案,检验丙烯醛中的官能团。
[问题分析2]首先明确检验目标是碳碳双键和醛基。若用新制氢氧化铜悬浊液检验醛基,则碳碳双键不是干扰因素,故形成检验醛基的方案(实验一):取少量样品于试管中,滴加新制氢氧化铜悬浊液并煮沸,若有砖红色沉淀产生,则含有醛基;若用溴水或酸性高锰酸钾溶液检验碳碳双键,则醛基是干扰因素,需要将其排除后再检验,故形成检验碳碳双键的方案一:取实验一的上清液于另一试管,加入足量稀硝酸酸化,再滴加溴水,若看到颜色褪去,则含碳碳双键。若用溴的四氯化碳溶液检验碳碳双键,则醛基不是干扰因素,可形成检验碳碳双键的方案二:另取少量样品于另一试管中,滴加溴的四氯化碳溶液,若溶液褪色,则含有碳碳双键。
[情境问题3]已知氯气易溶于CCl4,按图8中的装置实验,试管③中有白色沉淀,能够证明含有HCl,说明理由。
[问题分析3]首先明确检验目标是Cl2与HCl混合气体中的HCl,装置中已经明确用硝酸银溶液检验HCl,分析发现Cl2会干扰HCl的检验,需要先将其除尽,对实验可做如下解释:试管①可吸收氯气,试管②可进一步吸收氯气,若证明氯气已被吸收完全,则氯气不会干扰对HCl的检验,因此试管③中出现的白色沉淀一定是由于HCl导致的,故该装置可以证明混合气中含有HCl。
[情境问题4]化合物X由三种元素组成,某实验小组按如下流程进行相关实验:
化合物X在空气中加热到800℃,不发生反应。
请设计实验,检验尾气中相对活泼的2种气体。
[问题分析4]通过定量计算分析,可以确定X的化学式为BaCu3O4,且X在加热条件下与NH3发生反应:
反应中氨气过量,故尾气的成分有氨气、水蒸气和氮气,需要检验的是氨气和水蒸气。运用物质的定性检验认知模型进行分析发现,水蒸气不会干扰氨气的检验,故检验氨气的实验方案为:将湿润的红色石蕊试纸置于尾气出口,若变蓝,说明尾气中有NH3;由情境信息可知,氨气与铜的化合物在高温下会发生氧化还原反应生成铜单质和氮气,即若用无水硫酸铜检验水蒸气,则氨气会干扰水蒸气的检验,在没有理想的除杂试剂时可以转变思路寻找新方法,如利用水蒸气和氨气沸点的差异来检验水蒸气,故检验水蒸气的实验方案为:将尾气通入冷的集气瓶中,若有液珠产生,说明尾气中有水蒸气。
设计意图:物质定性检验的常见对象有气体、溶液中的离子、有机物中的官能团等,以上述四则情境问题的解决为载体,发展与评估学生应用认知模型解决新问题的能力。其中后两则情境问题节选自高考原题,前者已确定检验目标和检验试剂,对认知模型中的“排除干扰”进行考查;后者考查学生在新情境中准确判断是否存在干扰因素的能力,启发学生灵活变通,在难以除杂时需要转变思路,重新寻找检验方法。
4 教学反思
本节专题复习,教师引导学生从无干扰因素的简单情境过渡到有干扰因素的复杂情境,在情境中形成物质定性检验的一般思路,在科学探究中建构、完善、认同物质定性检验的认知模型,并在新情境中应用认知模型解决实际问题。这种素养导向下的专题复习能让学生真正学会假设、学会认证、学会分析、学会建模、学会问题解决,切实体现模型认知的价值和意义。
认知模型具有高度的凝练性和广泛的迁移性,特别适合在专题复习中建构和应用。教师开展基于模型认知的高三化学专题复习教学设计,可从以下几个方面进行思考。
4.1 在情境中建构认知模型
复习课中的情境创设要与教学主题高度相关,可以是单一情境,也可以是复杂情境,教师可以依据学生的认知规律和心理特点,设计由简单到复杂的情境线,在情境线的发展过程中提炼方法线,引导学生自然地建构认知模型。
4.2 在探究中认同认知模型
诚然,课堂上初步建构的认知模型常常需要进一步修正,也可能存在一些争议。教师與其充当“裁判”,不如将对认知模型的修正和认同过程设计成科学探究活动,引导学生在探究活动开展过程中主动形成一致意见,自然地认同认知模型。需要注意的是,在探究过程中教师的有意引导和学生的自主探究所占比例需要达到“平衡”。
4.3 在应用中内化认知模型
认知模型的建构、修正和认同,其目的是帮助学生在新情境中高效地解决问题,并最终将认知模型内化为化学学科思维。学生灵活迁移认知模型解决问题的能力和水平,不仅反映了“素养为本”的专题复习的有效性,也体现了“素养为本”的专题复习的价值和意义。
化学的发展过程从某种程度上可以说是一个不断建立模型、应用模型和修正模型的过程。学生是高三化学专题复习的主体,也是模型建构与应用的主体。教师设计“素养为本”的高三化学专题复习时要基于学生已有的知识和体验,突出学生的主体性,引发学生开展探究活动,调动学生主动建构认知模型的积极性,激发学生应用并内化认知模型的意识。这是一个需要长期实践并深入研究的课题,值得一线教师钻研与探讨。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京: 人民教育出版社, 2020: 6.
[2][3]华丹彤, 王颖霞, 卞江, 陈景祖. 普通化学原理(第4版)[M]. 北京: 北京大学出版社, 2015: 472, 471.

