用N形管和三通阀改进铜与浓硫酸反应实验
周密 岑秋琳 安浪沙 王中华

摘要: 铜与浓硫酸反应的实验是高中化学比较重要的实验之一。针对现行教材中该反应实验装置的不足,在分析总结文献中已有的多项改进方案后,提出以N形管和三通阀联合使用的创新设计方案。改进后的实验方案具有实验装置小巧、反应可控、实验现象明显、无污染气体排出、能防倒吸等特点。
关键词: 铜和浓硫酸反应; 实验改进; 实验探究; N形管; 三通阀
文章编号: 10056629(2023)10007103 中图分类号: G633.8文献标识码: B
1 问题提出
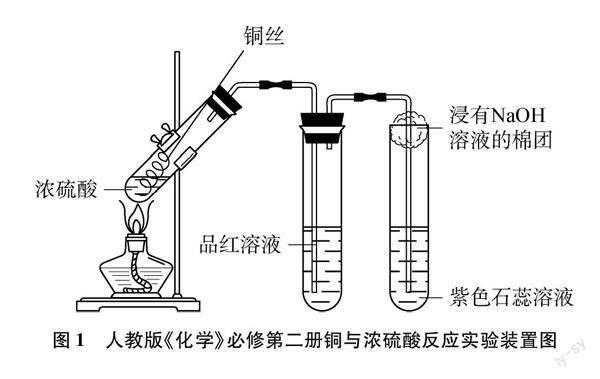
铜与浓硫酸反应的实验是学生理解浓硫酸的强氧化性与酸性以及二氧化硫的漂白性与酸性的重要实验。在现行的人教版《化学》必修第二册中,该实验是通过抽拉铜丝控制反应进行的,然后将产生的气体依次通入品红溶液和石蕊溶液中,以验证生成的二氧化硫的漂白性和酸性,并且在最后一个试管的管口塞了一个浸有氢氧化钠溶液的棉球,用以吸收多余的二氧化硫。在反应结束后,将试管内的物质倒入盛有少量蒸馏水的另一支试管中,以检测生成物硫酸铜。该实验装置如图1所示[1]。在此实验中,相比旧版教材,增加了用于吸收SO2尾气的氢氧化钠棉球,以及用于检验SO2酸性的紫色石蕊溶液。但该实验存在以下不足:(1)铜丝由橡胶塞侧面凹槽伸入试管中,向外拉动铜丝的时候,容易导致橡胶塞脱落,不易保证装置的气密性。(2)反应完成后,在拆除装置时,装置内残存的SO2会污染环境。(3)在冷却过程中,品红溶液易被倒吸进入反应试管。(4)冷却后将剩余物质倒入盛有少量水的试管里,溶液的蓝色并不明显。
2 相关文献简评
基于以上问题,不少研究者对该实验从不同的角度提出了改进,这里简单分析一下近期发表的三个改进实验。
张红卫[2]通过使用Y形管和环颈双球,再用针筒注水、双联打气球打气,以及盛有碱液双球漏斗,实现了对残留的SO2的完全吸收,也防止了倒吸。不足之处是:不能控制反应的进程,会有较多的黑色副产物生成,从而对实验现象产生了干扰,且没有对产物二氧化硫的酸性进行验证。
李文杰[3]的改进是:在装置反应部分添加了一个洗耳球,反应完后用洗耳球将装置内气体吹入双通管,使装置内残存的SO2被双通管中的含有氢氧化钠溶液的脱脂棉吸收;将98%的浓硫酸改为80%的浓硫酸进行实验,反应后更易呈现蓝色的现象;将品红溶液和石蕊溶液改为蘸有品红和石蕊的试纸,实现了微量化的改进;同时通过将铜丝插入胶头滴管内,可以更轻易地抽动铜丝,从而控制反应的进行。不足之处是:脱脂棉中含有的氢氧化钠溶液有限,无法将装置内的SO2吸收完全;将胶头滴管和导管插入橡皮塞中的操作较为繁琐,且不易保证装置的气密性。
巩永锐[4]的改进实现了对残留二氧化硫的吸收处理,能防倒吸,也能对反应速率进行控制。不足之处是:该实验装置较为庞大,在演示实验时需要较大的空间,且带平台的直角玻璃较为细长,存放十分不便。
3 改进方案
3.1 仪器与药品
仪器:N形管、三通阀、磁力搅拌子、磁环、10mL注射器(两个,其中一个带针头)、橡胶塞、胶头滴管、酒精灯、铁架台(带铁夹)、火柴
药品:浓硫酸(98%)、铜丝(长约15cm)、1mol/L氢氧化钠溶液、品红溶液、紫色石蕊溶液、蒸馏水
N形管:如图2所示。左右两侧都为长约16cm、内径约1.5cm的硬质玻璃试管,左侧试管离底部约1cm处与右侧试管离底部约10cm处通过口径较大的导管(内径约8mm)将两试管连通即可(可定制)。
三通阀:如图3所示。有三个出入口,旋转旋钮,利用阀门的切换可以实现液体在三个口的自由进出。
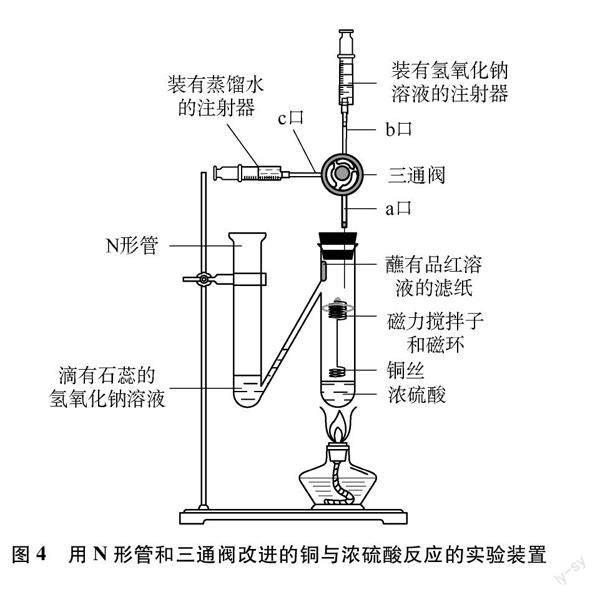
实验装置如图4所示。
3.2 实验步骤及现象
(1) 取约7mL 1mol/L的氢氧化钠溶液,向其中滴加几滴紫色石蕊溶液,溶液变蓝,得到含石蕊的氢氧化钠溶液。
(2) 选取一段长约15cm的铜丝,上端缠绕在磁力搅拌子上,下端折叠成螺旋状。
(3) 将三通阀一端接上注射器针头,插入橡胶塞中,在另外两端分别接上装有约4mL的蒸馏水和4mL 1mol/L的氢氧化钠溶液的注射器(三通阀连有注射器针头的一端为a口,装有氢氧化钠溶液的一端为b口,装有蒸馏水的一端为c口)。
(4) 将N形管固定在铁架台上,向N形管左侧试管(以下简称左侧试管)中加入第一步制得的含石蕊的氢氧化钠溶液,高度约3cm;N形管右侧试管(以下简称右侧试管)中加入约1.5mL的浓硫酸,然后将处理好的铜丝放入右侧试管中,并通过磁环将其与浓硫酸分离;随后将接有三通阀的橡皮塞塞在右侧试管管口。
(5) 检查装置气密性。方法为:点燃酒精灯,加热右侧试管中的浓硫酸,若N形管中间的导管处(以下简称导管)的液柱高度逐渐降低,降低至导管与左侧试管的接口处,使左侧试管产生气泡,则说明装置气密性良好。
(6) 继续加热浓硫酸至有少量白雾生成,然后将磁环向下移动,控制铜丝与浓硫酸接触,让铜丝与浓硫酸反应。现象:浓硫酸接触铜丝后剧烈反应,产生大量白雾,蘸有品红的滤纸逐渐褪色,即验证了二氧化硫的漂白性;并且左侧试管继续产生气泡。
(7) 待反应约50秒后,左侧试管中含石蕊的氢氧化钠溶液由蓝色变为红色,即验证了二氧化硫的酸性。此时熄灭酒精灯,将磁环向上移动,终止反应。然后再静置冷却半分钟左右,旋转三通阀的旋钮,使a、 c口相通,向其中缓慢注入约4mL蒸馏水。现象:静置后,右侧试管底部有灰白色沉淀生成,溶液为浅墨蓝色;加入蒸馏水后,底部灰白色沉淀溶解,溶液呈现浅墨蓝色,蓝色较浅,并且其中漂浮着黑色小颗粒固体。
(8) 再次旋转三通阀旋钮,使a、 b口相通,向其中缓慢注入4mL 1mol/L的氢氧化钠溶液。现象:液体分层,上層溶液为无色,中间层出现明显的蓝色絮状沉淀,下层仍为浅墨色溶液。
3.3 改进实验的优点
(1) 改进实验整个装置全程密封,不会存在二氧化硫逸出的情况,且装置内残留的二氧化硫也会被完全吸收。
(2) 实验现象明显,便于学生观察,从加热到反应结束整个过程均有实验现象发生,能吸引学生的注意力,引发学生的兴趣。
(3) 反应进程可控。在反应过程中,利用磁力搅拌子与磁环的吸引力来控制铜丝上下移动,从而实现控制反应进程的目的。
(4) 倒吸可防。在左侧试管内,含石蕊的氢氧化钠溶液的量仅仅超过了接口1.5cm左右,N形管的结构保证其维持一个动态平衡,因此左侧试管内的氢氧化钠溶液不会出现倒吸现象而进入右侧试管中。
(5) 此实验不仅可以通过观察铜离子的蓝色来证明生成硫酸铜,并且新增了通过利用生成氢氧化铜的方式对铜离子进行检验。氢氧化铜沉淀的蓝色比溶液的蓝色更明显,即使溶液中的铜离子浓度较低,只要生成了氢氧化铜,蓝色就很明显,更易于学生观察。
4 几点说明
(1) 实验时应先将浓硫酸预热至有少量白雾后再将铜丝与其接触反应,可有效减少副反应的发生[5]。
(2) 三通阀内的蒸馏水滴加的速度不宜过快,若过快会导致右侧试管溶液上端的铜离子较少,滴加氢氧化钠后生成的氢氧化铜就较少,现象没那么明显。此时,可通过磁环用铜丝将溶液搅拌一下,使溶液中的铜离子分布均匀,然后再滴加氢氧化钠溶液。
(3) 向右侧试管中滴加氢氧化钠溶液分层的原因是试管口径较小,溶液不易扩散,先滴加的氢氧化钠与原试管上层溶液中的铜离子反应生成蓝色的氢氧化铜絮状沉淀,该絮状沉淀阻隔氢氧化钠与下层溶液继续反应,从而出现分层现象。
(4) 铜丝预先要用砂纸打磨,所用的水以及配制溶液的水均要使用蒸馏水。因为铜丝表面通常会有一层聚氯乙烯,在反应过程中会生成氯离子,且自来水中含有氯离子,若溶液中氯离子浓度过高,会生成黄色的[CuCl4]2-,与水合铜离子的蓝色混合,从而使溶液呈现绿色[6],在滴加氢氧化钠溶液后,对蓝色沉淀的观察会造成一定的干扰影响。
参考文献:
[1]王晶, 郑长龙主编. 普通高中化学教科书·化学必修第二册[M]. 北京: 人民教育出版社, 2019: 5.
[2]张红卫. 浓硫酸与铜反应实验的改进[J]. 化学教学, 2020, (1): 67~69.
[3]李文杰. 浓硫酸与铜反应实验的改進[J]. 化学教学, 2019, (7): 63~65.
[4]巩永锐, 李忠恒, 周丽梅等. 铜与浓硫酸反应实验装置的一体化新设计[J]. 化学教学, 2022, (6): 68~71.
[5]王继璋. 温度对铜和浓硫酸反应的影响探究[J]. 化学教育, 2013, 34(9): 64,68.
[6]夏立先. 对铜与浓硫酸反应溶液呈绿色的实验探究[J]. 化学教学, 2015,(7): 64~65.

