一株海洋假单胞菌降解有机卤代物特性及酶学性质*
王亚月 向 巧 李佳瑞 郭 晴 裴冬丽#
(1.商丘师范学院生物与食品学院,河南 商丘 476000;2.河南师范大学生命科学学院,河南 新乡 453007)
有机卤代物因其优良的导热性、耐热性、绝缘性、亲脂性和生物活性[1-2],在合成去油剂、杀虫剂、有机溶剂、灭火剂以及多聚化合物等方面发挥重要作用,被广泛应用于工、农、医等生产领域[3-5]。随着有机卤代物的大量生产和广泛使用,该类物质逐渐在湖泊、饮用水、地下水、海水和土壤等环境中积累,致使生态环境恶化[6-8]。此外,有机卤代物可以通过食物链在生态系统中不断地迁移、转化、富集,导致生物体基因突变、畸形、癌症,极大地威胁人类健康[9-11]。因此,如何实现有机卤代物的有效降解是当前亟待解决的问题。
近年来,微生物降解法由于具有降解效率高、降解底物广谱、菌株适应性强的特点,已成为去除环境中多种污染物的有效方法之一,而生长在被有机卤代物污染环境中的微生物通常具有转化这些化合物的潜在能力[12-13]。目前已有不少关于有机卤代物降解菌菌种资源的报道,但是,大多数脱卤微生物分离自陆生环境,降解效率不高且催化底物谱范围较窄,应用时受到限制[14]10。不同分离环境的差异,可对微生物法处理有机卤代物的工艺及处理效果产生影响。因此,尝试从其他环境分离可降解有机卤代物的微生物菌株,拓展降解有机卤代物的微生物分离范围,并提高有机卤代物降解效率及拓宽其催化底物谱很有必要。海洋环境由于其压强高、含盐量高、营养成分少、温度低等特点,使得生活在其中的微生物生理生化特征、代谢途径与陆生微生物有所差异,是发现新型酶的重要资源库[15]。目前已报道的有机卤代物降解菌仅有少数来自于海洋环境,包括红杆菌属(Rhodobactersp.)、假单胞菌属(Pseudomonassp.)、副球菌属(Paracoccussp.)、冷单胞菌属(Psychromonassp.)、芽孢杆菌属(Bacillussp.)、微杆菌属(Microbacteriumsp.)、氨基杆菌属(Aminobactersp.)与赖氨酸芽孢杆菌属(Lysinibacillussp.)中的一些菌株[16],[17]1791,[18]91,[19-21]。
本研究以前期从大连海域繁茂膜海绵中筛选出的一株能够降解2-氯丙酸(2-CPA)的菌株56为试验对象,根据其形态、生理生化特征及16S rRNA序列分析鉴定其种属,并考察了其在15种不同有机卤代物作为唯一碳源条件下的生长情况以及对15种有机卤代物降解能力,进一步表征了菌株56胞内脱卤酶催化特性,包括脱卤酶催化D-2-氯丙酸(D-2-CPA)与L-2-氯丙酸(L-2-CPA)脱氯的最适温度和温度耐受性、最适pH和pH耐受性及底物谱等,为该菌用于有机卤代物污染环境的生物修复及手性中间体的绿色合成提供理论基础。
1 材料与方法
1.1 材 料
1.1.1 菌 株
菌株56在-80 ℃下保存于20%(质量分数)的甘油中。
1.1.2 主要试剂
单氯乙酸(MCA,纯度>99.0%)、单溴乙酸(MBA,纯度>99.0%)、单碘乙酸(MIA,纯度>99.0%)、二氯乙酸(DCA,纯度>97.0%)、2-氟丙酸(2-FPA,纯度>95.0%)、2-CPA(纯度>98.0%)、L-2-CPA(纯度>98.0%)、D-2-CPA(纯度>98.0%)、2-溴丙酸(2-BPA,纯度>99.0%)、2-溴-2-甲基丙酸(2-BMPA,纯度>98.0%)、2-氯丁酸(2-CBA,纯度>97.0%)、2-溴丁酸(2-BBA,纯度>99.0%)、氯乙酰胺(CAA,纯度>98.0%)等均采购自英国Alfa Aesar;2,2-二氯丙酸(2,2-DCPA,纯度>95.0%)、2-溴丙酰胺(2-BPAD,纯度>99.0%)采购自美国Sigma Aldrich;3-氯丙酸(3-CPA,纯度>98.0%)采购自日本TCI;2-氯丙酰胺(2-CPAD,纯度>98.0%)采购自德国Acros;其他试剂均为国产分析纯。
1.1.3 主要仪器
高压蒸汽灭菌锅(Panasonic MLS-3781L-PC);恒温培养箱(Thermo Scientific Index-1);恒温振荡培养箱(Thermo Scientific MAXQ4000);聚合酶链式反应(PCR)仪(ABI-2720);紫外可见分光光度计(MAPADA S1020);精密pH仪(Mettler Toledo S220);高效液相色谱(HPLC)仪(Agilent Technologies 1260)。
1.1.4 培养基
LB液体培养基:胰蛋白胨10 g,酵母浸粉5.0 g,NaCl 10 g,调pH为7.2,去离子水定容至1 000 mL,121 ℃灭菌20 min。
无机盐基础(MM)培养基:NaCl 30 g,Na2HPO4·12H2O 12 g,(NH4)2SO42 g,NaH2PO4·2H2O 1 g,MgSO4·7H2O 0.1 g,酵母浸粉0.1 g,10倍微量元素母液10 mL,调pH为7.2,去离子水定容至1 000 mL,121 ℃灭菌20 min。固体MM培养基是在每升MM培养基基础上加入18 g琼脂。
10倍微量元素母液:CaCl2530 mg,FeSO4·7H2O 200 mg,CuSO4·5H2O 40 mg,MnSO4·5H2O 20 mg,ZnSO4·7H2O 20 mg,CoCl24 mg,NaMoO4·2H2O 4 mg,H3BO33 mg,浓H2SO41 mL,加去离子水定容至1 000 mL。
卤代物培养基:1 L MM培养基中加入终摩尔浓度为10 mmol/L的有机卤代物。氯丙酸固体培养基则是在1 L 固体MM培养基中加入终摩尔浓度为10 mmol/L的2-CPA。
1.2 方 法
1.2.1 菌株56的生理生化特征
显微镜观察分离纯化后的菌株56形态特征,参照文献[22]和文献[23]对菌株56进行生理生化特征鉴定。
1.2.2 菌株56的分子鉴定
对分离纯化后的菌株56进行脱氧核糖核酸(DNA)提取。使用细菌通用引物27F和1492R扩增其16S rRNA基因。PCR反应体系(50 μL):模板10 μL,引物(10 μmol/L)各1 μL,酶与4种核苷酸混合物25 μL和双蒸水13 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,循环30次;72 ℃延伸10 min,4 ℃保存。经质量分数为1%的琼脂糖凝胶电泳检测后,扩增产物送至天津金唯智生物科技有限公司测定基因序列,序列结果经BLAST比对分析,通过MEGA version 6.0软件对菌株56构建系统发育树[24]。
1.2.3 菌株56的有机溶剂耐受性
取保存于甘油中的菌株56接入LB液体培养基,37 ℃过夜培养即为种子液。取1 mL种子液分别接入100 mL含有有机溶剂(甲醇、乙醇、丙酮、乙腈)的LB液体培养基中,每种有机溶剂体积分数分别为1%、2%、3%、5%、8%,37 ℃培养2 d,每个处理3个重复,分别将不接入种子液的处理与接入种子液不加有机溶剂的处理作为阴性对照组与阳性对照组。有机溶剂处理组培养液和阳性对照组一样明显变浑浊的认为可以耐受,若与阴性对照组一样澄清则认为不可以耐受。
1.2.4 菌株56对不同有机卤代物的降解能力
分别在100 mL MM培养基中添加终摩尔浓度为10 mmol/L的MCA、MBA、MIA、2-FPA、2-CPA、2-BPA、2-BMPA、3-CPA、2-CBA、2-BBA、DCA、2,2-DCPA、CAA、2-CPAD和2-BPAD作为唯一碳源,1∶100(体积比)接种,30 ℃、220 r/min下培养,每个处理3个重复,以100 mL不接种种子液的MM培养基作为相应的空白对照,间隔24 h取样,取样至168 h时,分别在未降解完全的卤代物培养基中加入终摩尔浓度为10 mmol/L的葡萄糖溶液,并继续取样至240 h。分光光度计测600 nm处吸光度值(OD600),监测菌株生长情况。同时取上述培养液12 000 r/min离心10 min后取上清液备用,运用HPLC仪检测其中有机卤代物含量。
检测色谱柱:C546250-U Cloversil C18(5 μm,4.6 mm×250 mm);紫外检测器,检测波长210 nm;流动相A为乙腈,流动相B为0.015 mol/L H3PO4-KH2PO4缓冲液(pH 2.2),流速1 mL/min;柱温30 ℃,检测体积10 μL。CAA检测流动相A、B以5∶95(体积比)等度洗脱,2,2-DCPA检测流动相A、B以10∶90等度洗脱,其余有机卤代物检测流动相A、B均以15∶85等度洗脱。
1.2.5 菌株56粗酶液制备
在MM培养基中,添加终摩尔浓度为20 mmol/L 的2-CPA作为唯一碳源培养菌株56,待培养至对数生长期后期时,4 ℃、8 000 r/min下,离心10 min收集菌体。沉淀用50 mmol/L KH2PO4-K2HPO4缓冲液(pH 7.5)洗涤3次后,置于-80 ℃保存备用。取菌体,每克菌体用20 mL上述缓冲液重悬。冰浴中超声破碎菌体,超声条件:200 W工作2 s,间隙2 s,200个循环,4 ℃、12 000 r/min下,离心30 min,上清液即为粗酶液(下文简称酶液)。
1.2.6 脱卤酶活性检测
脱卤酶活性检测反应体系为1.0 mL,包括100 μL 100 mmol/L有机卤代物,500 μL 0.2 mol/L甘氨酸-氢氧化钠缓冲溶液(pH 10.0)与400 μL酶液。30 ℃反应1 h,10 μL H3PO4(质量分数85%)终止反应。12 000 r/min下,离心10 min去除沉淀,取上清液,HPLC仪检测有机卤代物含量。定义每分钟催化转化1 μmol 底物所需要的酶量为1个活力单位(U)[18]92。
1.2.7 脱卤酶的底物谱检测
同1.2.6节中方法,检测底物包括MCA、MBA、MIA、2-FPA、2-CPA、2-BPA、2-BMPA、3-CPA、2-CBA、2-BBA、DCA、2,2-DCPA、CAA、2-CPAD和2-BPAD,终摩尔浓度为10 mmol/L,30 ℃反应30 min,检测有机卤代物含量,定义底物为2-CPA时的酶活性为100%,计算酶对其他有机卤代物的相对活性。
1.2.8 最适反应温度及其热稳定性检测
分别以L-2-CPA与D-2-CPA作为底物,测定酶液在0、20、30、40、50、60 ℃反应条件下的酶活性,确定其中脱卤酶最适反应温度。将酶液在上述不同温度下孵育30 min,检测剩余酶活性,确定其热稳定性。以所测最高酶活性为100%,计算酶在其他温度下的相对活性。
1.2.9 最适反应pH及pH稳定性检测
检测pH范围为4.0~12.0,pH 4.0~7.5用200 mmol/L K2HPO4-KH2PO4缓冲液,pH 8.0~9.5用200 mmol/L Tris-硫酸盐缓冲液,pH 10.0~12.0用100 mmol/L Glycine-NaOH缓冲液,分别以L-2-CPA与D-2-CPA作为底物,测定酶在不同pH缓冲液中的酶活力,以确定两个对映体底物最适脱卤pH。将酶液在上述缓冲液中以1∶10体积比稀释,4 ℃放置1 d,检测酶残留活性,确定其pH耐受性。以所测最高酶活为100%,计算酶在其他pH条件下的相对活性。
2 结果与讨论
2.1 菌株56的鉴定
2.1.1 形态特征
如图1所示,菌株56在氯丙酸固体培养基上形成扁平、大小不一、表面光滑湿润、呈黄褐色的圆形菌落,显微镜下观察呈短杆状,不产芽孢。
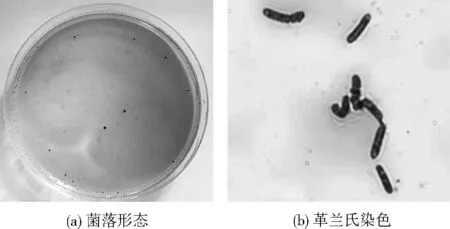
图1 菌株56菌落形态与革兰氏染色观察Fig.1 The colony morphology observation and Gram staining observation of strain 56
2.1.2 生理生化特征
由表1可见,菌株56为革兰氏阴性菌,甲基红、V-P试验、H2S试验呈阴性,不能水解淀粉和色氨酸,能够水解精氨酸、尿素,明胶液化、过氧化氢酶、氧化酶呈阳性,还原硝酸盐,可以利用葡萄糖、木糖、甲酸钠、乙酸钠、丙二酸钠、肌醇与硫氰酸钠,不能利用蔗糖、乳糖、半乳糖与柠檬酸钠。根据文献[23]进行比对,并结合菌株56菌落形态与显微形态,初步确定菌株56为假单胞菌属。
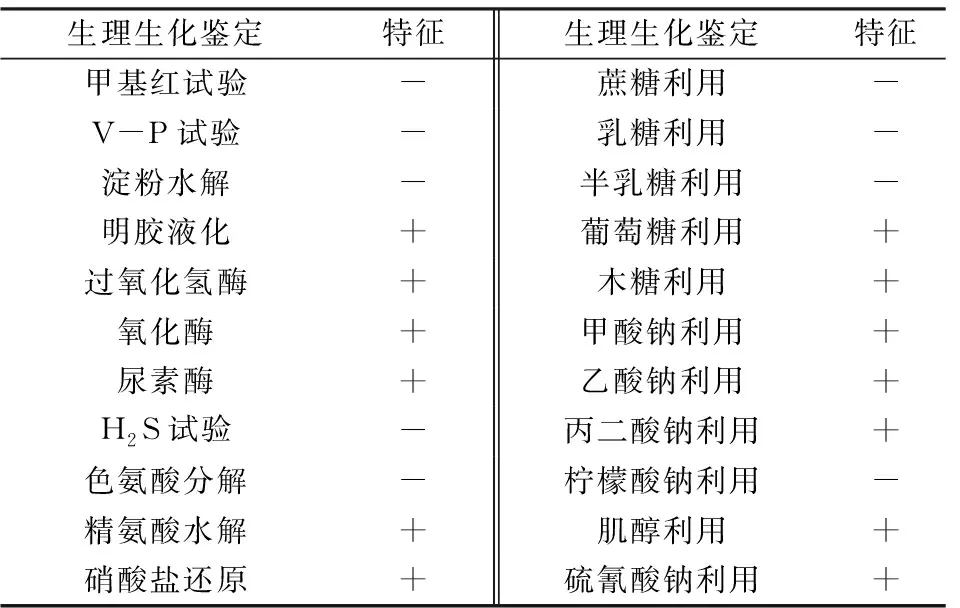
表1 菌株56的主要生理生化特征1)Table 1 Physiological and biochemical characteristics of strain 56
2.1.3 分子鉴定
所测16S rRNA基因序列经BLAST比对,下载相关同源序列,借助MEGA软件以邻位法构建系统发育树。如图2所示,对菌株56进行系统发育分析,该菌株与PseudomonaskunmingensisYL-233同聚一枝,且同源性为100%,结合其生理生化特征,进一步确定菌株56为昆明假单胞菌(Pseudomonaskunmingensis),菌株56的16S rRNA基因序列已上传至GenBank,登录号为ON306908。
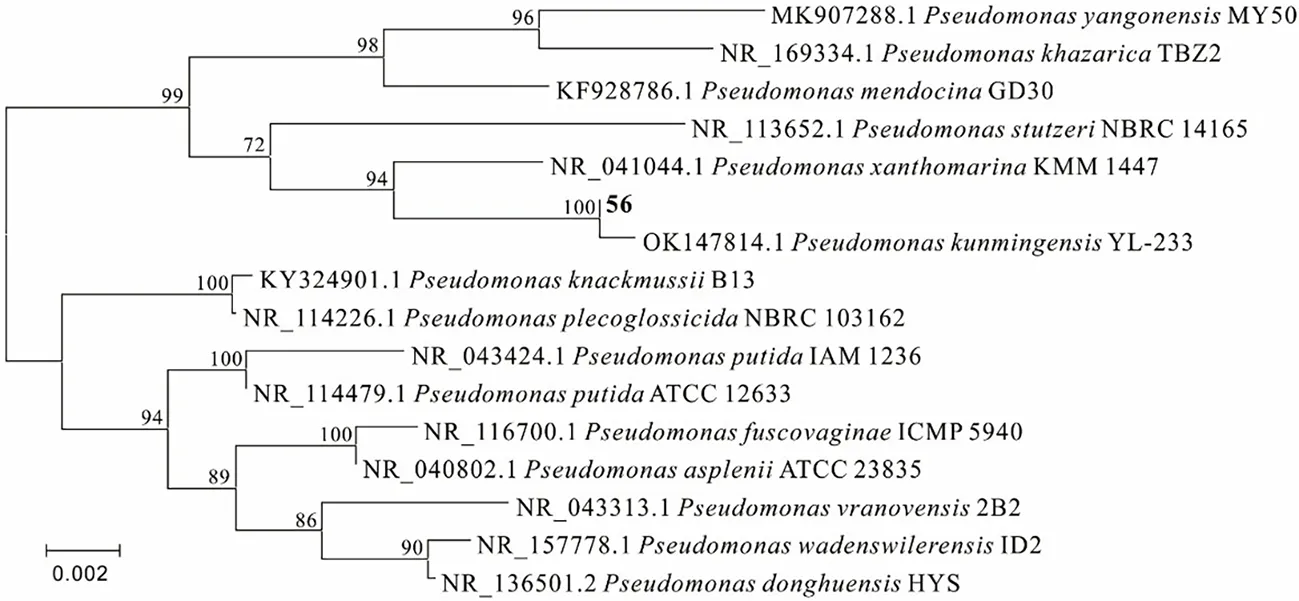
注:以软件中的Kimura-Parameter Distance模型计算进化距离,1 000次随机抽样,计算Bootstrape以评估系统发育树的置信度。图2 菌株56的系统发育树Fig.2 Phylogenetic tree of strain 56
2.2 菌株56有机溶剂耐受能力
对有机溶剂具有耐受能力的菌株在全细胞催化转化、工业酶制剂开发与环境污染物的生物降解等领域具有重大应用价值。对于脱卤微生物,由于其降解底物较差的水溶性,则更要求菌株具有一定的有机溶剂耐受能力[14]10。如表2所示,菌株56可以耐受1%~5%的甲醇、乙醇、丙酮和乙腈及8%的乙醇,然而不能耐受8%的甲醇、丙酮和乙腈。综上,菌株56对乙醇有良好的耐受能力,对低浓度甲醇、丙酮与乙腈也表现出耐受,具有开发应用潜力。
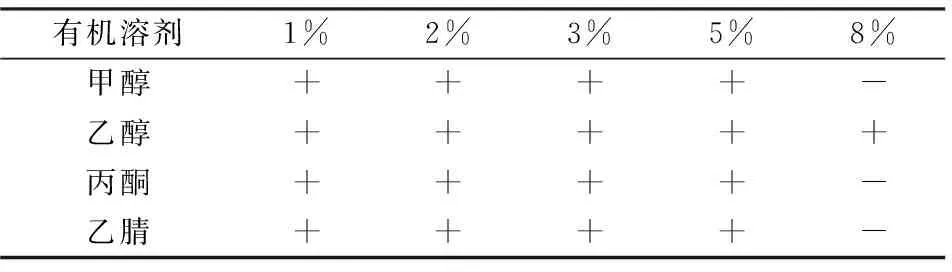
表2 菌株56对不同有机溶剂的耐受能力1)Table 2 The tolerance of strain 56 against organic solvent
2.3 菌株56降解有机卤代物特性
由于不同有机卤代物的结构、毒性、降解难易程度及在环境中的丰度等性质的差异,不同生境分离出的菌株亦表现出不同的利用特性。如图3所示,菌株56可以利用卤代乙酸(MCA、MBA、MIA)、卤代丙酸(2-CPA、2-BPA、2-BMPA、3-CPA)、卤代丁酸(2-CBA、2-BBA)、二卤代酸(DCA、2,2-DCPA)和卤代酰胺(CAA、2-CPAD、2-BPAD)作为唯一碳源进行生长,但不能利用卤代丙酸中的2-FPA。菌株以MBA、2-BPA、2-BMPA、DCA为唯一碳源时生长较快,其中在2-BMPA培养基中生长最快,OD600最大为0.807,其次依次为2-BPA、MBA、DCA,OD600最大值分别为0.555、0.310、0.308;以MCA、MIA、2-CPA、3-CPA、2-CBA、2-BBA、2,2-DCPA、CAA、2-CPAD、2-BPAD作为唯一碳源时生长较慢,120 h时OD600最大值仅0.209(2-CPA为唯一碳源),168 h加入辅助碳源葡萄糖后菌株迅速生长,240 h时OD600最大值可达1.742(2-BBA)。综上,15种有机卤代物中,仅2-FPA不能作为菌株56的碳源,剩余14种有机卤代物均可作为碳源,其中2-BMPA、2-BPA、 MBA和DCA为较易利用的碳源。

注:箭头表示添加葡萄糖。图3 菌株56的生长曲线及有机卤代物的降解曲线Fig.3 The growth curve of strain 56 and the degradation curve of organic halogenated compounds
相应地,菌株56对MBA、DCA、2-BPA、2-BMPA的降解速度也较快,分别在72、72、96、120 h内降解完全;对MCA、MIA、2-CPA、3-CPA、2-CBA、2-BBA、2,2-DCPA、CAA、2-CPAD与2-BPAD的降解较慢,168 h时降解率分别为48.2%、71.4%、82.3%、27.1%、34.2%、46.7%、20.4%、9.8%、6.6%、15.9%,加入葡萄糖后这些有机卤代物继续降解,216 h时2-CPA已全部降解,240 h时MCA、MIA、3-CPA、2-CBA、2-BBA、2,2-DCPA、CAA、2-CPAD和2-BPAD降解率分别可达70.7%、89.4%、45.6%、55.5%、69.2%、35.0%、20.1%、10.4%和26.2%。综上可知,以有机卤代物作为唯一碳源时,菌株56对有机卤代物的降解能力大小依次为MBA>DCA>2-BPA>2-BMPA>2-CPA>MIA>MCA>2-BBA>2-CBA>3-CPA>2,2-DCPA>2-BPAD>CAA>2-CPAD。
氯代、溴代丙酸的低毒性及其在自然界中高丰度特性,使得其容易被大多数菌株降解,而氟代酸较高的毒性及其C—F键的高稳定性使得其不易被降解[18]94,菌株56亦表现出此特性。菌株56不仅能降解MCA,而且对DCA表现出更高降解能力,与已报道菌株相比,表现出高效降解能力,如Arthrobactersp. strain D2、Pseudomonas sp. strain CBS3和BurkholderiacepacianMBA4能降解MCA,但对DCA几乎没有降解能力;Burkholderiasp. strain CL-1能高效利用MCA,但对DCA降解率较菌株56 低了约10%[25-27]。2,2-DCPA与3-CPA作为比较难降解的卤代酸,已报道的能够同时降解这两种有机卤代物的菌株也甚少,如AgrobacteriumtumefaciensRS4、XanthomonasmaltophiliaRS6、ComamonasacidovoransRS7、AchromobacterxylosoxidansRS9、Rhizobiumsp. RC1和Pseudomonasalcaligenes能降解2,2-DCPA,却不能降解3-CPA[28-30];BacilluscereusWH2、Bacillussp. CGMCC no. 4196、RhodococcusrhodochrousNCIMB13064虽然能降解3-CPA,却不能降解2,2-DCPA[31-33]。然而,菌株56不仅可以同时降解2,2-DCPA与3-CPA,还能降解卤代酰胺类化合物,极大地扩展了假单胞菌属菌株在治理有机卤代物污染环境中的应用。
2.4 菌株56中脱卤酶性质表征
2.4.1 底物谱
目前已报道的卤代酸脱卤酶多偏好于碳链小于3个碳原子的氯代与溴代的2-卤代酸,不能催化氟代与C3位置取代的卤代酸脱卤反应[14]3。然而,菌株56中脱卤酶却表现出优良的脱卤性能,可催化MCA、MBA、MIA、2-CPA、2-BPA、2-BMPA、3-CPA、2-CBA、2-BBA、DCA、2,2-DCPA、CAA、2-CPAD和2-BPAD的脱卤,不能作用于2-FPA,其中对2-CPA脱卤酶活性最高(见图4)。对于2-有机卤代物,酶活性依次为2-卤代丙酸>2-卤代丁酸>2-卤代酰胺,如对2-CPA的酶活性分别是2-CBA、2-CPAD的66.8、138.4倍,对2-BPA的酶活性分别是2-BBA、2-BPAD的16.0、81.9倍;对单卤代酸的酶活性高于二卤代酸,如对MCA的酶活性是DCA的1.7倍;对于不同卤素的有机卤代物,其酶活性为MCA

图4 菌株56卤代酸脱卤酶底物谱Fig.4 Substrate profile of haloacid dehalogenase from strain 56
2.4.2 最适反应温度及其热稳定性
如图5(a)所示,菌株56中卤代酸脱卤酶催化L-2-CPA和D-2-CPA脱氯的最适反应温度均为40 ℃,与PseudomonasstutzeriDEH130中脱卤酶相同[17]1794。0~30 ℃时,随着温度的升高,酶活性逐渐上升,30~40 ℃时,脱卤酶活性急剧上升,来源于Paracoccussp. DEH99[18]94、Pseudomonassp. DEH138A[34]140和Pseudomonasputidastrain AJ1/23[35]883中的酶也表现出相似特性。40~60 ℃时,随着温度的升高,酶活性逐渐降低。如图5(b) 所示,当酶液在0~40 ℃条件下孵育30 min时,酶相对稳定,酶活性可保留80%以上;随着温度的继续升高,酶稳定性降低,60 ℃时,对D-2-CPA、L-2-CPA的酶活性分别保留52.5%、24.6%。可见菌株56产生的卤代酸脱卤酶具有一定程度的热稳定性。
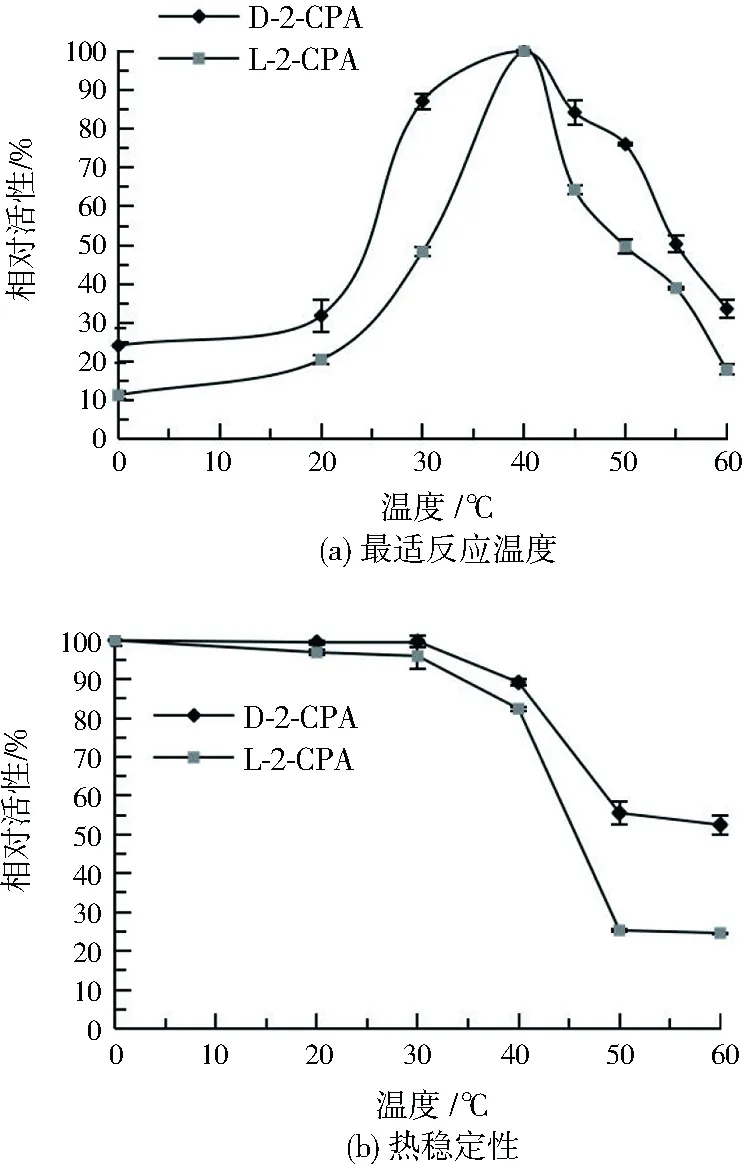
图5 温度对卤代酸脱卤酶反应活性的影响Fig.5 Effect of temperature on haloacid dehalogenase activity
2.4.3 最适反应pH及pH稳定性
卤代酸脱卤酶最适反应pH多偏碱性,如Pseudomonasputidastrain AJ1/23[35]883和PseudomonasstutzeriDEH130[17]1796中的脱卤酶在pH 9.5条件下酶活性最高,Pseudomonassp. DEH138A[34]140的最适pH为9.0,Paracoccussp. DEH99[18]93的最适反应pH为10.0。如图6(a)所示,菌株56中脱卤酶催化D-2-CPA和L-2-CPA脱氯的最适反应pH均为9.0;在碱性条件下(pH 8.0~10.0)具有较高的反应活性,pH<8.0和pH>10.0反应活性降低;过酸和过碱环境会导致酶丧失反应活性,pH为4.0和12.0时,酶催化D-2-CPA与L-2-CPA脱氯的酶活性均低于40%。如图6(b) 所示,在pH 4.0~12.0条件下孵育24 h后,酶在pH 7.0的环境中最稳定;缓冲液pH为5.0~9.0时,酶可保留高于70%的酶活性;当pH<5.0和pH>9.0时,酶活性逐渐降低,pH为4.0时,酶催化D-2-CPA与L-2-CPA脱氯酶活性分别保留89.1%与57.0%,而pH为12.0时,脱氯活性分别保留34.3%与5.6%,可见菌株56中卤代酸脱卤酶具有一定的耐酸性。
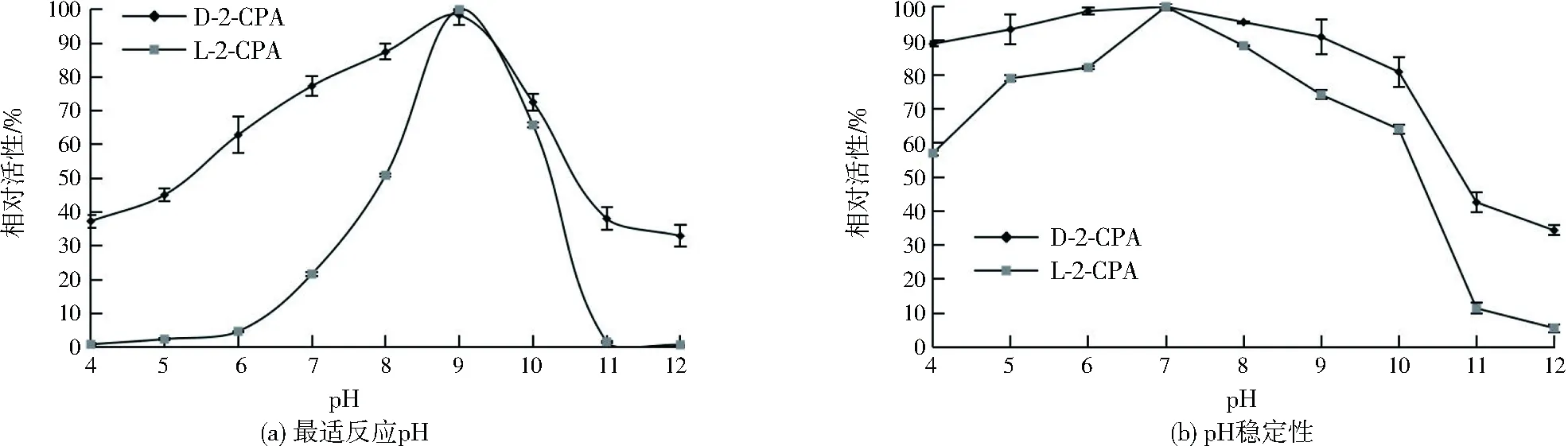
图6 pH对卤代酸脱卤酶反应活性的影响Fig.6 Effect of pH on haloacid dehalogenase activity
综上,根据菌株56中卤代酸脱卤酶在不同温度和pH条件下对两种手性氯丙酸的降解情况,推测该菌株中脱卤酶的组成可能有3种情况:一是细胞中有两种脱卤酶,分别为 D-2-卤代酸脱卤酶、L-2-卤代酸脱卤酶,它们在微生物细胞内共同起作用,并且具有相同的最适反应温度和pH;二是菌株细胞中只存在一种脱卤酶,即DL-2-卤代酸脱卤酶;三是存在D-2-卤代酸脱卤酶和/或L-2-卤代酸脱卤酶以及DL-2-卤代酸脱卤酶。然而,这需要进一步对其中卤代酸脱卤酶进行分离纯化。
3 结 论
(1) 从大连海域繁茂膜海绵中分离获得2-CPA降解菌株,经生理生化表征与16S rRNA序列分析鉴定为昆明假单胞菌(Pseudomonaskunmingensis),该菌株对有机溶剂甲醇、乙醇、丙酮和乙腈表现出一定的耐受性。
(2) 菌株56可利用MCA、MBA、MIA、2-CPA、2-BPA、2-BMPA、3-CPA、2-CBA、2-BBA、DCA、2,2-DCPA、CAA、2-CPAD与2-BPAD作为唯一碳源进行生长,不能利用2-FPA。
(3) 菌株56中脱卤酶可催化MCA、MBA、MIA、2-CPA、2-BPA、2-BMPA、3-CPA、2-CBA、2-BBA、DCA、2,2-DCPA、CAA、2-CPAD与2-BPAD的脱卤,其中对2-CPA与2-BPA具有较高酶活性,不能作用于2-FPA;其最适反应温度为40 ℃,在低于40 ℃的环境中,有良好的热稳定性,随着温度的升高,酶活性降低;最适反应pH为9.0,在pH 5.0~9.0能够较好保持活性。
(4) 菌株56不仅具有有机溶剂耐受性及降解多种有机卤代物的能力,且其产生的脱卤酶也具有较宽的底物谱、一定程度的热稳定性及良好的耐酸性,在有机卤代物的生物降解中具有工业应用潜力。

