膨胀石墨负载铁氰化铜吸附Cs+特性研究
刘霂宇 邱杨率,2# 张凌燕,2
(1.武汉理工大学资源与环境工程学院,湖北 武汉 430070;2.矿物资源加工与环境湖北省重点实验室,湖北 武汉 430070)
在核能技术日益兴盛的今天,核污染的危机也在日益增加。日本福岛核电站事故中含Cs+的放射性废水排放事件,敲响了应对核污染问题的警钟[1-3]。Cs是核废料中最主要的放射性源之一,易引发多种疾病。因此,制备能够高效去除Cs+的材料,对人体健康和环境安全具有重要意义[4-5]。YU等[6]使用经过浓硫酸交联的新鲜茶叶和二手茶叶作为吸附材料,测试其对Cs+的吸附效果,两种交联茶叶对Cs+的吸附量均在2.5 mmol/g左右。
铁氰化铜(CuHCF)具有优异的化学稳定性和对Cs+较强的选择性,成为处理含放射性Cs+废水的常用吸附剂之一[7-8]。ZHENG等[9]制备多壁碳纳米管负载CuHCF复合材料,去除废水中Cs+,吸附100次后,吸附容量仍能保持在原来的85%。但CuHCF在实验过程中存在颗粒较小,后续的收集工作较困难的缺点。
为了弥补CuHCF在实验过程中存在的缺点,本研究拟构建膨胀石墨作为CuHCF的载体材料。膨胀石墨也被称为石墨蠕虫或柔性石墨,由天然鳞片石墨氧化插层后高温膨胀得到,是一种拥有独特孔隙结构的碳素材料,拥有出色的润滑性及导热性能,耐高温、耐腐蚀、吸附性强,具有比表面积大、价格低等优势[10-11]。
目前国内外利用膨胀石墨负载CuHCF进行吸附的研究较少,因此,制备膨胀石墨负载CuHCF复合材料(EG-CuHCF)并分析其吸附性能,有利于膨胀石墨类复合材料进一步发展。本研究制备了EG-CuHCF,阐明EG-CuHCF对Cs+的吸附机理,为材料实际应用提供参考。
1 实 验
1.1 材料与仪器
材料:天然鳞片石墨(粒径为32~50 μm)、盐酸(质量分数37%)、醋酸(质量分数90%);高氯酸、高锰酸钾、硝酸铜、三水合六氰铁(Ⅱ)酸钾、氢氧化钠、氯化钾、氯化钠、氯化铯、无水氯化钙、无水氯化镁均为分析纯。
仪器:Nicolet 6700 型傅立叶变换红外光谱(FT-IR)仪、D8 Advance 型X射线衍射(XRD)仪、Zeiss Ultra Plus 型场发射扫描电子显微镜(SEM)、ESCALAB 250Xi型X射线光电子能谱(XPS)仪、X-Max 50型X射线能谱(EDS)仪。
1.2 实验方法
膨胀石墨制备实验:将一定量的天然鳞片石墨与6.00 mL/g高氯酸、1.5 mL/g醋酸混合,加入0.25 g/g高锰酸钾,在40 ℃恒温水浴中反应60 min,将产物用去离子水冲洗至中性,烘干得到可膨胀石墨。取可膨胀石墨在800 ℃下焙烧至体积不变,获得膨胀石墨,将膨胀石墨用去离子水冲洗2次,100 ℃烘干24 h备用。
CuHCF制备实验:将硝酸铜溶液与三水合六氰铁(Ⅱ)酸钾溶液按摩尔比1∶4的比例进行混合后,在200 r/min条件下搅拌5 min。将生成的颗粒在2 000 r/min条件下离心分离2 h,用去离子水冲洗沉淀物,烘干得到CuHCF。
EG-CuHCF制备实验:取1 g 膨胀石墨和一定量的硝酸铜溶液加入三颈圆底烧瓶中,在真空条件下缓慢搅拌。30 min后停止搅拌,静置,取反应后固体物质在80 ℃下真空干燥12 h。取干燥后的材料和一定量的三水合六氰铁(Ⅱ)酸钾溶液加入三颈圆底烧瓶中,在真空条件下缓慢搅拌,30 min后停止搅拌,取固体物质用去离子水反复冲洗,在80 ℃下真空干燥12 h,得到EG-CuHCF。
EG-CuHCF吸附实验:配制50 mg/L的Cs+溶液,在设定的条件下,将50 mL Cs+溶液加入到锥形瓶中,通过0.1 mol/L的氢氧化钠和0.1 mol/L的盐酸调节pH,将EG-CuHCF按6 g/g的投加量加入其中,120 r/min条件下振荡吸附,检测吸附后溶液中的Cs+浓度。
2 结果与分析
2.1 EG-CuHCF表征
2.1.1 FT-IR分析
由图1可知,3 445、1 625 cm-1处的峰分别对应膨胀石墨中游离水的O—H反对称伸缩振动峰和H—O—H弯曲振动吸收峰。1 387 cm-1处的特征峰是膨胀石墨和CuHCF结合形成的C—H伸缩振动峰,600、552 cm-1处的峰分别对应Fe(Ⅱ)—C、Fe(Ⅲ)—C的伸缩振动峰,证明膨胀石墨成功负载了CuHCF。通过XRD分析也可证实,膨胀石墨成功负载了CuHCF。
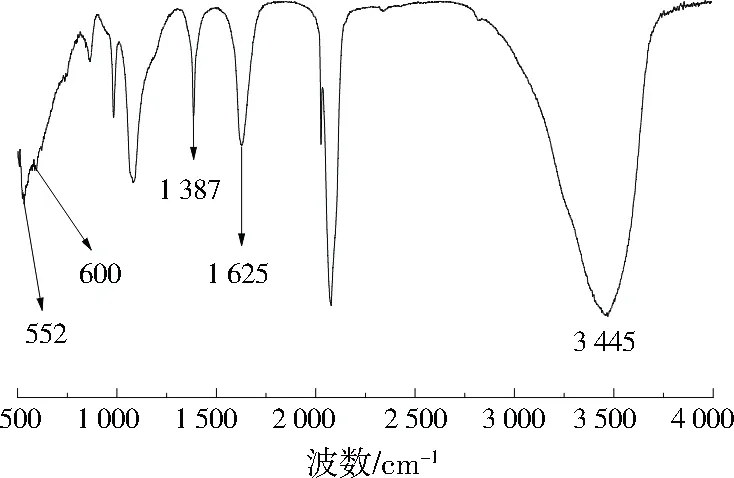
图1 FT-IR图谱Fig.1 FT-IR spectra
2.1.2 SEM分析
由图2(a)可知,膨胀石墨具有丰富的孔隙通道,内部表面光滑,呈现层状结构。由图2(b)可知,膨胀石墨负载CuHCF后,表面变得粗糙,表面负载的CuHCF颗粒平均粒径为50~100 nm。

图2 SEM图Fig.2 SEM images
2.2 吸附机理分析
737.00 eV处的Cs特征峰说明EG-CuHCF表面吸附上了Cs+(见图3(a))。由图3(b)可知,738.54、724.66 eV处的特征峰分别对应Cs 3d3/2和Cs 3d5/2,证实了材料表面有Cs+吸附。由图3(c)可知,吸附后K元素能量减弱,说明K元素含量减少[12],可以推出K与Cs+的吸附有关。

图3 XPS图谱Fig.3 XPS spectra
通过EDS进一步观察到EG-CuHCF吸附后出现了Cs元素,说明吸附反应有效进行。由EG-CuHCF吸附前后各元素的质量分数(见表1)可知,K元素质量分数降低了2.86百分点,而Cs元素质量分数增加了2.73百分点,结合XPS分析结果可知,EG-CuHCF吸附Cs+是通过结构内的K+与Cs+进行离子交换实现的。其他元素,如极少部分Cu2+与Fe2+存在制备过程中未反应完全的情况,因此在吸附过程中存在部分Cu2+与Fe2+的离子交换过程。

表1 EG-CuHCF吸附前后各元素质量分数Table 1 Mass fraction of each element on EG-CuHCF before and after adsorption
综合分析可知,EG-CuHCF通过化学吸附方式吸附Cs+,并与EG-CuHCF中的K+发生置换,从而达到去除溶液中Cs+的目的。当材料与Cs+溶液接触时,由于材料具有多孔结构,一部分Cs+被膨胀石墨的多孔结构捕集,另一部分Cs+随溶液进入材料内部,与CuHCF接触,并与CuHCF中的K+发生离子交换。
2.3 EG-CuHCF吸附Cs+的影响因素
2.3.1 CuHCF/膨胀石墨质量比对吸附效果的影响
在接触时间为60 min、pH为7、反应温度为25 ℃的条件下,CuHCF/膨胀石墨质量比对Cs+去除效果的影响如图4所示,在CuHCF/膨胀石墨质量比为0.5~1.5时,EG-CuHCF对Cs+的去除率随质量比的增加而快速增大;质量比大于1.5时,吸附开始趋于平衡;质量比为1.5时,去除率达到90.23%。综合考虑,可选择适宜CuHCF/膨胀石墨质量比为1.5。

图4 CuHCF/膨胀石墨质量比对吸附Cs+的影响Fig.4 Effect of CuHCF/expanded graphite mass ratio on adsorption of Cs+
2.3.2 接触时间对吸附效果的影响
在CuHCF/膨胀石墨质量比为1.5、pH为7、反应温度为25 ℃的条件下,接触时间对Cs+吸附效果的影响如图5所示,在吸附过程中,前20 min为快速吸附,20~120 min期间吸附速率上升较慢,120 min后吸附速率逐步趋于稳定,去除率达到95.11%。吸附初期,溶液中较高浓度的Cs+和EG-CuHCF上吸附点位接触多,去除率快速提高;随着吸附进行,Cs+浓度逐渐降低且材料上的吸附点位被占据,去除率缓慢提高,最后趋于稳定。综合考虑,可选择适宜接触时间为120 min。

图5 接触时间对吸附Cs+的影响Fig.5 Effect of contact time on adsorption of Cs+
2.3.3 反应温度对吸附效果的影响
在CuHCF/膨胀石墨质量比为1.5、pH为7、接触时间为60 min的条件下,反应温度对吸附效果的影响如图6所示,在吸附过程中,当温度由15 ℃提升到25 ℃时,去除率有所提升。在25~45 ℃时,去除率变化较小。在>45 ℃时,去除率继续增加。总体上升高温度有利于EG-CuHCF的吸附位点与Cs+结合,但综合考虑实际情况,可选择适宜反应温度为25 ℃。
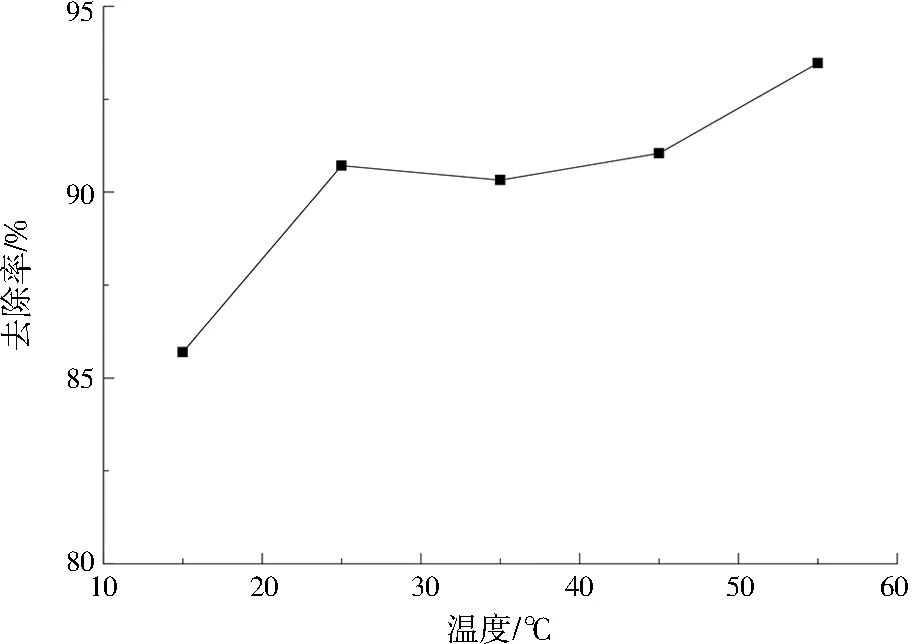
图6 反应温度对吸附Cs+的影响Fig.6 Effect of reaction temperature on adsorption of Cs+
2.3.4 pH对吸附效果的影响
在CuHCF/膨胀石墨质量比为1.5、反应温度为25 ℃、接触时间为60 min的条件下,pH对吸附效果的影响如图7所示,当pH在3~9时,吸附效果随着pH的增加而提升,去除率随着pH的增加而提升,幅度不大。当pH=9时,去除率达到90.08%。当pH>9时,去除率降低,这是由于在强碱条件下,Fe2+和—OH相结合,导致Fe2+与—CN断开[13-14],使得材料结构受到破坏,吸附能力减弱。pH=9和pH=7时的去除率差异较小(<1.7百分点),考虑到实际情况,可选择适宜pH为7。
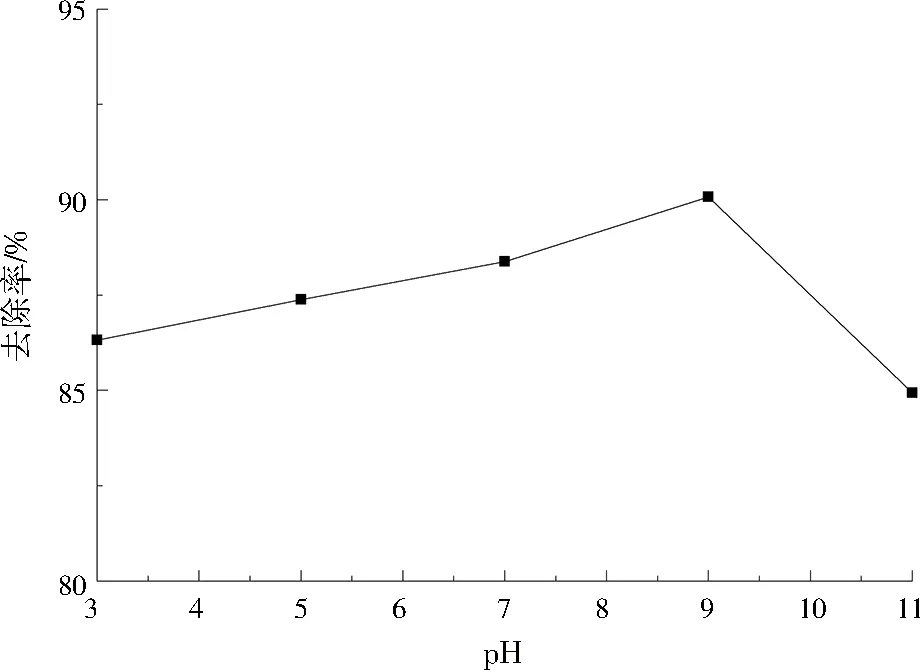
图7 pH对吸附Cs+的影响Fig.7 Effect of pH on adsorption of Cs+
2.3.5 干扰离子对吸附效果的影响
在CuHCF/膨胀石墨质量比为1.5、反应温度为25 ℃、pH为7、接触时间为60 min的条件下,干扰离子对吸附效果的影响如图8所示,干扰离子对EG-CuHCF吸附Cs+的抑制效应为K+>Na+>Ca2+>Mg2+。Cs和Na、K均为元素周期表中第一主族元素,且物理学特性相似,易产生竞争效应。CuHCF对Cs+的吸附是基于晶体内部的离子交换,K+离子半径与Cs+相差最小,在吸附过程中,K+与Cs+发生竞争,导致去除率降低[15]。
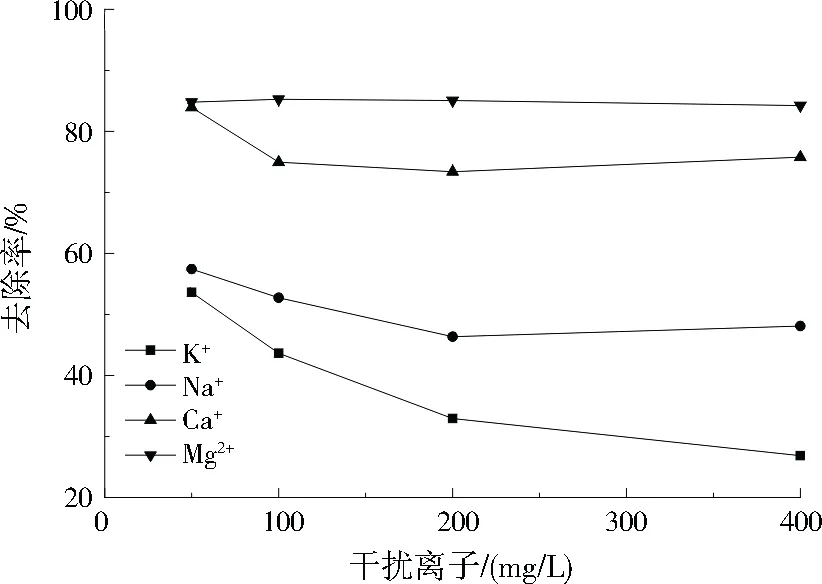
图8 干扰离子对吸附Cs+的影响Fig.8 Effect of interfering cations on adsorption of Cs+
2.4 吸附动力学研究
经拟合计算后可得,准二级动力学模型(R2=0.999)明显优于Elovich动力学模型(R2=0.824),表明整个吸附过程更符合准二级动力学模型。吸附过程为非均相扩散过程,分为快速吸附和缓慢吸附两个阶段,首先Cs+较快吸附到材料外表面,然后Cs+缓慢进入材料孔隙,直至达到吸附平衡。
2.5 等温吸附研究
经拟合计算后可得,Langmuir等温吸附模型(R2=0.996)明显优于Freundlich等温吸附模型(R2=0.949),说明材料对Cs+的吸附更适合用Langmuir等温吸附模型来描述。吸附Cs+的分离因子介于0~1,表明EG-CuHCF对Cs+的吸附属于自发的,吸附反应易发生。
3 结 论
(1) FT-IR、XRD、SEM分析可证实,膨胀石墨成功负载了CuHCF;XPS分析发现,EG-CuHCF吸附Cs+后,K峰明显减弱,出现了Cs 3d3/2和Cs 3d5/2峰,EDS分析发现,吸附后出现Cs信号,K的质量分数下降,说明EG-CuHCF成功吸附了Cs+,Cs+接触CuHCF后,与其结构中的K+进行离子交换,还有一部分Cs+被膨胀石墨的多孔结构捕集。
(2) 初始Cs+为50 mg/L,EG-CuHCF投加量为6 g/g时,EG-CuHCF吸附Cs+的适宜条件如下:CuHCF/膨胀石墨质量比为1.5,接触时间为120 min,反应温度为25 ℃,pH为7。此时Cs+去除率达到95.11%。干扰离子对EG-CuHCF吸附Cs+的抑制效应表现为K+>Na+>Ca2+>Mg2+。
(3) EG-CuHCF对Cs+的吸附行为符合准二级动力学模型和Langmuir等温吸附模型,该吸附过程为非均相扩散的化学吸附,该过程是自发的,吸附反应易发生。

