印度梨形孢(Piriformospora indica)诱导烟草对靶斑病的抗性及生理机制分析
朱 迪,李金梦,田仁进,李 震,罗富方,汪汉成,孙美丽,胡静荣*,许本波*
1.贵州省烟草公司黔西南州公司,贵州省兴义市桔山新区瑞南路60 号 562400
2.湖北文理学院现代农业研究院,湖北省襄阳市隆中路296 号 441053
3.贵州省烟草科学研究院,贵阳市观山湖区龙滩坝路29 号 550081
4.长江大学农学院,湖北省荆州市荆秘路88 号 434025
烟草靶斑病是由立枯丝核菌(Rhizoctoniasolani)引起的真菌性病害。该病害在烟草苗期至成熟期均可发生,可侵染烟株叶片、茎部和叶脉等部位,影响烟叶品质,造成较大经济损失[1-6]。据中国农药信息网数据显示,目前已登记防治靶斑病的单剂和混剂共14种,但已登记防治烟草靶斑病的药剂仅有井冈霉素1种。长期使用同种药剂可导致立枯丝核菌产生严重的抗药性,增加对病害的防治难度。为解决这一难题,王潮钟等[7]筛选出可供选择的化学药剂(30%苯甲·丙环唑和20%噻氟酰胺);徐传涛等[8]筛选出生物制剂(10 亿CFU/g 海洋芽孢杆菌可湿性粉剂和3%多抗霉素水剂)等。同时,也有学者提出了土壤改良、田园清理、肥料平衡和生态调控等农业措施[9-10],然而针对各产区复杂的气候条件和栽种模式,烟草靶斑病的传播速度和危害面积越来越大。因此,研发新型烟草靶斑病的绿色防控技术显得尤为重要。
印度梨形孢(Piriformosporaindica)是一种能够提高植物抗性的内生真菌,主要定殖于植物根部,促进植物对土壤中营养元素的吸收,从而增强植物对病害的抗性[11-12]。研究表明,印度梨形孢可诱导大麦对白粉病病原菌Blumeriagraminis、小白菜对黑斑病病原菌Alternariabrassica、玉米对轮枝镰孢菌Fusariumverticillioides、烟草对黑胫病病原菌Phytophthoraparasitica、烟草对青枯病病原菌Ralstoniasolanacearum等产生抗病性[13-16],其抗病性机理与植物体内保护酶活性及复杂的新陈代谢显著相关[17]。例如超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Perosidase,POD)、过氧化氢酶(Catalase,CAT)、苯丙氨酸解氨酶(Phenylalanine ammonialyase,PAL)等均是植物体内重要的防御酶,能抵抗活性氧和氧自由基对其细胞膜系统的伤害,增强植物的抗逆性或抗病性[18]。植物器官衰老或病变通常导致膜脂过氧化反应,而丙二醛(MDA)是膜脂过氧化反应的最终产物,其含量与植物抗病性成负相关[19]。脯氨酸(Pro)是植物体中重要的蛋白质组分,在调节细胞渗透、稳定生物大分子等方面起着重要作用,在某种程度上也反映了植物的抗逆性[20]。但目前有关印度梨形孢诱导烟草对靶斑病的抗病性研究则鲜见报道。因此,采用平板对峙法、混菌法和盆栽接菌法研究印度梨形孢诱导烟草对靶斑病的抗性生理机制,并检测了烟叶中SOD、POD、CAT、PAL、MDA 和Pro 等与抗性相关的生理指标,同时调查了印度梨形孢对烟草生长的影响,旨在为烟草靶斑病生防菌剂的开发奠定基础。
1 材料与方法
1.1 材料与菌株培养
印度梨形孢(Pi)由长江大学生命科学学院实验室提供;烟草靶斑病病原菌立枯丝核菌(Rs)和烟草种子(红花大金元)由贵州省烟草科学研究院提供。参考陈佑源等[21]的方法进行印度梨形孢PDA固体培养。用无菌打孔器( =5 mm)从PDA固体平板培养基上取培养7 d的菌块,接种于PD液体培养基中,置于28 ℃,150 r/min的摇床上振荡培养8 d,制备得到印度梨形孢菌液。将立枯丝核菌转接至PDA固体培养基中,置于28 ℃恒温培养箱内黑暗条件下培养3 d,备用。
1.2 方法
1.2.1 印度梨形孢和立枯丝核菌的生长动态测定
分别用无菌打孔器( =5 mm)从PDA固体培养基上取生长良好的印度梨形孢和立枯丝核菌菌块1块,接种至另一装有PDA 培养基的培养皿( =15 cm)的中心位置,置于恒温培养箱中于28 ℃黑暗条件下培养,每天测量菌落的直径,直到菌落将培养皿布满为止。每处理重复3次。
1.2.2 印度梨形孢和立枯丝核菌的平板对峙培养
参考1.2.1节印度梨形孢和立枯丝核菌的生长动态。先用无菌打孔器( =5 mm)从PDA固体培养基上取生长良好的印度梨形孢菌块1个,接种至另一装有PDA 固体培养基的培养皿( =9 cm)中。接种时,印度梨形孢菌块接种至距离培养皿中心位置2 cm的左侧,置于恒温培养箱中于28 ℃黑暗条件下培养5 d,再取出该培养皿,在距离培养皿中心2 cm的右侧接种立枯丝核菌菌块( =5 mm)1 块。然后再将接种好的培养皿置于上述培养箱中继续培养。此时开始计时,分别比较同一培养皿中立枯丝核菌培养第1天与印度梨形孢培养第6天、立枯丝核菌培养第2天与印度梨形孢培养第7天、立枯丝核菌培养第3天与印度梨形孢培养第8天菌落的长势,测量菌落直径大小并拍照。每处理重复3次。
1.2.3 混菌法培养印度梨形孢后接种立枯丝核菌对其生长的影响测定
参考1.2.1节印度梨形孢和立枯丝核菌的生长动态,参考胡静荣[22]的方法进行印度梨形孢孢子悬液的制备。处理:将100 mL PDA 固体培养基融化,待温度降至55 ℃左右时,再加入5 mL印度梨形孢孢子悬液,混匀后倒平板,将平板置于恒温培养箱28 ℃黑暗条件下培养5 d后,再在平板中心接种生长良好的立枯丝核菌块( =5 mm);对照:在PDA固体培养基平板中心接种同样大小的立枯丝核菌块。每天观察菌落的生长情况,持续7 d,测量其直径大小并拍照。每处理重复3次。
1.2.4 印度梨形孢在烟草根部的定殖检测
将烟草种子用75%乙醇消毒60 s,用无菌水清洗3次,加入2.5%次氯酸钠消毒8 min,再用无菌水洗3次。然后播种于装有无菌基质[m(营养土)∶m(蛭石)∶m(珍珠岩)=4 ∶2 ∶1]的培养钵中(钵口 =9 cm),置于温度为26 ℃,相对湿度为75%,光周期L∶R=14 h ∶10 h 的恒温培养箱中培养。30 d 后挑选长势一致的烟苗,分别向钵中浇灌100 mL印度梨形孢菌液,待第5、10、15和20 天取烟苗根系1 cm,置于10%KOH溶液中浸泡10 h,用无菌水洗涤3次后,放入1%HCl 溶液中浸泡5 min,用0.05%台盼蓝染色5 min,再用无菌水洗涤5次,然后在显微镜(Y-TV55,日本尼康仪器上海有限公司)400倍下检测印度梨形孢在烟草根系的定殖情况并拍照。
1.2.5 印度梨形孢对立枯丝核菌侵染烟苗的影响测定
按1.2.4节的方法选取播种30 d后长势一致的烟苗进行试验。对照1(CK1):浇灌100 mL无菌水,然后用灭菌的接种针对健康烟叶扎孔,但不接种立枯丝核菌;处理1(Pi):浇灌100 mL 印度梨形孢菌液,然后用灭菌的接种针对健康烟叶扎孔但不接种立枯丝核菌;处理2(20Pi+Rs):浇灌100 mL 印度梨形孢菌液,20 d后采用针刺法对健康烟叶进行处理,在伤口处放置5 mm 的待测立枯丝核菌菌饼,保湿培养;处理3(Pi+Rs):浇灌100 mL 印度梨形孢菌液,采用上述针刺法接种立枯丝核菌;处理4(Rs):浇灌100 mL 无菌水,采用上述针刺法接种立枯丝核菌。处理2接种Pi后20 d再接种Rs,其中接种Rs的时间与CK1、处理1、处理3、处理4在同一天进行。5次重复,每重复3株烟苗,选取每株烟的最大叶片以主脉为对称进行接种,接种后分别在第3、6 和9 天调查烟草靶斑病的发病情况[23],以叶片上病斑为准,测量每片烟叶上病斑直径并取平均值。
1.2.6 生理指标测定
选1.2.5节中CK1、处理2和处理4第9天的烟叶进行生理指标测定。参考陈建勋等[24]的方法测定叶片样品中丙二醛(MDA)和脯氨酸(Pro)含量(质量分数),以及超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性。参考王学奎[25]的方法测定样品中苯丙氨酸解氨酶(PAL)活性。每处理重复5次。
1.2.7 烟草生长和光合作用测定
按1.2.4节的方法选取播种30 d后长势一致的烟苗进行试验。CK1:浇100 mL无菌水;处理1(Pi):浇100 mL印度梨形孢菌液。每处理重复5次,每重复3株烟苗。50 d后随机挑选烟株上、中、下3片烟叶,采用光合作用测定仪(LI-6400,美国LI-COR 公司)测定净光合速率,以及单叶鲜质量、单叶长和宽,然后将烟叶烘干后称其干质量;同时测量每株烟的株高,并计算其平均值。
1.3 数据处理
采用Excel 2007 和SPSS 17.0 进行数据的统计分析。用Duncan’s新复极差(DMRT)法进行多组样本间的差异显著性检验;用t检验(Student’st-test)进行两组数据间的比较,P<0.05 水平作为差异显著的标准。
2 结果与分析
2.1 印度梨形孢和立枯丝核菌的生长动态
印度梨形孢和立枯丝核菌的生长动态测定结果(图1)表明:印度梨形孢和立枯丝核菌的菌落大小与培养时间均呈线性关系,但印度梨形孢的生长速率显著低于立枯丝核菌。其中,印度梨形孢和立枯丝核菌菌落布满培养皿( =15 cm)分别需要20和7 d。

图1 印度梨形孢(A)和立枯丝核菌(B)的生长动态Fig.1 Growth dynamic of Piriformospora indica(A)and Rhizoctonia solani(B)
2.2 印度梨形孢与立枯丝核菌的平板对峙
在PDA 平板上接种印度梨形孢5 d 后再对峙接种立枯丝核菌结果(图2)表明:随着培养时间延长立枯丝核菌菌落明显增大,但印度梨形孢生长缓慢。其中,立枯丝核菌培养第1天和第2天的菌落直径显著小于印度梨形孢培养第6天和第7天的菌落直径,但是立枯丝核菌培养第3天的菌落直径却显著大于印度梨形孢培养第8天的菌落直径。
2.3 混菌法培养印度梨形孢后接种立枯丝核菌对其生长的影响
对照立枯丝核菌在PDA 培养基上持续增长(图3A),培养第5天可布满整个培养皿,见图3A、图3B。然而,混菌法先培养印度梨形孢5 d后再接种立枯丝核菌,持续观察5 d均未发现立枯丝核菌生长(图3A、图3C)。后续持续观察仍未见立枯丝核菌的生长。
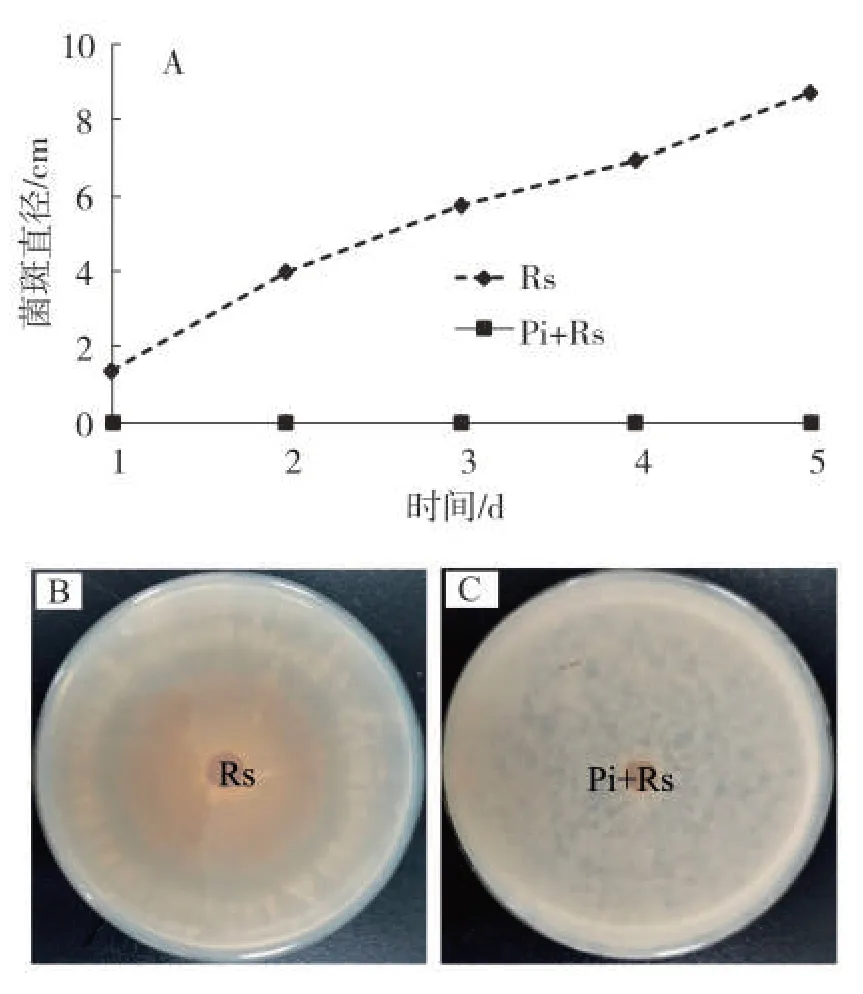
图3 混菌法培养印度梨形孢后接种立枯丝核菌对立枯丝核菌生长的影响Fig.3 Effect of PDA medium mixed with P.indica on growth of R.solani after inoculation
2.4 印度梨形孢在烟草根系的定殖检测
浇灌印度梨形孢菌液后第5、10和15 天,在烟草根系中均未检测到印度梨形孢定殖,但在第20 天检测到印度梨形孢的厚垣孢子存在于烟草根系的细胞内或细胞间(图4),表明印度梨形孢已定殖于烟株根系中。

图4 印度梨形孢在烟草根系中的定殖检测Fig.4 Colonization detection of Piriformospora indica on roots of tobacco plant
2.5 印度梨形孢诱导烟草对靶斑病抗性的影响
CK1 和Pi 处理均未见发病症状,而其他3 个处理接种立枯丝核菌的烟草均存在不同程度的发病现象。其中,20Pi+Rs处理的病斑最小,显著低于Pi+Rs和Rs处理的病斑,但Pi+Rs和Rs处理烟苗的病斑差异不显著(P>0.05)。另外,随着培养时间的延长,3个发病处理病斑的直径均持续增大,但Pi+Rs 和Rs处理病斑直径的增长速率更快,见图5。
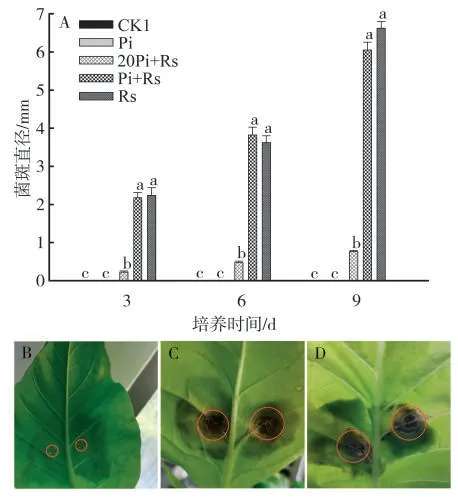
图5 不同处理对烟草靶斑病病斑大小的影响Fig.5 Effects of different experimental treatments on target spot size on tobacco leaves
2.6 印度梨形孢诱导对烟草抗病生理指标的影响
20Pi+Rs处理烟叶的CAT、POD、SOD、PAL酶活和Pro 含量均最高且显著高于其他处理,MDA 含量最低且显著低于其他处理;CK1 组烟叶的CAT、POD、SOD、PAL酶活和Pro含量均最低;Rs组烟叶的MDA含量最高,见图6。

图6 印度梨形孢和立枯丝核菌对烟草抗病生理指标的影响Fig.6 Effects of Piriformospora indica and Rhizoctonia solani on physiological indexes of tobacco
2.7 印度梨形孢对烟草生长的影响
检测发现根系定殖印度梨形孢的烟草叶绿素含量、株高、单叶鲜质量、单叶干质量、叶长和叶宽均显著高于未定殖印度梨形孢的烟株,见图7。
3 讨论
本研究表明,印度梨形孢和立枯丝核菌的菌落大小与培养时间均呈线性关系,但印度梨形孢的生长速率显著低于立枯丝核菌。布满同样大小的培养皿,印度梨形孢需要的时间是立枯丝核菌的2.86倍。因此,研究印度梨形孢是否能够抑制立枯丝核菌的生长时,需要提前接种印度梨形孢,待其生长稳定后再接种立枯丝核菌。
印度梨形孢在PDA 上培养5 d 可形成比较规则且厚实的菌落。因此,在进行平板对峙或混菌法抑菌时,先将印度梨形孢培养5 d,再接种立枯丝核菌。根据平板对峙试验发现,立枯丝核菌第3 天的菌落直径已显著超过印度梨形孢第8 天的菌落直径,虽然与印度梨形孢接触的一侧存在抑制现象,但未见明显的抑制圈,这种抑制作用可能并非印度梨形孢的次生代谢产物所为,而是印度梨形孢提前培养,占据了立枯丝核菌的生态位,阻止其“越界”生长。然而,本研究中通过混菌法培养印度梨形孢5 d后再接种立枯丝核菌,发现立枯丝核菌不能正常生长,说明印度梨形孢能够显著抑制立枯丝核菌生长,其抑菌机理有待进一步研究。
印度梨形孢定殖在植物根系表面和表皮细胞内,能够促进植物吸收营养并增强其抗逆性[26]。本研究结果表明,接菌20 d 后在烟草根系细胞内或细胞间可清楚地观察到其厚垣孢子,暗示着印度梨形孢已定殖于烟草根部。
印度梨形孢定殖于大麦根系,白粉病的发病率下降58%[27];定殖于番茄根系,黄萎病的发病率降低30%[28]。本研究结果表明,在烟苗根系浇灌印度梨形孢菌液20 d 后再在叶片接种立枯丝核菌,接种部位发病,但病斑直径显著小于Pi+Rs 组和Rs 组,而Pi+Rs 组和Rs 组病斑直径差异不显著,暗示着印度梨形孢定殖于根系才能提高烟草对靶斑病的抗性,或抑制靶斑病病斑的快速生长。因此,采用印度梨形孢预防烟草靶斑病时,应在烟株发病前将其定殖于烟草根系,以增强烟株的抗病能力。
根系定殖印度梨形孢,可增强玉米对根腐病的抗性,其机理与玉米叶片过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)和超氧化物歧化酶(SOD)的活性显著提高密切相关[29]。同样,根系定殖印度梨形孢,也能显著增强大麦对白粉病的抗性,其机理与大麦叶内抗氧化酶活的增强显著相关[30]。另外,根系定殖印度梨形孢后接种长柄链格孢(Alternarialongipes),烟叶中MDA含量显著降低,Pro含量显著升高[14,31],与本研究结果一致。本研究中还发现,定殖印度梨形孢的烟草接种立枯丝核菌后,其体内CAT、POD、SOD 和PAL 4 种常见酶活和Pro 含量均显著高于根系未定殖印度梨形孢的烟株,进一步证明根系定殖印度梨形孢之所以能够抑制烟草靶斑病病斑的快速增长,与其提高烟叶抗氧化能力有关。
植物体中的叶绿素含量与光合作用有着密切关系。通常情况下,叶绿素含量越高,植物的光合效率也越高[13]。本研究中发现,根系定殖印度梨形孢的烟草叶绿素含量显著高于未定殖印度梨形孢的烟草,与前人研究结果一致[32]。同时,前人研究表明,接种印度梨形孢能够提高四九黄菜心[33]、番茄[34]等的产量。本研究中也得到一致的结果,即根系定殖印度梨形孢的烟株株高、单叶鲜质量、单叶干质量、叶片长和叶片宽均显著高于未定殖印度梨形孢的烟株,进一步证实了印度梨形孢能够促进烟株生长。然而,目前关于印度梨形孢促进植物生长的机理尚不明确,可能与诱导其生长激素或吸收营养物质等有关,有待进一步深入研究。
4 结论
印度梨形孢的生长速率显著低于立枯丝核菌;印度梨形孢和立枯丝核菌混菌法培养时立枯丝核菌无法正常生长;印度梨形孢菌液浇灌20 d 后可定殖于烟草根系中,定殖的印度梨形孢可显著抑制烟草靶斑病病斑的生长;浇灌印度梨形孢菌液后可促进烟株生长。印度梨形孢能够抑制立枯丝核菌的正常生长,增强烟草对靶斑病的抗性。

