3种测试片对烟用香精香料菌落总数检测的适用性评价
叶长文,周 芸,李 栋,崔中月,赵婉霞,黄 阔,胡中军,周 晓*
1.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2 号 4500012.广西中烟工业有限责任公司技术中心,南宁市西乡塘区北湖南路28 号 530001
烟用香精香料种类繁多,组分复杂,富含微生物生长所需营养成分,易受污染变质[1-4]。菌落总数是影响烟用香精香料质量稳定的重要因素之一[5],也是评价烟用香精香料卫生状况的重要指标。目前,食品样品的菌落总数检测常参照国家标准GB 4789.2—2022[6]中的平板计数法或测试片法进行。平板计数法为传统的菌落总数检测方法,但该方法操作复杂,且对检测环境要求较高[7]。测试片法是以凝胶或无纺布为培养基载体代替琼脂培养微生物的一种新型检测方法,具有操作快速、易于判读、准确性好等优点[8]。采用测试片法检测各类食品样品菌落总数的研究已有报道[9-10]。王曦等[11]采用测试片法与平板计数法检测了30个糕点样品的菌落总数,发现2种方法检测的菌落总数无显著差异;林杰等[12]采用测试片法和平板计数法分别检测了沙拉、茶叶、明虾等15 种食品样品的菌落总数,发现2 种方法的菌落总数检测结果无显著差异;赵立冬等[13]采用测试片法与平板计数法对129 个熟肉样品的菌落总数进行检测,发现测试片法与平板计数法的检测结果一致性较好。然而,测试片法检测烟用香精香料菌落总数的相关研究还鲜见报道。为此,使用3种测试片以及PCA培养基检测标准菌株样品、菌落总数定量质控样品和烟用香精香料样品的菌落总数,评价3种测试片检测烟用香精香料菌落总数的适用性,旨在为测试片用于烟用香精香料菌落总数检测提供依据。
1 材料与方法
1.1 材料、试剂和仪器
供试的17株标准菌株(表1)购自中国食品药品检定研究院,为菌落总数测定过程中常见的可培养细菌[7,14],也是变质烟用香精香料中常见的优势菌[2,4]。菌落总数定量质控样品(QC-FD-002)购自中国检验检疫科学研究院。标准菌株和菌落总数定量质控样品均保存于-20 ℃冰箱。代表性烟用香精香料样品采集于广西中烟工业有限责任公司仓库,共计56个。其中,1~53号样品为烟用香料(含单体香料、香基、浸膏、酊剂、净油等),54~56号样品为烟用香精。烟用香精香料样品均保存于4 ℃冰箱。

表1 标准菌株名称和编号Tab.1 Name and number of standard strains
3M PetrifilmTM菌落总数测试片(3M-AC 测试片,3M 中国有限公司);DNP 菌落总数测试片[DNP-AC测试片,安科生物制品(上海)有限公司];MC-Media 菌落总数测试片(MC-AC 测试片,德国Merck公司)。
平板计数琼脂(PCA)培养基和脑心浸出液肉汤(BHI)(北京陆桥技术有限公司);无菌磷酸盐缓冲液(PBS,pH=7.2,山东微色谱生物科技有限公司)。
Bio II Advance 生物安全柜(西班牙Telstar 公司);BagMixer 400 均质器(法国Interscience 公司);CTHI-250B2H 恒温恒湿箱[施都凯仪器设备(上海)有限公司];CL-40M 高压灭菌锅(日本ALP 公司);ZQZY-C58F 恒温振荡培养箱(上海知楚仪器有限公司)。
1.2 方法
1.2.1 标准菌株样品菌悬液制备
分别挑取17株标准菌株的单菌落接种于10 mL BHI培养基中,36 ℃、180 r/min振荡培养24 h进行活化。取10 μL活化后的菌液加入含有9 mL无菌磷酸盐缓冲液的试管中,充分混匀后对所得液体进行梯度稀释,得到7个稀释梯度(10-1、10-2、10-3、10-4、10-5、10-6、10-7)的标准菌株菌悬液。
1.2.2 菌落总数定量质控样品菌悬液制备
参照菌落总数定量质控样品说明书制备菌悬液原液。使用无菌磷酸盐缓冲液对菌悬液原液进行梯度稀释,得到4个稀释梯度(10-2、10-3、10-4、10-5)的菌落总数定量质控样品菌悬液。
1.2.3 烟用香精香料样品匀液制备
称取25 g或量取25 mL烟用香精香料样品放入无菌均质袋中,加入225 mL无菌磷酸盐缓冲液后使用拍击式均质器(2 挡)均质1~2 min。将所得液体进行梯度稀释,得到4 个稀释梯度(10-1、10-2、10-3、10-4)的烟用香精香料样品匀液。
1.2.4 菌落总数检测方法
1.2.4.1 平板计数法
在无菌条件下分别取10-1~10-7稀释梯度的标准菌株菌悬液、10-2~10-5稀释梯度的菌落总数定量质控样品菌悬液和10-1~10-4稀释梯度的烟用香精香料样品匀液1 mL滴至无菌培养皿上,然后加入15~20 mL冷却至46~50 ℃的PCA培养基,转动培养皿使其充分混匀,每个稀释梯度设置3次重复。待琼脂凝固后将培养皿倒置,(36±1)℃培养48 h后观察PCA培养基上的菌落形态,并进行菌落计数,参照文献[6]计算菌落总数。
1.2.4.2 测试片法
在无菌条件下分别取10-1~10-7稀释梯度的标准菌株菌悬液、10-2~10-5稀释梯度的菌落总数定量质控样品菌悬液和10-1~10-4稀释梯度的烟用香精香料样品匀液1 mL滴至测试片中央,每个稀释梯度重复3次。(36±1)℃培养24 h后观察MC-AC测试片上的菌落形态,并进行菌落计数;在培养48 h后观察3M-AC和DNP-AC测试片上的菌落形态,并进行菌落计数。测试片法的详细操作和菌落总数的计算参照3M-AC、DNP-AC和MC-AC测试片使用说明书进行。
1.2.5 数据统计分析
使用Excel 软件将菌落总数转换为10 的对数值,再用SPSS 24.0软件对标准菌株和烟用香精香料样品的菌落总数对数值进行Pearson相关性分析,并对烟用香精香料的菌落总数对数值进行配对t检验。
菌落总数定量质控样品的结果通过计算Z比分数进行评价。Z比分数计算公式:
式中:x为实验室菌落总数检测结果对数值,lgCFU/mL;X为特性值;s为能力评定标准差。本实验中菌落总数定量质控样品的特性值和能力评定标准差分别为3.370 lgCFU/mL 和0.182 lgCFU/mL。当|Z|≤2时,评价结果为“满意”;2<|Z|<3时,评价结果为“有问题”;|Z|≥3时,评价结果为“不满意”。
2 结果与分析
2.1 标准菌株样品菌落形态和菌落总数
2.1.1 标准菌株样品菌落形态
17株标准菌株在PCA培养基和3种测试片上的菌落形态描述见表2。在3种测试片上,所有标准菌株菌落均为红色;在PCA培养基上,除金黄色葡萄球菌(Staphylococcusaureus)为黄色外,其他标准菌株菌落均为白色。在PCA培养基上培养48 h后,同一标准菌株在PCA培养基表面和内部的菌落大小和形状差异较大。17 株标准菌株在3M-AC 测试片上培养48 h后,枯草芽胞杆菌(Bacillussubtilis)、解淀粉芽胞杆菌(Bacillusamyloliquefaciens)和多黏类芽胞杆菌(Paenibacilluspolymyxa)的菌落有明显的液化现象(图1),影响计数,其他标准菌株菌落一般为圆形或近似圆形,菌落形态清晰,便于计数。在DNP-AC测试片上培养48 h后,标准菌株菌落一般为圆形,菌落形态清晰,便于计数。在MC-AC测试片上培养24 h后,标准菌株菌落形状多不规则,但菌落形态清晰,无液化现象,便于计数。

图1 3M-AC测试片上有明显液化现象的标准菌株Fig.1 Standard strains with visible liquefaction on 3M-AC count plates
2.1.2 标准菌株菌落总数检测结果
表3为17株标准菌株的菌落总数和菌落总数对数值。其中,大肠杆菌(Escherichiacoli)、肠沙门氏菌肠亚种鼠伤寒血清型(Salmonellaentericasupbsp.entericaserovarTyphimurium)、塞氏柠檬酸杆菌(Citrobactersedlakii)、鲍曼不动杆菌(Acinetobacter baumnnii)、金黄色葡萄球菌(Staphylococcusaureus)和缓慢葡萄球菌(Staphylococcuslentus)6株标准菌株的3种测试片与PCA培养基菌落总数检测结果均为同一数量级;蜡样芽胞杆菌(Bacilluscereus)的3M-AC 和DNP-AC 测试片菌落总数检测结果与PCA培养基菌落总数检测结果存在2个数量级的差异;苏云金芽胞杆菌(Bacillusthuringiensis)的3M-AC测试片菌落总数检测结果与PCA培养基菌落总数检测结果存在2个数量级的差异。由图2可见,PCA培养基与3M-AC、DNP-AC和MC-AC测试片的菌落总数对数值呈极显著(P<0.01)正相关。其中,MC-AC测试片的菌落总数对数值与PCA培养基的菌落总数对数值相关性(R2=0.997 7,P<0.01)最好。

图2 不同检测方法标准菌株菌落总数对数值的相关性分析Fig.2 Correlation analysis between logarithmic values of aerobic plate counts of standard bacterial strains obtained by different methods

表3 标准菌株的菌落总数和菌落总数对数值Tab.3 Aerobic plate counts and the logarithmic values of aerobic plate counts of standard strains
2.2 定量质控样品菌落总数检测结果和评价
使用PCA培养基和3种测试片对菌落总数定量质控样品进行检测,PCA 培养基、3M-AC、DNP-AC和MC-AC测试片的菌落总数对数值如表4所示。Z比分数的评价结果均为“满意”。

表4 菌落总数定量质控样品检测结果和评价Tab.4 Determination results and evaluation of quality control sample for aerobic plate count
2.3 烟用香精香料样品菌落总数检测结果
使用PCA培养基和3种测试片分别检测56个烟用香精香料样品的菌落总数,部分样品检测结果见表5。其中,39个样品的菌落总数小于10 CFU/mL(g),17 个样品的菌落总数大于10 CFU/mL(g)。由图3可见,采用测试片法和平板计数法检测烟用香精香料样品菌落总数,2种方法的菌落总数对数值呈正相关。其中,MC-AC测试片与PCA培养基的菌落总数对数值相关性(R2=0.922 8,P<0.01)最好。烟用香精香料样品菌落总数对数值配对t检验结果(表6)表明,PCA 培养基与3 种测试片的菌落总数对数值差异均不显著(P>0.05)。

表5 烟用香精香料样品的菌落总数和菌落总数对数值①Tab.5 Aerobic plate counts and logarithmic values of aerobic plate counts of tobacco flavor samples

表6 烟用香精香料样品菌落总数对数值配对t检验①Tab.6 Paired t-test for logarithmic values of aerobic plate counts of tobacco flavor samples
2.4 平板计数法和测试片法操作过程比较
由表7可见,相比平板计数法,在前期准备时,测试片法无需清洗培养皿和配制培养基。在接种样品匀液时,平板计数法将样品匀液滴至培养皿后需倾注PCA培养基(46~50 ℃),而测试片法只需滴加样品匀液即可。其中,样品匀液滴至3M-AC测试片中央后,需用压板将样品匀液压至规定大小,操作不当会导致样品匀液接种区大小不一致,影响判读,而样品匀液滴至MC-AC 和DNP-AC 测试片中央后无需压板按压,样品匀液因毛细管作用将自动扩散至测试片的整个接种区。在培养过程中,平板计数法使用的培养皿所占空间较大,而测试片体积小,可堆叠,移动方便;PCA 培养基、3M-AC 和DNP-AC 测试片的培养时间均为48 h,而MC-AC测试片的培养时间为24 h。在结果判读时,PCA 培养基上的菌落颜色和培养基接近,部分菌落较小,难以观察和计数,而测试片上的菌落为红色,菌落清晰,便于计数,但当3M-AC测试片上出现明显的液化现象时,可能会影响菌落计数。
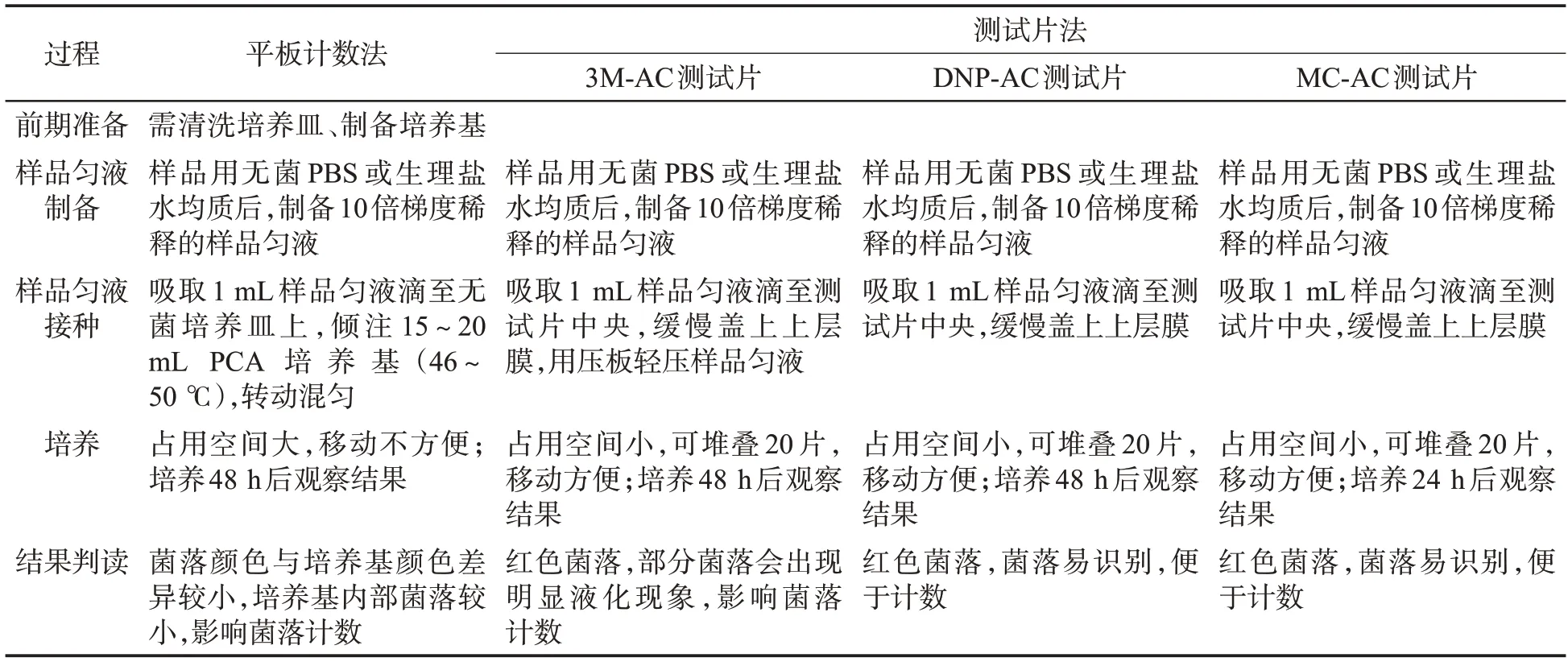
表7 平板计数法和测试片法的操作过程Tab.7 Procedures of plate count method and count plate method
综上,在进行菌落总数检测时,测试片法比平板计数法更简便、快速。其中,使用MC-AC 测试片进行菌落总数检测的前期准备、样品匀液接种和培养过程耗时均最短。
3 讨论
3 种测试片与PCA 培养基的计数结果无显著(P>0.05)差异,这与徐蕾蕊等[14]和孙霞等[15]的研究结果一致。枯草芽胞杆菌(Bacillussubtilis)、解淀粉芽胞杆菌(Bacillusamyloliquefaciens)和多黏类芽胞杆菌(Paenibacilluspolymyxa)在3M-AC 测试片上菌落边缘模糊,液化现象明显,这与谢范英[7]和王杰伟等[16]的研究结果一致。液化现象的产生可能是因为这些菌株的代谢能力较强,分解了测试片中的凝胶。在使用PCA 培养基和3 种测试片对烟用香精香料菌落总数进行检测时,发现54号样品在PCA培养基上的检测结果比3M-AC 和DNP-AC 测试片高4 个数量级,这与张建军等[9]报道的3M-AC 测试片和PCA 培养基检测同一浓缩果汁样品时,PCA 培养基上的菌落总数比测试片上菌落总数高的结果相似。
4 结论
17 株标准菌株中的枯草芽胞杆菌(Bacillus subtilis)、解淀粉芽胞杆菌(Bacillusamyloliquefaciens)和多黏类芽胞杆菌(Paenibacilluspolymyxa)在3M-AC 测试片上有明显的液化现象,其余标准菌株在PCA 培养基和3 种测试片上的菌落形态均较清晰,便于计数。标准菌株3种测试片的菌落总数对数值与PCA 培养基的菌落总数对数值呈极显著(P<0.01)正相关。对菌落总数定量质控样品的PCA 培养基与3 种测试片的菌落总数对数值进行Z比分数评价,评价结果均为“满意”。烟用香精香料样品的3种测试片与PCA培养基的菌落总数对数值间差异不显著(P>0.05),且MC-AC 测试片与PCA 培养基的菌落总数对数值相关性(R2=0.922 8,P<0.01)最好。测试片法比平板计数法更简便、快速。其中,使用MC-AC测试片检测菌落总数耗时最短。

