氯普噻吨调节Akt/mTOR通路对人急性髓系白血病细胞自噬和凋亡的影响
王瑞娟 李超 段丽娟 尚淼 杨如玉
南阳市中心医院血液内科(河南南阳 473000)
急性髓系白血病(acute myeloid leukemia,AML)主要是造血细胞的恶性增殖,导致细胞无法正常分化、凋亡,从而诱发造血系统恶性疾病,患者预后和存活率较差[1-2]。自噬是一种细胞内分解代谢途径,在正常和病理生理条件下调节细胞稳态[3]。在血液恶性肿瘤中,自噬参与癌前病变、癌细胞增殖及抑制等过程,是肿瘤治疗中的一个关键靶标[4-6]。了解自噬如何影响AML肿瘤发生,选择安全、有效的药物治疗对于疾病控制有较高意义。据报道,多巴胺受体在AML细胞中存在异常表达,多巴胺受体拮抗剂可作为抗白血病药物[7]。氯普噻吨是一种常用的多巴胺受体拮抗剂,可诱导AML细胞凋亡和自噬,为AML的潜在治疗药物[8];但具体机制尚不明确。蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路是调控自噬的重要通路,也是癌症治疗的关键靶标[9];研究[10]显示,激活Akt/mTOR通路可抑制细胞自噬和凋亡,并增加AML耐药性。Akt/mTOR通路抑制剂可抑制AML细胞增殖,诱导细胞凋亡[11]。此外,有报道[12]显示,多巴胺受体拮抗剂可通过AKT/mTOR通路诱导自噬发挥抗癌活性。但是氯普噻吨的抗AML作用是否与AKT/mTOR通路有关尚鲜见报道。因此,本研究基于Akt/mTOR通路探讨了氯普噻吨对人AML细胞自噬和凋亡影响,以期明确氯普噻吨的治疗机制。
1 材料与方法
1.1 材料
1.1.1 细胞SKNO-1、MOLM-13细胞均购自中国细胞系上海细胞库,产品编号分别为:BNCC340118、BNCC340568。
1.1.2 主要试剂与仪器氯普噻吨(常州亚邦制药有限公司);Akt激活剂SC79(美国Selleck公司,货号:S786303);Cell Counting Kit-8(CCK-8)试剂盒、Annexin V-FITC细胞凋亡检测试剂盒(碧云天生物技术,货号:C0038、C10621);单丹磺酰尸胺(monodansylcadaverine,MDC)染色试剂盒(北京雷根生物技术有限公司,货号:DA0041);一抗兔源SQSTM1/p62、微管相关蛋白1轻链3B(LC3B)、聚腺苷酸二磷酸核糖转移酶(PARP)、天冬氨酸特异性半胱氨酸蛋白酶3(caspase3)、激活型caspase3(cleaved caspase3)、Akt、p-Akt、mTOR、p-mTOR、GAPDH,二抗羊抗兔(英国abcam公司,货号:ab109012、ab63817、ab191217、ab32351、ab32042、ab179463、ab8805、ab134903、ab232486、ab9485、ab205718)。培养箱(济南鑫贝西生物技术有限公司,型号:QP-80);酶标仪(上海美谷分子仪器有限公司,型号:SpectraMax iD5);流式细胞仪(贝克曼库尔特,型号:cytoflex);荧光显微镜(奥林巴斯,型号:CX33);凝胶成像分析系统(北京中西华大科技有限公司,型号:CN61M)。
1.2 方法
1.2.1 细胞培养SKNO-1细胞采用90% IMDM+10%胎牛血清(FBS)培养液、MOLM-13细胞采用90% RPMI-1640+10% FBS培养液均在5%二氧化碳培养箱中37 ℃培养。整个过程无菌操作,细胞均采用半量换液分瓶传代,细胞传2 ~ 3代进行实验。
1.2.2 细胞分组及处理0、20、40、60 μmol/L氯普噻吨分别处理SKNO-1、MOLM-13 6、12、24 h,CCK-8检测细胞活力及增殖抑制率情况。细胞分组:对照组、SC79组、氯普噻吨组、氯普噻吨+SC79组,对照组正常培养,SC79组添加终浓度为5 mg/L SC79处理细胞2 h,氯普噻吨组40 μmol/L氯普噻吨处理细胞12 h,氯普噻吨+SC79组在SC79组基础上添加40 μmol/L氯普噻吨处理细胞12 h。
1.2.3 CCK-8检测细胞增殖情况对数生长期SKNO-1、MOLM-13细胞稀释至1 × 105个/mL,接种至96孔板中,每孔100 μL,添加终浓度为0、20、40、60 μmol/L的氯普噻吨,分别在5%二氧化碳培养箱中37 ℃培养6、12、24 h时,添加10 μL CCK-8,继续培养2 h,同时仅含完全培养液设为空白孔,酶标仪在450 nm处测吸光度(optical density,OD)值,计算细胞增殖抑制率。细胞增殖抑制率(%)=(对照孔OD-实验孔OD)/(对照孔OD-空白孔OD)×100%。
1.2.4 MDC染色检测自噬的发生情况对数生长期SKNO-1、MOLM-13细胞稀释至5 × 104个/mL,接种至96孔板中,参考1.2.2各组处理方法,添加0.05 mmol/L MDC染料,37 ℃孵育1 h,荧光显微镜(激发滤光片365 nm、阻断滤光片430 nm)下观察,随机取100个细胞,计数含自噬小体细胞,并计算自噬小体阳性率。
1.2.5 流式细胞术检测细胞凋亡情况对数生长期SKNO-1、MOLM-13细胞接种至6孔板,每孔500 μL,参考1.2.4处理方法处理细胞,根据Annexin V-FITC细胞凋亡检测试剂盒说明书,加入195 μL Annexin V-FITC结合液、5 μL Annexin V-FITC轻轻混匀,添加10 μL碘化丙啶染色液,继续混匀,室温下避光20 min后流式细胞仪检测细胞凋亡情况。
1.2.6 蛋白质免疫印迹检测自噬、凋亡、Akt/mTOR通路相关蛋白表达情况蛋白裂解液提取细胞总蛋白,BCA试剂盒测定总蛋白浓度,每孔上样30 μg,凝胶电泳分离蛋白,经PVDF转膜、5%脱脂奶粉室温封闭后,加入一抗SQSTM1/p62(1∶20 000)、LC3B(1∶10 000)、PARP(1∶1 000)、caspase3(1∶5 000)、cleaved caspase3(1∶500)、Akt(1∶5 000)、p-Akt(1∶500)、mTOR(1∶5 000)、p-mTOR(1∶2 000)、GAPDH(1∶5 000),4 ℃过夜孵育;加羊抗兔二抗(1∶5 000),室温孵育2 h。电化学发光试剂显影后,凝胶成像分析系统拍照和定量分析。
1.3 统计学方法采用GraphPad Prism 9.0进行统计学分析。计量数据以平均数±标准差表示,多组间比较用单因素方差分析,进一步两两比较采用SNK-q法。以P< 0.05为差异有统计学意义。
2 结果
2.1 氯普噻吨对SKNO-1、MOLM-13细胞增殖的影响与0 μmol/L氯普噻吨相比,20、40、60 μmol/L氯普噻吨处理后细胞增殖抑制率升高(P< 0.05);与20 μmol/L氯普噻吨相比,40、60 μmol/L氯普噻吨处理后细胞增殖抑制率升高(P< 0.05);与40 μmol/L氯普噻吨相比,60 μmol/L氯普噻吨处理后细胞增殖抑制率升高(P< 0.05)。见表1。在同一时间点,随着氯普噻吨浓度的升高,SKNO-1、MOLM-13细胞增殖抑制率升高;且随着时间的延长,20、40、60 μmol/L氯普噻吨处理后SKNO-1、MOLM-13细胞增殖抑制率升高。40 μmol/L氯普噻吨处理12 h进行接下来研究。
表1 氯普噻吨对SKNO-1、MOLM-13增殖抑制率的影响Tab.1 Effects of cloprothixene on the proliferation inhibition rates of SKNO-1 and MOLM-13 ±s,%

表1 氯普噻吨对SKNO-1、MOLM-13增殖抑制率的影响Tab.1 Effects of cloprothixene on the proliferation inhibition rates of SKNO-1 and MOLM-13 ±s,%
注:与0 μmol/L氯普噻吨相比,*P < 0.05;与20 μmol/L氯普噻吨相比,#P < 0.05;与40 μmol/L氯普噻吨相比,△P < 0.05
氯普噻吨浓度SKNO-1 MOLM-13 0 μmol/L 20 μmol/L 40 μmol/L 60 μmol/L F值P值24 h 3.83 ± 0.47 34.15 ± 5.15*64.49 ± 5.48*#79.85 ± 8.33*#△215.958 0.000 6 h 2.23 ± 0.56 13.46 ± 2.49*35.49 ± 6.25*#57.49 ± 8.16*#△128.278 0.000 12 h 2.45 ± 0.48 19.58 ± 2.56*48.29 ± 6.45*#77.56 ± 7.18*#△261.739 0.000 24 h 2.34 ± 0.51 39.56 ± 8.15*67.25 ± 8.48*#84.27 ± 9.13*#△138.469 0.000 6 h 3.75 ± 0.58 14.85 ± 2.73*30.68 ± 4.12*#48.95 ± 5.34*#△174.126 0.000 12 h 3.67 ± 0.49 19.35 ± 2.48*46.29 ± 4.16*#61.65 ± 7.13*#△182.066 0.000
2.2 氯普噻吨对SKNO-1、MOLM-13细胞中自噬小体的影响与对照组相比,SC79组自噬小体阳性率降低(P< 0.05),氯普噻吨组自噬小体阳性率升高(P< 0.05);与SC79组相比,氯普噻吨+SC79组自噬小体阳性率升高(P< 0.05);与氯普噻吨组相比,氯普噻吨+SC79组自噬小体阳性率降低(P< 0.05)。见图1、表2。
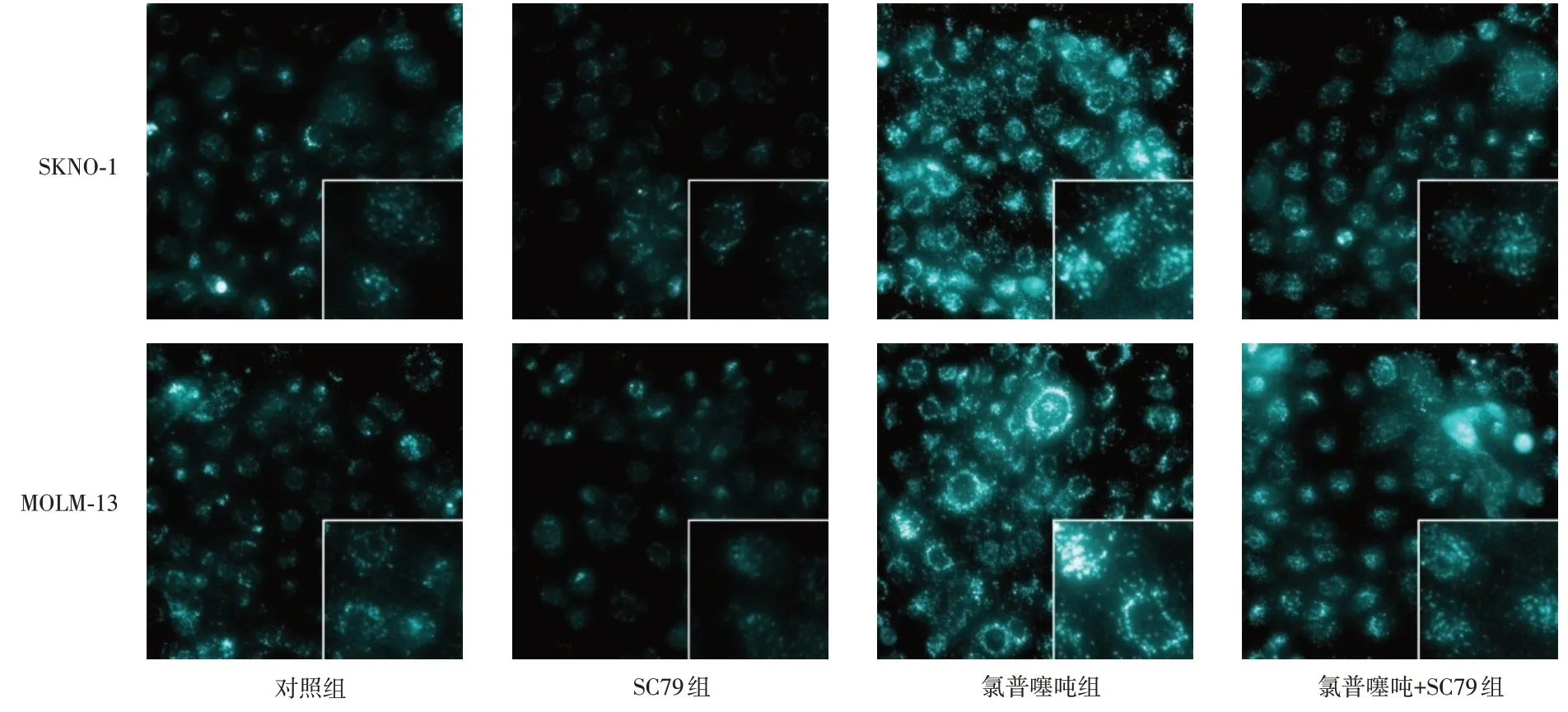
图1 MDC染色检测SKNO-1、MOLM-13细胞中自噬小体情况(×400,×1 000)Fig.1 Autophagosome detection in SKNO-1 and MOLM-13 cells by MDC staining (×400,×1 000)
表2 氯普噻吨对SKNO-1、MOLM-13细胞中自噬小体阳性率的影响Tab.2 Influence of cloprothixene on positive rate of autophagosomes in SKNO-1 and MOLM-13 cells ±s,%

表2 氯普噻吨对SKNO-1、MOLM-13细胞中自噬小体阳性率的影响Tab.2 Influence of cloprothixene on positive rate of autophagosomes in SKNO-1 and MOLM-13 cells ±s,%
注:与对照组相比,*P < 0.05;与SC79组相比,#P < 0.05;与氯普噻吨组相比,△P < 0.05
MOLM-13 24.68 ± 4.21 6.18 ± 0.73*73.25 ± 8.47*#47.36 ± 6.85*#△147.241 0.000组别对照组SC79组氯普噻吨组氯普噻吨+SC79组F值P值SKNO-1 11.86 ± 2.72 3.12 ± 0.46*62.58 ± 7.18*#27.26 ± 3.42*#△232.908 0.000
2.3 氯普噻吨对SKNO-1、MOLM-13细胞凋亡的影响与对照组相比,SC79组细胞凋亡率降低(P< 0.05),氯普噻吨组细胞凋亡率升高(P< 0.05);与SC79组相比,氯普噻吨+SC79组细胞凋亡率升高(P< 0.05);与氯普噻吨组相比,氯普噻吨+SC79组细胞凋亡率降低(P< 0.05)。见图2、表3。

图2 流式细胞术检测SKNO-1、MOLM-13细胞凋亡情况Fig.2 Apoptosis of SKNO-1 and MOLM-13 cells was detected by flow cytometry
表3 氯普噻吨对SKNO-1、MOLM-13细胞凋亡率的影响Tab.3 Effects of cloprothixene on apoptosis rate of SKNO-1 and MOLM-13 cells ±s,%

表3 氯普噻吨对SKNO-1、MOLM-13细胞凋亡率的影响Tab.3 Effects of cloprothixene on apoptosis rate of SKNO-1 and MOLM-13 cells ±s,%
注:与对照组相比,*P < 0.05;与SC79组相比,#P < 0.05;与氯普噻吨组相比,△P < 0.05
MOLM-13 11.36 ± 2.31 4.65 ± 0.62*43.68 ± 5.29*#29.86 ± 3.22*#△171.612 0.000组别对照组SC79组氯普噻吨组氯普噻吨+SC79组F值P值SKNO-1 13.86 ± 3.14 6.38 ± 1.23*57.86 ± 6.38*#35.46 ± 5.33*#△160.428 0.000
2.4 氯普噻吨对SKNO-1、MOLM-13细胞中SQSTM1/p62、LC3B、PARP、caspase3、cleaved caspase3、Akt、p-Akt、mTOR、p-mTOR蛋白表达的影响与对照组相比,SC79组SQSTM1/p62、p-Akt/Akt、p-mTOR/mTOR蛋白水平升高(P< 0.05),LC3B、PARP、cleaved caspase3/caspase3蛋白水平降低(P< 0.05),氯普噻吨组SQSTM1/p62、p-Akt/Akt、p-mTOR/mTOR蛋白水平降低(P< 0.05),LC3B、PARP、cleaved caspase3/caspase3蛋白水平升高(P< 0.05);与SC79组相比,氯普噻吨+SC79组SQSTM1/p62、p-Akt/Akt、p-mTOR/mTOR蛋白水平降低(P< 0.05),LC3B、PARP、cleaved caspase3/caspase3蛋白水平升高(P< 0.05);与氯普噻吨组相比,氯普噻吨+SC79组SQSTM1/p62、p-Akt/Akt、pmTOR/mTOR蛋白水平升高(P< 0.05),LC3B、PARP、cleaved caspase3/caspase3蛋白水平降低(P< 0.05)。见图3、表4、5。

图3 蛋白免疫印迹检测SKNO-1、MOLM-13细胞中SQSTM1/p62、LC3B、PARP、caspase3、cleaved caspase3、Akt、p-Akt、mTOR、p-mTOR蛋白表达情况Fig.3 Protein Western blot detection of SQSTM1/p62,LC3B,PARP,caspase3,cleaved caspase3,Akt,p-Akt,mTOR,p-mTOR protein expression in SKNO-1 and MOLM-13 cells
表4 氯普噻吨对SKNO-1细胞中SQSTM1/p62、LC3B、PARP、caspase3、cleaved caspase3、Akt、p-Akt、mTOR、p-mTOR蛋白表达的影响Tab.4 Effects of cloprothixene on expression of SQSTM1/p62,LC3B,PARP,caspase3,cleaved caspase3,Akt,p-Akt,mTOR,p-mTOR in SKNO-1 cells ±s

表4 氯普噻吨对SKNO-1细胞中SQSTM1/p62、LC3B、PARP、caspase3、cleaved caspase3、Akt、p-Akt、mTOR、p-mTOR蛋白表达的影响Tab.4 Effects of cloprothixene on expression of SQSTM1/p62,LC3B,PARP,caspase3,cleaved caspase3,Akt,p-Akt,mTOR,p-mTOR in SKNO-1 cells ±s
注:与对照组相比,*P < 0.05;与SC79组相比,#P < 0.05;与氯普噻吨组相比,△P < 0.05
组别对照组SC79组氯普噻吨组氯普噻吨+SC79组F值P值p-mTOR/mTOR 0.85 ± 0.09 1.03 ± 0.11*0.43 ± 0.05*#0.69 ± 0.08*#△53.443 0.000 SQSTM1/p62 1.23 ± 0.15 1.75 ± 0.27*0.43 ± 0.05*#0.76 ± 0.08*#△75.987 0.000 LC3B 0.37 ± 0.05 0.16 ± 0.05*0.96 ± 0.11*#0.61 ± 0.07*#△128.618 0.000 PARP 0.49 ± 0.05 0.28 ± 0.09*1.09 ± 0.15*#0.83 ± 0.11*#△68.403 0.000 cleaved caspase3/caspase3 0.51 ± 0.09 0.09 ± 0.03*0.89 ± 0.13*#0.71 ± 0.09*#△83.388 0.000 p-Akt/Akt 0.81 ± 0.08 0.98 ± 0.09*0.41 ± 0.06*#0.66 ± 0.05*#△68.078 0.000
表5 氯普噻吨对MOLM-13细胞中SQSTM1/p62、LC3B、PARP、caspase3、cleaved caspase3、Akt、p-Akt、mTOR、p-mTOR蛋白表达的影响Tab.5 Effects of cloprothixene on expression of SQSTM1/p62,LC3B,PARP,caspase3,cleaved caspase3,Akt,p-Akt,mTOR and p-mTOR in MOLM-13 cells ±s

表5 氯普噻吨对MOLM-13细胞中SQSTM1/p62、LC3B、PARP、caspase3、cleaved caspase3、Akt、p-Akt、mTOR、p-mTOR蛋白表达的影响Tab.5 Effects of cloprothixene on expression of SQSTM1/p62,LC3B,PARP,caspase3,cleaved caspase3,Akt,p-Akt,mTOR and p-mTOR in MOLM-13 cells ±s
注:与对照组相比,*P < 0.05;与SC79组相比,#P < 0.05;与氯普噻吨组相比,△P < 0.05
组别对照组SC79组氯普噻吨组氯普噻吨+SC79组F值P值p-mTOR/mTOR 1.04 ± 0.09 1.23 ± 0.16*0.57 ± 0.07*#0.88 ± 0.09*#△41.949 0.000 SQSTM1/p62 1.09 ± 0.12 1.28 ± 0.12*0.43 ± 0.06*#0.86 ± 0.11*#△72.288 0.000 LC3B 0.41 ± 0.05 0.26 ± 0.03*0.81 ± 0.09*#0.57 ± 0.09*#△67.786 0.000 PARP 0.41 ± 0.05 0.21 ± 0.03*0.97 ± 0.13*#0.74 ± 0.08*#△102.914 0.000 cleaved caspase3/caspase3 0.42 ± 0.06 0.24 ± 0.04*0.87 ± 0.11*#0.66 ± 0.09*#△71.646 0.000 p-Akt/Akt 0.73 ± 0.09 0.96 ± 0.11*0.23 ± 0.04*#0.46 ± 0.08*#△85.929 0.000
3 讨论
白血病以异常造血细胞的恶性增殖、分化受阻、凋亡受到抑制为主要特征,其中AML是常见类型。随着药物研究的深入,研究[8]发现氯普噻吨在AML治疗中表现出一定优势,氯普噻吨在白血病中能够扰乱一些关键生物过程,如可影响细胞周期、细胞凋亡以及AML细胞自噬等,亦可减轻AML大鼠模型中肿瘤情况,推测氯普噻吨对于AML具有一定疗效。以往研究中氯普噻吨作为硫杂蒽类药物,具有镇静和抗呕吐等作用,主要用于治疗以抑郁、焦虑为主的精神分裂症、情感精神病性抑郁症等[13],而恶性肿瘤易感性与精神压力有关。
氯普噻吨作为多巴胺受体抑制剂,能够阻断中枢神经系统多巴胺通路中多巴胺受体从而发挥抗精神病作用,研究发现多巴胺受体拮抗剂可促进AMP活化蛋白激酶激活和调控癌细胞凋亡的关键因子,并可提高细胞自噬,影响细胞功能,参与癌症进展[14-15]。在白血病中,自噬受损会加速正常造血干细胞向白血病干细胞恶化,激活自噬能提高白血病细胞药物敏感性[16]。LC3在自噬中发挥重要作用,上调自噬相关蛋白LC3能够诱导自噬小体形成,下调SQSTM1/p62蛋白表达能够促进自噬流[17]。据报道,上调LC3-Ⅱ表达,抑制SQSTM1/p62表达可促进自噬体形成,进而对抗AML干细胞中的耐药性[18]。caspase家族参与细胞凋亡过程,其中caspase3能够剪切procaspase2、6、7、9,且可特异性剪切caspase底物PARP等,促进细胞凋亡[19]。本研究发现,在AML细胞中添加不同浓度氯普噻吨处理(6、12、24 h),细胞增殖受到不同程度的抑制,且自噬小体阳性率、细胞凋亡率均出现明显升高,表明氯普噻吨可促进AML细胞自噬和凋亡。进一步验证自噬、凋亡相关蛋白表达情况,发现与对照组比较,氯普噻吨处理后自噬标志基因LC3B-Ⅱ蛋白水平升高、SQSTM1/p62蛋白水平降低,提示氯普噻吨可促进自噬小体和自噬流形成,激活自噬;同时氯普噻吨组促凋亡蛋白caspase3处于激活状态,底物PARP处于高表达,进一步提示添加氯普噻吨可诱导细胞自噬,促进AML细胞凋亡。
Akt/mTOR通路抑制剂在AML治疗中表现出良好的疗效,作为自噬通路,激活该通路能够抑制自噬发生,抑制该通路能够诱导肿瘤细胞自噬性死亡[20];Akt/mTOR通路同时影响细胞凋亡,抑制该通路可抑制AML细胞增殖、促进细胞凋亡[21]。在本研究中,氯普噻吨处理AML细胞后,Akt/mTOR通路蛋白磷酸化水平受到抑制;在氯普噻吨基础上添加Akt激活剂SC79,Akt/mTOR通路蛋白磷酸化水平升高,且LC3B-Ⅱ、cleaved caspase3、PARP蛋白水平降低,SQSTM1/p62蛋白表达水平升高,自噬小体阳性率、细胞凋亡率降低,表明SC79可减弱氯普噻吨对AML细胞自噬和凋亡的促进作用;提示氯普噻吨通过抑制Akt/mTOR通路促进AML细胞自噬和凋亡,进而实现对疾病缓解。
综上所述,氯普噻吨能够抑制Akt/mTOR通路的表达,进而促进AML细胞自噬、凋亡,为氯普噻吨在AML治疗中的应用提供一定参考。但添加Akt激活剂后并不能完全抵消氯普噻吨的作用,氯普噻吨可能通过别的相关通路发挥作用,需要进一步研究加以探讨。

