红色邻米草菌S2-4-1HT摇瓶发酵产六氢环庚基灵菌红素的培养基配方优化
董乐,傅俊杰,李世琪,王芳,林晓思,黄兆斌
(1.福建省海洋藻类活性物质制备与功能开发重点实验室,福建 泉州 362000;2.泉州师范学院 海洋与食品学院,福建 泉州 362000)
灵红素(prodiginines,PGs)家族是一类由三吡咯结构组成的微生物生物碱类天然红色色素[1].PGs家族中的灵菌红素(prodigiosin,PG)于粘质沙雷氏菌(Serratiamarcescens)中首次被发现[2],并从该菌中分离出PG纯品,确定PG分子式为C22H29N3O[1].目前,PGs已被发现存在于沙雷氏菌属(Serratia)[3]、假单胞菌属(Pseudomonas)[4]、弧菌属(Vibrio)[5]、霍氏菌属(Hahella)[6]、假交替单胞菌属(Pseudoalteromonas)[7]、紫色杆菌属(Janthinobacterium)[8]、链霉菌属(Streptomyces)[9]、邻米草菌属(Spartinivicinus)[10]、无色杆菌属(Achromobacter)[11]和李氏红色菌属(Zooshikella)[12]等多种微生物中.据报道,已鉴定结构的PGs包括PG、十一烷基灵菌红素、环庚基灵菌红素(heptylprodigiosin,hPG)、间环灵菌红素、链玉红菌素B、灵菌红素R1、壬基灵菌红素、甲基环庚基灵菌红素、类灵菌红素以及盐酸环状灵菌红素等[13].本实验室从红色邻米草菌(Spartinivicinusruber)菌株S2-4-1HT中分离鉴定获得六氢环庚基灵菌红素(six hydrogen cycloheptane prodigiosin,ShcPG),分子式为C22H27N3O[10].PG、十一烷基灵菌红素和类灵菌红素属于线性三吡咯结构,其他灵红素属于环状三吡咯结构[10-11].PGs被证明具有抗痢疾内变形虫[1]、抗肿瘤[14]、抗炎症细胞因子[15]、神经调节[15]、抗氧化[15-16]、抗细菌[16]、抗真菌[17]、抗病毒[18]、抗疟疾[19]、抗克氏锥虫[20]、抗寄生虫[21]、免疫抑制[22]、杀藻[23]和降解塑化剂[24]等作用.值得关注的是,PGs对正常细胞系具有低毒性或无毒性[16].在PGs的研究与开发上,PG相对较为深入.PG不仅被用于各种癌症的实验药物,且被用作先导物合成了一种灵菌红素衍生物(GX15-070或简称obatoclax).Obatoclax被用于治疗晚期慢性淋巴细胞白血病的I期临床试验[18,25],并被证明具有良好的安全性[18].因此,PGs在临床药物开发、环境处理、食品添加剂制备等方面具有巨大的潜在应用价值,在全球市场上占有越来越重要的地位[26].
PGs可以通过化学合成和微生物生产进行制备.PGs化学合成的步骤多、反应成本高、合成速率低[26],而其微生物生产具有环境友好、条件温和、低成本、易于工业化的优点,因此,PGs的微生物生产被认为是其制备的发展方向[26].然而,在PGs的微生物生产中目前仍存在着产量低的问题[26].高水平的微生物发酵色素产品依赖于优良的微生物菌株和有效的发酵方法.PGs作为微生物的次生代谢产物,其生产取决于培养基组成、生产条件、发酵方法和微生物菌株等许多因素[27].
优化发酵工艺参数的一个经典方法是一次改变一个因素(如氮源、碳源、矿物质、pH值、温度等)而保持其他参数不变,但这一方法不仅耗时、费力,而且不能确定各种参数的同时交互作用[28].响应面法(response surface methodology,RSM)是同时考虑几个因素变化时优化工艺参数的最常用的统计工具,它不仅提供了关于直接效应、成对组合交互效应和变量参数的曲线变量效应的全面知识[29],而且省时省力.
本实验室从红色邻米草菌菌株S2-4-1HT中分离鉴定了hPG和ShcPG(以下称hPG+ShcPG),其中ShcPG为首次发现,ShcPG的含量占hPG+ShcPG总含量的70%以上,并且ShcPG对肿瘤细胞A549的半抑制浓度(half-inhibitory concentration,IC50)值为(0.2261±0.0261) μmol/L,其抑制效果为PG的25倍、顺铂的42倍[10].因此,ShcPG具有极高的研究价值和抗肿瘤新药开发潜力.目前,国内PG的价格高昂,1 mg 98%纯度PG的价格约3 000元,限制了其进一步的开发和应用,如何优化微生物发酵条件提高PG产率依然是国内外学者的研究重点[30].ShcPG的研究重点在于:如何优化S.ruber菌株S2-4-1HT通过摇瓶发酵产ShcPG的工艺,以提高ShcPG的产率.本研究通过单因素试验对菌株S2-4-1HT发酵工艺的培养基配方进行考察,在此基础上通过RSM实验对菌株S2-4-1HT的hPG+ShcPG摇瓶发酵培养基配方进行优化,以期得到稳定可靠的菌株S2-4-1HT摇瓶发酵产hPG+ShcPG的发酵工艺参数数据,旨在为ShcPG的工业化生产提供科学依据.
1 材料与方法
1.1 材料与试剂
红色邻米草菌(S.ruber)菌株S2-4-1HT,由本实验室分离鉴定并保藏于中国海洋微生物菌种保藏管理中心(保藏编号:MCCC 1K03745T=KCTC 72148T),已完成对该菌株的形态学观察、生理生化鉴定、16S rDNA鉴定.PG(相对分子质量为350)、ShcPG(相对分子质量为352),纯度均达98%以上,由本实验室纯化制备,华侨大学分析测试中心核磁鉴定;金龙鱼纯正花生油,嘉里粮油(青岛)有限公司生产;海生菌肉汤2216(Marine Broth 2216,MB)和琼脂粉,生物级,美国Becton,Dickinson and Company公司生产;酵母粉胰蛋白胨,生物级,美国OXOID公司生产;其他试剂均为国药集团化学试剂有限公司生产,分析纯.
1.2 实验方法
1.2.1 菌种活化 将本实验室保存的菌株解冻后划线接种于MB的固体培养基上,于28 °C恒温条件下培养48~72 h.挑取生长状态好的红色单菌落于MB的液体培养基中,于28 °C、160 r/min振荡培养48 h,待培养液呈红色后于4 °C冷藏,备用.其中,配制每升MB液体培养基,应在(多少)mL去离子水中加入37.4 g MB粉;配制每升MB固体培养基,应在每升MB液体培养基中加入15.0 g琼脂粉.
1.2.2 发酵培养基的优化 (1)发酵基础培养基中碳源氮源的确定.按照MB培养基成分配方,在其他成分不变的情况下,将碳源分别替换为葡萄糖和花生油,氮源分别替换为酵母粉、蛋白胨,并将碳源氮源进行两两组合配制成4种发酵基础培养基,其中碳源和氮源的浓度均为5 mg/mL.4种发酵基础培养基经高压灭菌温度降至室温后,按1∶400的比例分别接入1.2.1中活化备用的菌液,于28 °C、160 r/min振荡培养48 h后,提取发酵液中hPG+ShcPG产物并进行含量的测定.比较不同碳源氮源组合对hPG+ShcPG产量的影响,选择最优的碳源氮源组合进行单因素试验.
(2)发酵培养基单因素试验.按照MB培养基成分配方,其他成分不变,主要考察无水氯化钙(以下简称氯化钙)、六水合氯化镁(以下简称氯化镁)和柠檬酸铁的添加量等因素对发酵液中hPG+ShcPG产量的影响.因素水平见表1.

表1 发酵培养基单因素试验因素水平
(3)发酵培养基的RSM实验设计.根据Box-Behnken中心组合试验设计原理,综合单因素试验结果,选取氯化钙、氯化镁、柠檬酸铁的添加量作为自变量,以S.ruber菌株S2-4-1HT发酵液中hPG+ShcPG的质量浓度为响应值,进行3因素3水平的RSM中心组合设计,优化摇瓶发酵hPG+ShcPG的培养基配方.试验因素和水平见表2.

表2 发酵培养基优化试验的因素水平
1.3 发酵液中hPG+ShcPG产量的测定
1.3.1 标准曲线的绘制 以hPG+ShcPG纯品为标准样品,以其无水乙醇溶液的质量浓度为横坐标,于535 nm下的吸光度(A535)值为纵坐标,绘制标准曲线,得到回归方程为y=0.123 4x+0.012 5(R2=0.999 1),表明hPG+ShcPG纯品质量浓度在0.547 0~7.020 0 mg/L时,A535值和hPG+ShcPG的质量浓度呈现良好的线性关系.
1.3.2 发酵液中hPG+ShcPG产量的测定 发酵完成后,将S.ruber菌株S2-4-1HT发酵液和乙酸乙酯按照1∶1体积混合,充分超声破碎菌体细胞,静置后取8 mL上清液于10 000 r/min离心5 min.将离心后上清液全部移至另一离心管中,待乙酸乙酯挥发完全即获得hPG+ShcPG产物.用无水乙醇溶解hPG+ShcPG产物并全部转移到10 mL比色管中,定容至5 mL.定容后的溶液于10 000 r/min离心5 min,移取上清液,采用比色法测定溶液中的hPG+ShcPG产量.
1.4 数据处理
所有实验的重复次数均为3次,数据表示为平均值±标准差.采用Design-Expert 8.0.6分别对发酵培养基配方和发酵条件进行RSM试验设计、方差分析及二次方差分析、绘制等高线图和响应曲面图,采用Microsoft Office 2019进行基本的图表制作、绘制单因素试验相关曲线图.
2 实验结果与分析
2.1 发酵基础培养基中碳源氮源的确定
不同碳源氮源组合下hPG+ShcPG的产量见表3.由表中可知,在相同碳源和氮源浓度下,花生油和蛋白胨组合培养时S.ruber菌株S2-4-1HT发酵液中hPG+ShcPG浓度最大,且与其他组合相比差异有统计学意义.

表3 不同碳源氮源组合下hPG+ShcPG的产量
2.2 发酵培养基单因素试验
2.2.1 花生油添加量对hPG+ShcPG产量的影响 花生油添加量对S.ruber菌株S2-4-1HT发酵产hPG+ShcPG产量的影响见图1.由图可知,当发酵培养基中花生油添加量在(0.5~2.0) mg/mL时,hPG+ShcPG产量呈上升趋势;当花生油浓度大于4.0 mg/mL时,hPG+ShcPG产量开始降低;并且当花生油添加量为2.0 mg/mL时,S.ruber菌株S2-4-1HT发酵产hPG+ShcPG的产量达最大值.因此,发酵培养基中的花生油添加量在(1.0~4.0) mg/mL时适合S.ruber菌株S2-4-1HT发酵产hPG+ShcPG.

图1 不同花生油添加水平下hPG+ShcPG产量 图2 不同蛋白胨添加水平下hPG+ShcPG产量
2.2.2 蛋白胨添加量对hPG+ShcPG产量的影响 蛋白胨添加量对S.ruber菌株S2-4-1HT发酵产hPG+ShcPG产量的影响见图2.由图可知,当发酵培养基中的蛋白胨添加量为0.5~4.0 mg/mL时,S.ruber菌株S2-4-1HT发酵产hPG+ShcPG产量呈上升趋势;当蛋白胨添加量为4.0~8.0 mg/mL时,hPG+ShcPG的产量呈下降趋势;当蛋白胨添加量为4.0 mg/mL时,S.ruber菌株S2-4-1HT发酵产hPG+ShcPG产量达最大值.因此,发酵培养基中的蛋白胨添加量为2.0~8.0 mg/mL时适合S.ruber菌株S2-4-1HT发酵产hPG+ShcPG.
2.2.3 氯化钙添加量对hPG+ShcPG产量的影响 氯化钙添加量对S.ruber菌株S2-4-1HT发酵产hPG+ShcPG产量的影响见图3.由图可知,当发酵培养基中的氯化钙添加量为0.05~0.45 mg/mL时,S.ruber菌株S2-4-1HT发酵产hPG+ShcPG产量呈上升趋势;当氯化钙添加量大于1.35 mg/mL时,hPG+ShcPG的产量急剧下降,并且当氯化钙添加量为0.45 mg/mL时,S.ruber菌株S2-4-1HT发酵产hPG+ShcPG产量达最大值,因此在S.ruber菌株S2-4-1HT发酵产hPG+ShcPG发酵的RSM法优化分析确定最佳工艺参数水平时,培养基中的氯化钙添加量适合选择在0.05~1.35 mg/mL.

图3 不同氯化钙添加水平下hPG+ShcPG产量 图4 不同氯化镁添加水平下hPG+ShcPG产量
2.2.4 氯化镁添加量对hPG+ShcPG产量的影响 氯化镁添加量对S.ruber菌株S2-4-1HT发酵产hPG+ShcPG产量的影响见图4.由图可知,当发酵培养基中的氯化镁添加量为0.0~6.0 mg/mL时,S.ruber菌株S2-4-1HT发酵产hPG+ShcPG产量呈上升趋势;当氯化镁添加量大于6.0 mg/mL时,hPG+ShcPG的产量开始下降;当氯化镁添加量为6.0 mg/mL时,S.ruber菌株S2-4-1HT发酵产hPG+ShcPG产量达最大值.因此,在S.ruber菌株S2-4-1HT发酵产hPG+ShcPG发酵的RSM法优化分析确定最佳工艺参数水平时,培养基中的氯化镁添加量适合选择在0.0~12.0 mg/mL.
2.2.5 柠檬酸铁添加量对hPG+ShcPG产量的影响 柠檬酸铁添加量对S.ruber菌株S2-4-1HT发酵产hPG+ShcPG产量的影响见图5.由图可知,当发酵培养基中的柠檬酸铁添加量为0.02~0.10 mg/mL时,S.ruber菌株S2-4-1HT发酵产hPG+ShcPG产量呈上升趋势;当柠檬酸铁添加量大于0.50 mg/mL时,hPG+ShcPG的产量开始下降;当柠檬酸铁添加量为0.10 mg/mL时,S.ruber菌株S2-4-1HT发酵产hPG+ShcPG产量达最大值.因此,在S.ruber菌株S2-4-1HT发酵产hPG+ShcPG发酵的RSM法优化分析确定最佳工艺参数水平时,培养基中的柠檬酸铁添加量适合选择在0.02~0.50 mg/mL.
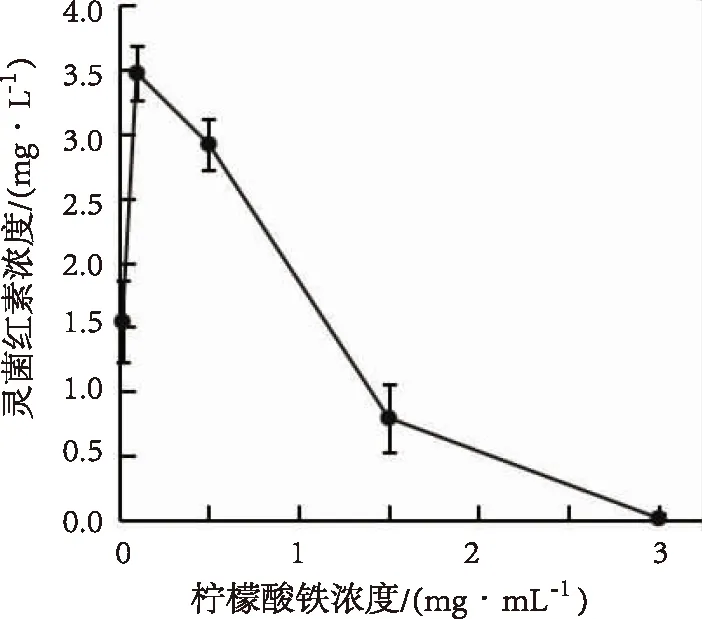
图5 不同柠檬酸铁添加水平hPG+ShcPG产量
2.3 发酵培养基配方RSM法优化分析
2.3.1 试验设计与最佳工艺参数确定 在单因素试验的基础上,依据中心组合设计原理,采用3 因素3 水平的RSM分析法,以发酵液中hPG+ShcPG质量浓度为响应值,结果见表4.

表4 酵培养基RSM法试验设计及结果
利用Design-Expert 8.0.6对响应面试验结果进行二次多元回归分析,试验结果如表5,得到hPG+ShcPG质量浓度的回归方程为
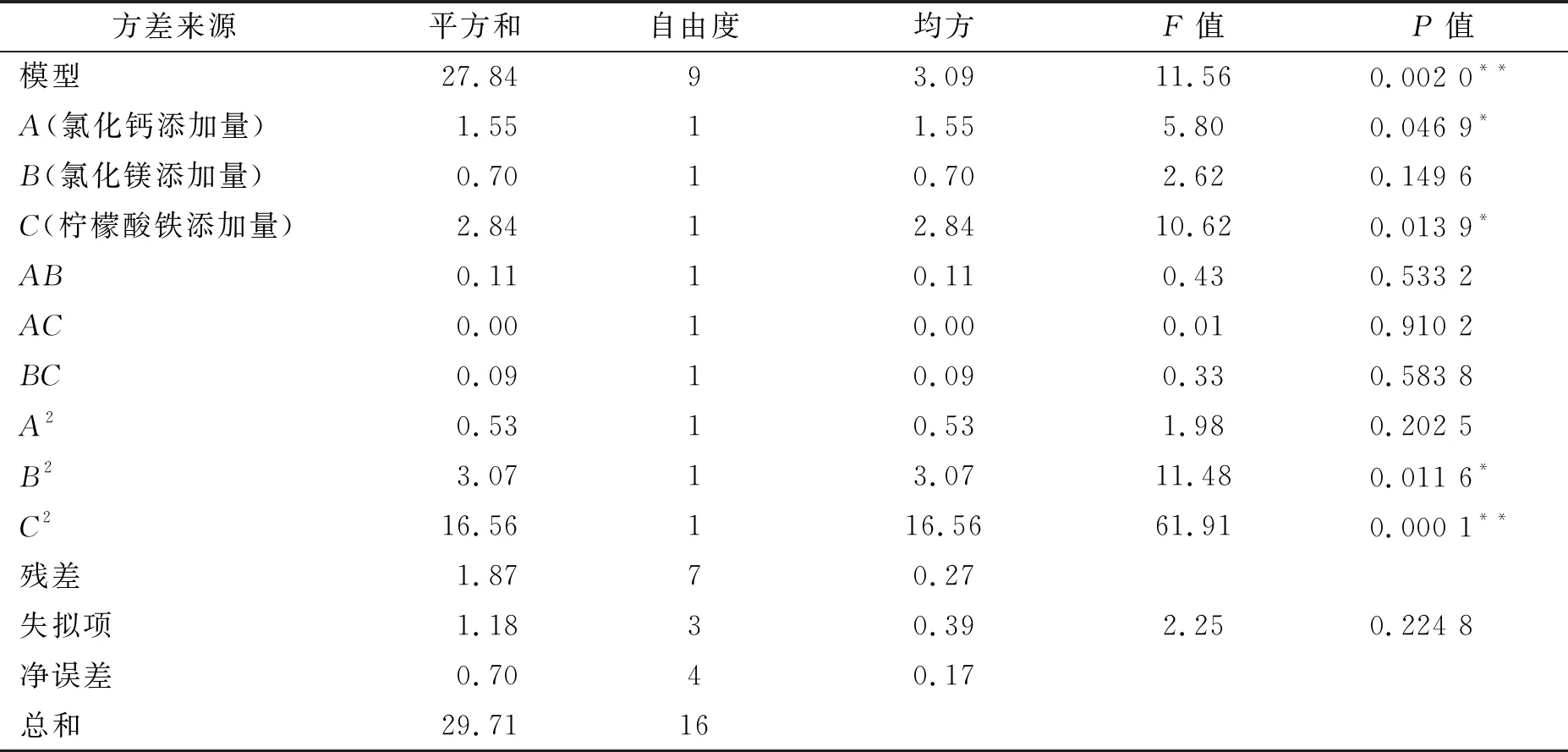
表5 hPG+ShcPG发酵培养基RSM中心组合设计的方差分析
Y=4.43+0.54A-0.50B-0.73C+0.17AB+0.03AC-0.15BC-0.35A2-0.85B2-1.98C2.

根据响应面试验结果建立的回归方程进行分析和拟合,得到响应面对应的等高线图和响应曲面图,见图6.响应面图中若图形越陡峭,则说明两因素间的交互作用影响越显著;若图形越平坦反而影响越不显著.等高线图可以根据其图形的形状来判断其交互影响的程度,若图形为椭圆且密集则交互现象越明显.

图6 氯化钙、氯化镁与柠檬酸铁的添加水平对hPG+ShcPG产量影响的响应曲面图(A)和等高线图(B)
由响应面分析图分析3个因素对S.ruber菌株S2-4-1HT发酵产hPG+ShcPG产量的作用.图6(1)和图6(2)中三维曲面图较平缓,且图6(1)和图6(2)等高线图形接近圆形,表明氯化钙和氯化镁的添加量、氯化镁和柠檬酸铁的添加量的交互作用的影响无统计学意义(P>0.05).图6(3)中高线图形接近椭圆形,但图6(3)三维曲面图较平缓,表明氯化钙和柠檬酸铁的添加量的交互作用的影响无统计学意义(P>0.05).
若将B和二次项A2、交互项AB、AC、BC从回归方程中剔除,且将其平方和和自由度并入实验误差,进行第二次方差分析,结果见表6.

表6 hPG+ShcPG发酵培养基RSM中心组合设计的二次方差分析
二次方差分析表明,各项均有统计学意义(P<0.05)且失拟项无统计学意义(P>0.05).因此hPG+ShcPG质量浓度的回归方程为
Y=4.30+0.45A-0.66C-0.53B2-2.02C2.
在3个试验因素的编码范围内,Excel规划求解得到发酵液中hPG+ShcPG产量的最佳发酵培养基配方为:氯化钙、氯化镁和柠檬酸铁的质量浓度分别为1.35、9.00、0.22 mg/mL.在最佳发酵培养基配方条件下hPG+ShcPG产量预测值为4.81 mg/L.
2.3.2 最佳发酵培养基工艺参数验证性试验 按照MB培养基成分配方,其他成分不变,氯化钙、氯化镁和柠檬酸铁的质量浓度分别为1.35、9.00和0.22 mg/mL的配方工艺下,S.ruber菌株S2-4-1HT发酵产hPG+ShcPG产量的验证值为(4.86±0.30) mg/L(n=3),与预测值接近(P<0.05),证明了RSM法优化S.ruber菌株S2-4-1HT发酵产hPG+ShcPG的最佳培养基配方的可行性.
3 结论
S.ruber菌株S2-4-1HT发酵产hPG+ShcPG的培养基配方优化为:花生油、蛋白胨、氯化钙、氯化镁和柠檬酸铁的质量浓度分别为2.00、4.00、1.35、9.00、0.22 mg/mL.在最佳发酵培养基配方工艺下发酵48 h,hPG+ShcPG的产量为(4.86±0.30) mg/L,是用MB培养基培养产量的19.44倍,且预测值和测定值的绝对差值小于5%,表明回归模型可靠.

