紫球藻胞外多糖酶解物的纯化、红外鉴定及其抗氧化活性
黄卫红,董乐*
(1.福建省海洋藻类活性物质制备与功能开发重点实验室,福建 泉州 362000;2. 泉州师范学院 海洋与食品学院,福建 泉州 362000)
多糖作为一种天然高分子聚合物,具有广泛的药理活性,如抗氧化、抗病毒、提高免疫力等活性[1-4].近年来,对天然多糖抗氧化活性的研究已成为焦点,其抗氧化机制也被相继报道[4-10].研究表明,外源多糖能够通过提高氧化应激调节因子Nrf2(Nuclearfactor erythroidderived 2-like 2)的表达量进而诱导抗氧化基因或抗氧化酶表达,也能直接诱导抗氧化酶的表达[5-7],而高表达的抗氧化基因或抗氧化酶可以进一步阻断自由基链式反应,从而减少自由基产生[8-9].其次,外源多糖通过抑制诱导型-氧化氮合酶(inducible nitric oxide synthase, iNOS)表达并减少NO产生,能够显著提高机体抗氧化能力,减轻氧化应激损伤[4,10].
随着海洋生物技术的发展和微藻天然活性产物的深入研究,微藻多糖包括抗氧化活性在内的生物活性也备受关注[11-12].紫球藻胞外多糖(exopolysaccharide fromPorphyridiumcruentum, EPC)是一种来自紫球藻胞外分泌的高分子硫酸化多糖[13],因其具有抗病毒[14]、抗氧化[15]、抗炎症[16]和降胆固醇[17]等多种基本生物活性,被广泛用于保健食品和制药行业[18-19].对EPC的抗氧化活性研究发现,EPC对各种自由基具有较强的清除能力,且其对自由基的清除能力与相对分子质量大小显著关性[20-21].表明EPC和其他大分子多糖一样,低溶解和高黏度等特性使其生物学构象和生物活性受到限制[22].天然多糖结构和活性的关系研究表明,大分子多糖被降解为小分子多糖后其生物活性均会显著增加[22],利用酶解技术和分级纯化方法是获得小分子多糖的主流方法[23-25].然而,目前对EPC的抗氧化等生物活性的评价主要以多糖粗提物为研究对象[21,26],对其酶解或分级纯化后抗氧化活性的研究鲜有报道.

1 材料与方法
1.1 材料与试剂
紫球藻藻种,中国科学院海洋研究所藻种库;非洲大蜗牛消化道混合酶,1 874.52 U·g-1,泉州师范学院福建省海洋藻类活性物质制备与功能开发重点实验室;纤维素DE-52(DEAE-52)、快流速Q琼脂糖凝胶(Q SepharoseTMFast Flow)、水溶性维生素E(Trolox),美国Sigma-Aldrich公司;偶氮二异丁脒盐酸盐(AAPH)、1,1-二苯基-2-三硝基苯肼(DDPH·)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS·+),aladdin公司;荧光素钠盐(FL),上海MACK-LIN公司;其余试剂均为分析纯,国药集团化学试剂有限公司.
1.2 仪器设备
Allegra 64R型台式高速离心机,美国贝克曼库尔特有限公司;HH-6D型恒温水浴锅,金坛市城东宏业实验仪器厂;UV-1200型紫外可见分光光度计,上海美谱达仪器有限公司;LGJ-10D型冷冻干燥机,北京四环科学仪器厂有限公司;Nicolet iS 10型傅立叶红外光谱仪,美国Thermo Scientific公司;YP-2压片机,上海山岳科学仪器有限公司;Infinite 200 Pro型多功能酶标仪,瑞士Tecan公司;W2-100S型旋转蒸发仪,上海申生科技有限公司.
1.3 实验方法
1.3.1 多糖提取及酶解物制备 EPC的提取及酶解物制备均参照之前对EPC酶解物制备工艺优化的研究[24]进行.
1.3.2 多糖酶解物分离纯化及成分的初步鉴定 将EPC酶解物配制为40 mg·mL-1溶液,10 000 r·min-1离心2 min后取4 mL上清液加入已平衡好的DEAE-52层析柱(2.6 cm×40 cm),用pH为7.5的0~4 mol·L-1NaCl溶液进行线性洗脱,流速1.5 mL·min-1,每7.0 mL为1个流份,根据每个流份的多糖含量绘制洗脱曲线,合并单一峰组分阳性反应的高峰部分;将DEAE-52层析柱分离纯化的组分配制为20 mg·mL-1溶液,10 000 r·min-1离心2 min后取取5 mL上清液加入已平衡好的Q SepharoseTMFast Flow层析柱(3.0 cm×40 cm),用pH值为7.2的2~4 mol·L-1NaCl溶液进行线性洗脱,流速1.5 mL·min-1,每9.0 mL为1个流份,根据每个流份的多糖含量绘制洗脱曲线,合并单一峰组分阳性反应的高峰部分.紫外光谱法[27]和红外光谱法[28]分别用于鉴定纯化后不同组分的纯度和结构.
1.3.3 总糖含量和硫酸基含量测定 采用苯酚-硫酸比色法[29]分别对EPC粗品、EPC酶解物及其纯化组分的糖含量进行测定,标准品多糖浓度与吸光值的标准曲线为y=0.004 5x+0.018 4,R2=0.999 6.使用氯化钡-明胶比浊法[30]分别对EPC粗品、EPC酶解物及其纯化组分的硫酸基含量进行测定,硫酸基浓度与吸光值的标准曲线为y=0.001 8x+0.008 8,R2=0.999 1.
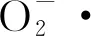
1.4 数据分析
所有实验均为3次重复,所得结果均以值±标准差表示.GraphPad Prism 9.0软件用于计算EPC酶解物及其纯化组分的浓度对各种自由基清除率的IC50值.
2 实验结果与分析
2.1 EPC酶解物分离纯化
EPC酶解物经DEAE-52柱层析洗脱后获得2个组分EPCⅠ和EPCⅡ,二者分别为较窄和较宽的洗脱尖峰,说明2个组分的总糖含量和纯度差异较大(图1).EPCⅠ和EPCⅡ经Q SepharoseTMFast Flow柱层析分离,EPCⅠ洗脱后获得4个组分EPCⅠ-QⅠ、EPCⅠ-QⅡ、EPCⅠ-QⅢ和EPCⅠ-QⅣ,4个组分被连续洗脱,相对分子质量较为接近,除EPCⅠ-QⅣ总糖含量较低外,其他3个组分的总糖含量也较为接近(图2).EPCⅡ洗脱后同样获得4个组分EPCⅡ-QⅠ、EPCⅡ-QⅡ、EPCⅡ-QⅢ和EPCⅡ-QⅣ,前3个组分被连续洗脱,相对分子质量较为接近,而EPCⅡ-QⅣ被单独洗脱,相对分子质量不同于前3个组分(图3).

图1 EPC酶解物经DEAE-52柱洗脱曲线
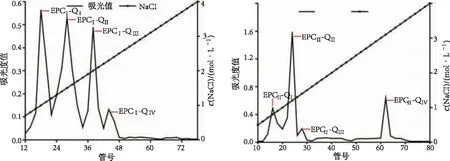
图2 EPCⅠ经Q SepharoseTM Fast Flow柱洗脱曲线 图3 EPCⅡ经Q SepharoseTM Fast Flow柱洗脱曲线
2.2 EPC酶解物及纯化组分的总糖质量分数和硫酸基质量分数
EPC酶解物及其纯化组分的总糖质量分数和硫酸基质量分数如表1所示.所有样品的总糖质量分数均大于30%,硫酸基质量分数均大于3%,表明EPC为一种硫酸化多糖.EPC经酶解后总糖质量分数和硫酸基质量分数均明显提高,说明酶解过程对EPC具有良好的纯化作用.EPC酶解物纯化后的EPCⅠ和EPCⅡ总糖质量分数差异较小,而二者的硫酸基质量分数变化明显.EPCⅠ纯化后组分的总糖质量分数和硫酸基质量分数降低;EPCⅡ纯化后除了EPCⅡ-QⅠ总糖质量分数明显提高外其他组分均有降低,EPCⅡ纯化后组分的硫酸基质量分数同样出现下降.表明柱层析纯化对EPC的总糖质量分数和硫酸基质量分数均有明显影响.

表1 EPC酶解物及纯化组分的总糖质量分数和硫酸基质量分数
2.3 EPC酶解物纯化组分的纯度鉴定
用紫外光谱分析EPC酶解物纯化后不同组分的纯度,结果见图4.在190~450 nm的波长范围内,所有多糖纯化组分的吸收峰均随着波长的增加而降低,在260 nm和280 nm处均无多肽、蛋白质和核酸的特征吸收峰,表明酶解和分级纯化能够有效去除EPC的非多糖杂质,所获得的多糖组分的纯度较高.

图4 EPC酶解物纯化后不同组分的紫外光谱图
2.4 EPC酶解物纯化组分的红外光谱分析
EPC酶解物不同纯化组分的红外光谱分析结果表明,所有纯化组分均在3 700~3 000 cm-1内具有较强的O-H伸缩振动,在1 620~1 670 cm-1内显示了较强的C=O非对称伸缩振动和N-H变角振动,在1 380~1 460 cm-1内均显示明显的C-H变角振动,这些吸收峰均为多糖物质的特征峰.992 ~1 160 cm-1内的O-H和C-O-C变角振动表明所有纯化组分均含有吡喃糖结构.EPCⅠ和EPCⅡ纯化后的组分在1 350 cm-1处均具有S=O伸缩振动,表明这些组分均含有硫酸基团,并在951~957cm-1内均显示了呋喃糖衍生物A型的吸收峰.此外,866 cm-1附近的吸收峰表明EPCⅠ和EPCⅡ纯化的后组分糖链中存在的糖苷键为β-构型.而EPCⅠ和EPCⅡ在783~786 cm-1处的微弱吸收峰可能是吡喃糖环结构的吸收峰.
2.5 EPC酶解物及纯化组分的抗氧化活性

表2 EPC酶解物及纯化组分对4种自由基的清除率的IC50值
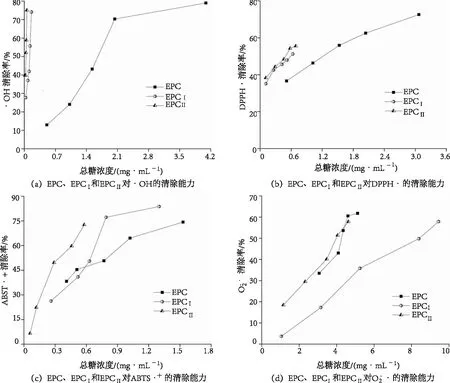
图5 EPC酶解物及纯化组分对4种自由基的清除能力
2.5.2 氧自由基吸收能力(ORAC) EPC酶解物及其纯化组分对氧自由基吸收能力(ORAC)的荧光淬灭动力学曲线见图6,ORAC值如表3所示.与EPC酶解物相比,EPCⅠ和EPCⅡ的ORAC值分别有所降低和升高,结合EPCⅡ对其他4种自由基的清除能力优于EPCⅠ的特性,表明EPCⅠ可能为1个综合抗氧化活性较差的大分子组分,而FPCⅡ则为1个综合抗氧化活性较高的小分子组分.EPCⅠ纯化后4个组分的ORAC值较EPCⅠ有所提高,但仍低于EPC酶解物和EPCⅡ.EPCⅡ纯化后EPCⅡ-QⅠ和EPCⅡ-QⅡ的ORAC值高于EPCⅡ,而EPCⅡ-QⅢ和EPCⅡ-QⅣ的ORAC值低于EPCⅡ.其中EPCⅡ-QⅠ的ORAC值高达(1 523.98±21.17) μmol ·g-1,分别是EPC酶解物、EPCⅠ和EPCⅡ的3.21、14.62和2.69倍.表明EPC经多级纯化后能够获得抗氧化活性更高的多糖组分.

表3 EPC酶解物及纯化组分的 ORAC 值

图6 EPC酶解物及纯化组分的荧光淬灭动力学曲线
3 讨论
本研究对EPC酶解物纯化组分的纯度、结构及纯化前后抗氧化活性的变化进行了分析,结果表明,EPC酶解物的两次分级纯化均获得多个不同多糖组分,其是由多个单糖及其衍生物形成的相对分子质量高的物质,具有一般天然多糖的高分子聚合性[2,34].高于30%的总糖质量分数及高于3%的硫酸基质量分数表明EPC为一种硫酸化多糖,与之前Geresh等[13]对EPC相对分子质量测定及流变性能的研究结果一致.酶解作用增加了EPC的纯度,使其总糖质量分数和硫酸基质量分数得以提高,说明酶解过程能够有效地去除天然多糖组分中的大部分非多糖类杂质[35].此外,本研究使用柱层析纯化后获得的EPC组分的总糖质量分数和硫酸基质量分数具有明显差异.紫外光谱扫描结果进一步表明了酶解和分级纯化后的EPC组分无多肽、蛋白质和核酸等杂质,均为高纯度的多糖组分[36].对比以往对天然多糖物质结构和官能团表征分析的研究结果[37-41],发现所有EPC组分均具有天然多糖物质的特征官能团,多糖结构以吡喃糖结构为主.然而仅在EPCⅠ和EPCⅡ纯化后的组分中检测到硫酸基团的S=O伸缩振动、呋喃糖衍生物A型的特征峰和β-构型糖苷键,表明多次分离纯化改变了EPC组分结构[22].

4 结论


