铁缺乏与肺动脉高压相关性的研究进展
王 鑫, 张 展, 刘 铎, 谢 萍
(1.甘肃中医药大学第一临床医学院,甘肃 兰州 730000;2.甘肃省人民医院 心内一科,甘肃 兰州 730000)
肺动脉高压(pulmonary arterial hypertension,PAH)被视为由各种原因引起的以肺血管压力升高为主的血管疾病,住院率及病死率高[1]。PAH涉及多种机制,即免疫炎性反应、缺氧诱发因素等[2]。PAH的自然病史是肺血管阻力增加和右心室衰竭,如不治疗会导致死亡[1]。关于PAH治疗主要从前列环素途径、内皮素途径和一氧化氮途径出发。研究发现[3],多数PAH患者血清铁处于低水平。小样本铁替代治疗PAH方面的临床研究或动物实验表明,铁替代治疗能提高活动耐力和生存率。本文收集近年来关于铁缺乏(iron deficiency,ID)与PAH相关性的研究文献,阐述PAH与ID的发病机制和疗效评估的最新研究进展,且强调铁剂的选择和利弊,为PAH的临床治疗提供理论支持。
1 PAH与ID的概述
成年人中,PAH患病率约为10.6/100万,且发病率随年龄增长而增加[1]。PAH的诊断是仰卧平静呼吸时,右心导管平均肺动脉压力>20 mmHg和肺血管阻力>2 WU[4]。这一定义与之前右心导管肺动脉压力≥25 mmHg的阈值不同,因为与≤20 mmHg相比,平均肺动脉压21~24 mmHg死亡率和住院风险更高[1]。PAH是肺高压的亚型,根据潜在原因,进一步可分为特发性PAH(idiopathic PAH,IPAH)、可遗传PAH、药物或毒素诱导的PAH、与某些疾病相关的PAH(结缔组织病、获得性免疫缺陷综合征感染、门脉高压症、先天性心脏病、血吸虫病)、对钙通道阻滞剂的长期应答的PAH、肺静脉闭塞性PAH和新生儿持续性PAH[1]。ID是人体铁含量降低的病理状态。PAH患者的ID定义为血清铁蛋白<100 μg/L 或血清铁蛋白100~299 μg/L和转铁蛋白饱和度(transferrin saturation,TSAT)<20%[5]。ID在PAH人群中约占40%[2]。据报道[5],无论是否存在贫血,PAH患者ID总会引起6min步行距离下降,以及氧气运输和处理能力的受损。
2 PAH与ID的发病机制
PAH常见的病理学特征是肺动脉内皮细胞功能障碍、肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)增殖和迁移,以及成纤维细胞活性失调。肺动脉内皮细胞功能障碍导致黏附能力、增殖和抗凋亡表型增加,促进了微血栓形成和血管壁增生。平滑肌细胞迁移导致其他非肌化远端毛细血管肌化,进一步加剧管腔变窄[6]。见图1。
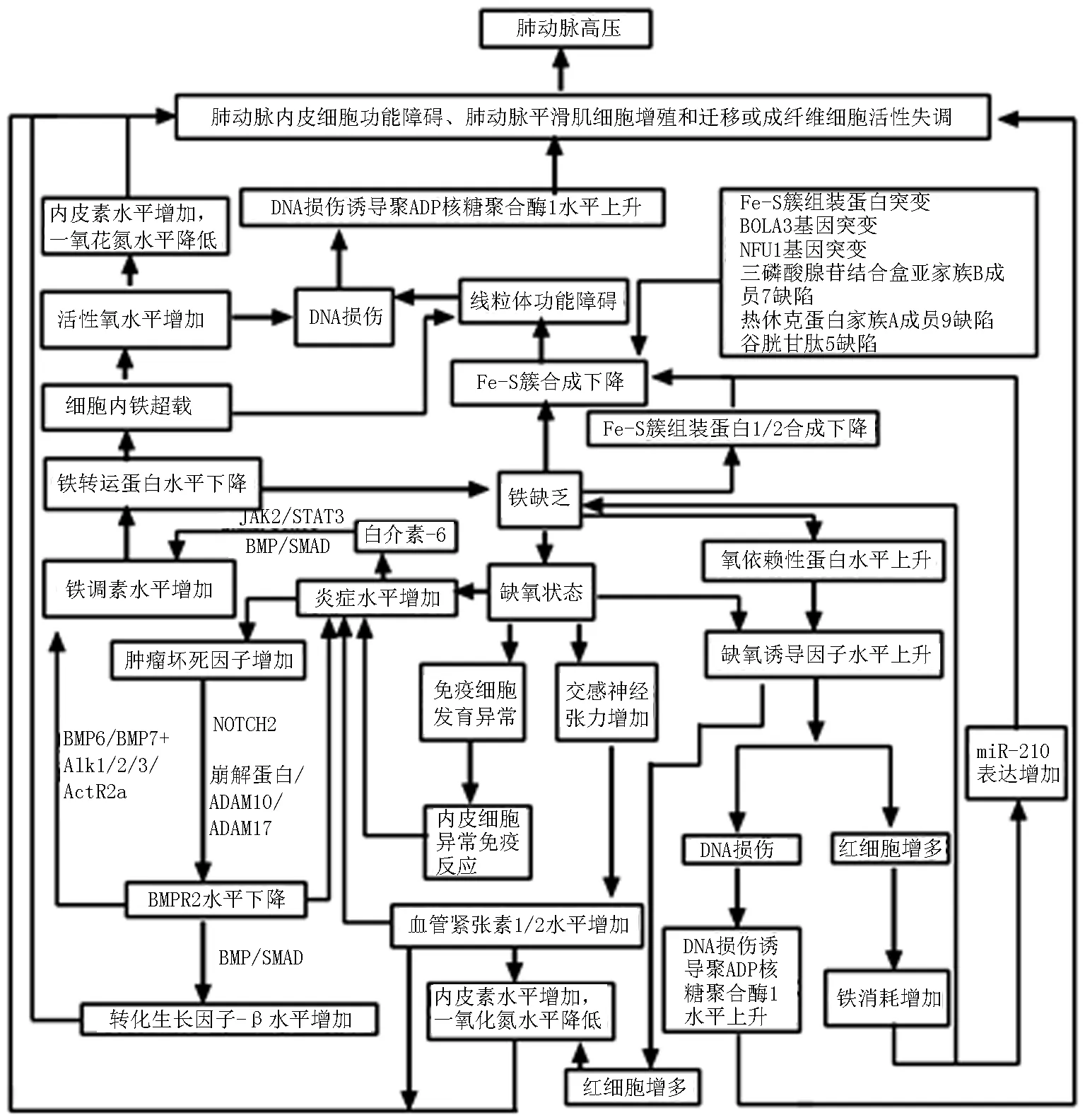
图1 PAH发生机制
2.1炎症及氧化应激 最近的研究[6]报告了肺血管重塑与血管周围炎症呈正相关。PAH肺血管炎症可诱导炎症因子白介素-6(interleukin,IL-6)升高,激活肝细胞内和膜结合的IL-6受体,通过JAK2/STAT3途径刺激铁调素表达[2]。在没有IL-6信号传导的情况下,IL-1β也会增加肝细胞铁调素的表达[2]。在分子水平上,铁调素与铁转运蛋白(ferroportin,FPN)的结合引起FPN受体泛素化、内化和降解,而FPN介导细胞铁的释放和肠道铁的吸收,FPN破坏引起铁的转运及代谢异常而在细胞内和肠道内积累,继而造成机体缺铁[7-8]。IL-6和细胞内高浓度铁,促进线粒体功能障碍和活性氧(reactive oxygen species, ROS)产生,最终引起脂质过氧化、DNA损伤和蛋白质变性等,这与PAH发生密切相关[7]。PAH啮齿动物模型中可见[9],ROS导致内皮细胞功能障碍,并伴有内皮素的过表达和一氧化氮合成酶途径的抑制。研究[10]表明,铁治疗可逆转ROS的不利作用。此外,炎症诱导的肿瘤坏死因子通过肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)中的崩解蛋白和金属蛋白酶ADAM10和ADAM17促进骨形态发生蛋白Ⅱ型受体(bone morphogenetic protein type-Ⅱ receptor,BMPR2)的裂解,且增加NOTCH2信号传导阻断BMPR2表达[10]。BMPR2受体是转化生长因子-β(transforming growth factor-β,TGF-β)超家族中的5-羟色胺/苏氨酸激酶受体,BMPR2功能障碍可通过激活TGF-β通路和增加炎性细胞因子产生促进血管重塑。此过程通过Smad信号传导发生[6, 11]。BMP/Smad信号传导是铁稳态系统调节的核心[2, 10]。当BMP与BMP受体复合物结合时,受体发生磷酸化并激活Smad,磷酸化的R-Smad与Smad4结合并转运到细胞核,激活铁调素编码基因的转录[11]。此外,在BMPR2功能丧失的情况下,II型BMP受体(即ActR2a)可能会代替BMPR2,BMP6和BMP7与Alk1/2/3/ActR2a结合后很可能上调铁调素表达[2]。PULSAR II期试验证实[6],通过平衡BMPR2成功降低了肺血管阻力并改善了6min步行试验(6 minute walk test,6MWT)、N末端脑钠肽前体(N-terminal pro-B-type natriuretic peptide,NT-proBNP)和WHO功能分级。
2.2缺氧 缺铁的模拟缺氧状态使缺氧诱导因子2α(hypoxia inducible factor2α,HIF2α)稳定存在。在缺氧条件下缺氧诱导因子(hypoxia inducible factor-1,HIF)调节缺氧基因表达,刺激肾脏分泌的促红细胞生成素(erythropoietin,EPO)诱导红细胞生成,从而增加肺内皮细胞中内皮素表达,促进收缩肺血管系统和肺血管细胞增殖[11-12]。同时,血红蛋白生成消耗铁进一步造成机体缺铁状态[11]。HIF-α的活化还可诱导DNA损伤。DNA损伤诱导聚二磷酸腺苷(adenosine diphosphate,ADP)核糖聚合酶(poly ADP-ribose polymerase-1,PARP-1)活化,该聚合酶负责DNA修复。然而,PARP-1过度激活导致细胞功能障碍和炎症反应的激活,引起PASMCs增殖[13]。HIF主要通过氧依赖性蛋白体降解进行调节,而这种蛋白体的降解是铁依赖性的[12]。研究表明[2],缺氧可通过释放细胞因子引起炎症。在最近的动物研究[9, 12]中,通过缺铁诱导实验动物PASMCs内缺氧及血管周围炎性细胞浸润,巨噬细胞迁移抑制因子,IL-6、IL-10、肿瘤坏死因子α和TGF-β等可使血管收缩、血管生成和组织修复受损,产生不同的肺血管表型。此外,缺氧状态下,交感神经张力增加使血管紧张素Ⅰ和Ⅱ水平升高,可导致血管收缩和机体炎症水平升高,也可继发引起内皮素水平升高和一氧化氮水平下降等。长期如此,可进一步使PASMCs肥大和增殖[6]。众所周知,缺氧可能影响免疫细胞的发育、功能和死亡,并触发内皮细胞异常免疫反应[14]。研究表明[15],单独使用SU5416抑制VEGFR2可诱导T细胞缺陷的大鼠产生重度的PAH,并伴肺内皮细胞凋亡,而免疫重组后裸鼠的肺血管周围炎症、内皮细胞凋亡以及PAH均减弱。调节性T细胞的功能是限制内皮损伤和炎症,而铁能调节T细胞极化和树突状细胞功能[10]。
2.3铁硫簇 PAH发生与铁硫(Fe-S)簇有关,ID通过简单的底物剥夺影响Fe-S簇。Fe-S簇是呼吸链中复合物Ⅰ、Ⅱ和Ⅲ中的重要辅助因子,如未正确组装的Fe-S簇,呼吸链就会功能失调[16]。此外,Fe-S簇组装蛋白1/2是Fe-S簇生物反应所必需的支架蛋白,也是microRNA-210(miR-210)的直接抑制靶标,分别位于细胞质基质和线粒体[2, 17]。当缺氧诱导肾脏产生EPO,促进血红蛋白合成并消耗铁超过一定阈值时,miR-210会降低Fe-S簇组装蛋白1/2的表达,Fe-S簇合成减少[2, 17]。这个过程削弱了Fe-S簇依赖性线粒体呼吸,导致特定的线粒体的代谢改变,促进肺动脉内皮细胞中的糖酵解,这种机制称为Warburg效应[17-18]。研究发现[7],许多蛋白质参与了Fe-S簇的组装和运输,如三磷酸腺苷结合盒亚家族B成员7是线粒体Fe-S簇转向细胞质的主要转运蛋白。热休克蛋白家族A成员9是将新形成的2Fe-2S簇转移到谷胱甘肽5所必需的线粒体伴侣。反过来,谷胱甘肽5是2Fe-2S簇的直接供体,以靶向载脂蛋白。这些蛋白质的缺陷导致Fe-S簇功能受损,在慢性状态下,铁摄取增加和铁利用率降低导致线粒体代谢异常和重编程,促进PAH的发生发展[17]。此外,一些基因突变也将PAH与铁稳态异常联系起来。如纯合子线粒体的Fe-S簇组装蛋白突变导致运动相关的肺血管功能障碍[2]。BOLA3(编码Fe-S簇成熟必需蛋白质)突变导致PAH相关的多发性线粒体功能障碍综合征[2]。此外,NFU1编码的蛋白可将Fe-S簇递送到线粒体呼吸复合物Ⅰ和Ⅱ,其突变也与PAH相关[2]。
2.4基因 miRNA对PAH发生发展的重要调节作用已被证明,最近有研究[19]提出miRNAs参与铁的调控。在IPAH患者中,一些miRNAs(miR-483-5p、miR-27a-3p、miR-27b-3p、miR-26b-5p、miR-199a-5p和miR-23b-3p)可能会失调[20-22]。有证据表明[23],miR-485-3p可在转录后下调FPN,但这种机制的生理作用尚不确定。这些失调miRNAs在其他生物学环境,也可转录控制铁获取、铁输出和铁储存等相关基因的表达[20-22],如BCL2、MSMO1、SLC7A11、TSPAN5和TXNRD1[20]。SLC7A11表达减少会影响谷胱甘肽合成或细胞内铁代谢的不稳定,导致细胞铁死亡[24-25]。XNRD1的下调可能通过NRF2信号使细胞更易受到铁死亡的影响[26]。另外,TSPAN5表达增加可能与细胞铁摄取增加引起的NOTCH信号通路激活有关,而MSMO1表达下调可能与血红素代谢有关[27-28]。此外,BCL2下调可诱导细胞凋亡[29]。研究表明[6],铁代谢相关基因和基因差异表达增加与氧化应激增加相关,但仍需进一步研究了解具体的作用途径和作用方式。
3 PAH合并ID的治疗
促进前列环素途径和一氧化氮途径,抑制内皮素途径是治疗PAH患者的基本途径。目前的指南[4]推荐对PAH患者进行靶向药物联合治疗。Boucly等[30]研究证明,相较于单用或二联,初始三联治疗(包括肠外前列环素)对高风险PAH患者益处更大。然而,复杂的药物管理、高昂的药物费用、靶向药物的可及性和各种不良反应使三联组合策略难以实施[31]。此外,当PAH患者合并ID时,单纯予靶向药物可能并不能有效改善患者预后。因为靶向药物仅通过扩张血管,以达到缓解症状的目的。缺铁可通过多种机制引起PAH,因此,铁剂可作为一种的新的策略用于治疗PAH患者。当患者合并其他因素时,如心力衰竭[32]、特发性PAH[33]和女性绝经期[6]等,补铁可能对于患者的益处更大。
3.1PAH患者铁剂的选择
3.1.1口服补铁 口服铁剂是一种廉价、安全和有效的方式。目前,市场上常用的口服铁制剂包括麦芽酚铁、硫酸亚铁、富马酸亚铁和葡萄糖酸亚铁。原则上,推荐元素铁剂量为100~200 mg/d,分2~3次给药[34]。然而,研究发现[35],在缺铁和非贫血的女性中,高剂量元素铁会提高铁调素的水平,限制铁剂吸收,且会出现恶心、黑便、肠胃气胀、便秘、上腹部不适、金属味和呕吐等胃肠道不良反应[5]。剂量调整频繁、处方改变、依存性降低或治疗中止,使原本“廉价”铁剂的真实成本可能显著高于产品本身的成本[35]。目前,新的口服制剂主要是将三价铁与载体结合以优化吸收并减少不良胃肠道作用,如焦磷酸脂质体铁口服胶囊。最近的数据表明[34],较低频率的给药,如隔天给药,可能会改善肠道耐受性,提高吸收率。因此,建议当PAH患者轻中度缺铁时选择中间剂量和隔日服用;当铁缺乏严重时,可考虑选择高剂量和每日服用,以此增加绝对吸收。
3.1.2静脉补铁 目前,指南建议PAH的ID患者静脉补铁。研究发现[36],静脉补铁组血红蛋白和血清铁蛋白水平的增加高于口服补铁组。然而,静脉铁剂也存在局限性,包括价格昂贵,过敏或输注反应,如荨麻疹、心悸、面部潮红和肌痛,以及感染等[32]。在临床中,可通过降低输注速率,以及对有药物敏感史、免疫/炎症/过敏性疾病史、肥大细胞增多症等患者不采用静脉输注铁,以避免过敏反应的发生[37]。有研究称[38],[实际体重×(9.3(或目标血红蛋白)—实际血红蛋白)×1.61]×2.4+铁储备,可用于指导铁剂量,但需进一步研究验证。
右旋糖酐铁是最早使用的制剂,蔗糖铁是使用最广泛的制剂,异麦芽糖铁(ferric derisomaltose,FDI)和羧基麦芽糖铁(ferric car-boxymaltose,FCM)是近年中国批准使用的新型铁剂。与传统铁制剂相比,FDI和FCM有一定优势,包括发生过敏反应几率低、元素铁生物利用度更高及半衰期更长等[39]。FCM可单剂量给药(1000 mg),也可多次给药(100~200 mg),无需测试剂量[38],FDI最大单次输注剂量为20 mg/kg[40]。因此,其能有效的减少输注次数,降低治疗成本。研究表明[38],FCM和FDI可诱导低磷酸盐血症发生,反复使用可能导致严重的骨软化,其特征为骨痛、假骨折和低创伤骨折。相比FCM,FDI发生低磷血症及过敏等风险较低[41]。因此,临床医生应在给药前检测血清磷酸盐浓度和维生素D状态,以评估患低磷血症的风险[38]。低磷酸盐血症发生风险为中度及以上时,以FDI作为优选;风险较高时,使用低分子右旋糖酐铁(无低磷血症风险)。如除FCM外无其他静脉内铁制剂,建议使用FCM的最大剂量的1/2[38]。低磷酸盐血症通常在8~10周内恢复,但临床医生仍应在2周后重复测量磷酸盐水平(此时最低值),避免患者出现肌肉功能障碍、精神状态改变和骨软化等[34, 38]。目前,缺乏妊娠早期(第1~3月)PAH患者使用FCM和FDI的证据[38]。
3.2铁替代治疗PAH患者的益处
3.2.1降低肺动脉压 研究表明[30],降低肺动脉压有助于通过降低血流动力学应激来逆转重塑和提高长期生存率。在剧烈运动中氧气提取增加约3倍,继而混合静脉血的氧饱和度下降,肺部暴露于缺氧期间继发肺血管阻力升高[42]。补铁可能提供1种机制,用于减少缺氧性肺血管阻力。1项随机双盲安慰剂对照生理学研究[42],选取32名50~80岁的健康人行静脉单剂量FCM(15 mg/kg至最大1 g)或安慰剂治疗,在8周的观察过程中输液耐受性良好。结果表明,运动期间收缩期肺动脉压力降低了约3 mmHg[(39.4±1.0) mmHg vs (36.9±0.9) mmHg,P<0.01],这种效果持续了8周。这项研究证明了缺铁与缺氧性肺血管收缩有关,且这种异常可通过静脉注射铁来纠正。因此,缺氧性PAH因补铁而减弱,因铁耗竭而加重。另一种可能机制是左心室功能的改善,正性肌力状态的实质性变化引起的肺动脉压力降低。有研究[12]发现,高海拔地区通过补铁逆转了约40%的PAH对缺氧的反应,PAH降低6 mmHg[(37(34~40) mmHg vs 31 (29~33) mmHg,P=0.01]。此外,1项Ⅱ期多中心、随机、双盲、安慰剂对照、交叉临床试验[43],将60例IPAH患者1∶1随机分配后,分别予12周铁剂羧甲基三氧化二铁注射液和安慰剂治疗,结果显示,试验组肺血管阻力明显降低。
3.2.2提升活动耐力 6MWT是评估患者身体能力简单可行的方法,与生活质量测量和运动耐量(运动持续时间和运动高峰期的摄氧量)有良好的相关性,重要的是6min步行距离与慢性心血管和呼吸系统疾病的预后密切相关[44]。Ghio等[45]通过使用焦磷酸脂质体铁胶囊,进行为期16周的纵向观察性发现,6 min步行距离显著改善[(500(390~500) m vs 530(410~550) m,P=0.043],但未证实补铁对肺动脉压力的影响,这可能是由于IPAH合并ID患者仅22例(6例贫血,16例不贫血)样本量不足,且未将治疗组与对照组比较分析。Molssn[46]研究结果表明,口服麦芽酚铁可提升PAH患者运动耐力[(331±147)m vs (381±131) m,P=0.004],证实了补铁与NT-proBNP、铁的状态、血红蛋白和右心室尺寸改善相关。
Viethen等[47]将20例PAH的ID患者(伴或不伴贫血)单次输注FCM≤1000 mg,2个月后,无氧阈[(647.0±70.0) ml/min vs (747.1±93.4) ml/min,P=0.03]和6MWT[(346.5±28.3) m vs (374.0±25.5) m,P=0.007]显著增加。根据贫血状态和右心功能对患者进行分层后发现,静脉铁对贫血和无贫血患者均有益,但贫血患者益处更明显。有研究[3, 48]得到相同结果,进一步证实FCM补铁对PAH合并ID患者活动耐力的改善。这可能是由于运动能力的提高是血红蛋白和肌红蛋白改善心脏、骨骼和吸气肌氧代谢的结果[3]。Ruiter[49]研究表明,运动耐力时间提升和达到无氧阈的时间延长, 但6 MWT未发生变化。因此,不能证明6MWT降低来解释疾病严重程度的差异。
铁对血红蛋白的形成至关重要,与活动耐力密切相关。研究表明[50],与正常人相比,缺铁患者6MWT降低,无论是否存在贫血。Howard[51]首次针对无贫血患者的随机、双盲、安慰剂对照研究,为期12周,并对两种静脉铁进行比较,39例欧洲患者接受FCM 1000 mg(体重<67 kg,15 mg/kg)或生理盐水,17例中国患者接受右旋糖酐铁(20 mg/kg)或生理盐水,结果表明,补铁对运动能力(心肺运动试验或6 MWT)或心肺血流动力学的任何测量均无影响。本试验患者均未发生贫血,且多数属于较轻功能级别(Ⅰ级和Ⅱ级:60%)。此外,该研究还包括遗传性PAH患者,存在潜在的基因突变,因此其可能不太可能从补铁中获得临床益处。
3.2.3改善铁水平 Ruiter等[52]另一项研究纳入21例缺铁患者,口服铁(富马酸亚铁200 mg,3次/d)连续4周,结果发现,仅2例在4周后血清铁水平升高。研究者怀疑铁摄取受损,可能归因于胃肠道水肿。矛盾的是,新型口服铁剂焦磷酸铁改善肠道吸收后也未改善体内的铁稳态[45]。此外,麦芽酚铁有显著作用,试验组血清铁、铁蛋白和转铁饱和度均显著增加。因此,仍需进一步明确口服铁在铁稳态方面的作用。相比口服铁,静脉铁恢复铁水平的效果显著, 输注后4h达到最高铁浓度,并在4周降至对照组水平。铁蛋白和铁调素浓度分别在23h和4h时大幅上升,并在整个8周内保持升高[42]。此外,其他几项研究[3, 47, 49, 51]也展现了静脉在补充机体铁水平方面的优势。
4 小结
综上所述,筛查和治疗PAH患者ID的好处超过风险。如患者有贫血和缺铁,可考虑补充铁,这种益处不仅体现在肺动脉压力方面,且也在活动耐力方面表现出来。但目前研究仅评估了补铁对缺氧性PAH的效果,且亚最大运动能力向最大运动能力转变的补铁剂量及时间需进一步确定。脂质体铁和隔日服用可作为口服铁剂的首选。较新的静脉注射铁制剂,如FCM和FDI,发生严重反应的风险似乎非常低。另外,部分研究结果存在差异,有无贫血及有无遗传性因素对补铁治疗PAH疗效的影响需进一步研究,且这些研究由于样本量小,随访时间短,无法在临床上推广,因此需大规模和可靠的随机对照研究,以探索补铁对PAH患者长期的潜在效用。
——忌食

