54例2型糖尿病患者合并新型冠状病毒感染的死亡原因分析
位 增,曹 灵,佘敦敏,刘 彦,王 艳,张真稳
(1.大连医科大学, 辽宁 大连 116000;2.扬州大学临床医学院 内分泌科,江苏 扬州 225001)
新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)是由新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染引起的以肺部炎性病变为主的呼吸道乙类传染病,严重者也可快速进展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒和出凝血功能障碍及多器官功能衰竭等。与其他病毒一样,新型冠状病毒基因组也会发生变异。世界卫生组织卫生组织(WHO)提出的“关切的变异株”(variant of concern, VOC)有 5 个,分别为阿尔法(Alpha)、 贝塔(Beta)、伽玛(Gamma)、德尔塔(Delta)和奥密克戎(Omicron)。目前Omicron 株感染病例已取代Delta 株成为主要流行株[1]。尽管Omicron变异株逐渐成为绝对优势流行株,其传播力和免疫逃逸能力显著增强,但随着国内外证据显示Omicron变异株肺部致病力明显减弱,临床表现已由肺炎为主衍变为以上呼吸道感染症状为主,故2023年1月由新型冠状病毒肺炎更改为新型冠状病毒感染[2]。自2022年12月22日新冠阳性人数达到高峰694万,后波动下降。而糖尿病与COVID-19住院患者的发病率和死亡率密切相关[3]。合并糖尿病的慢性疾病的患者,其发展为重症COVID-19的风险增加,并且重症监护室的入院率及死亡率都较高[4]。本研究主要对扬州大学临床医学院54例2型糖尿病(type 2 diabetes mellitus,T2DM)合并COVID-19的死亡患者的流行病学特征及相关实验室检查结果进行回顾性分析,以便及早判断病情发展及死亡的可能影响因素。
1 资料与方法
1.1病例选择 选取扬州大学临床医学院2022年12月1日至2023年2月28日住院病人中T2DM合并COVID-19并在住院期间发生死亡的54例患者。本研究获得扬州大学临床医学院伦理审查委员会的批准(伦审编号2023ky144)。
1.2诊断标准 在2023年1月6日之前采用COVID-19的诊断标准参照《新型冠状病毒肺炎诊疗方案(试行第九版)》[1]。在2023年1月6日之后采用COVID-19的诊断标准参照《新型冠状病毒感染诊疗方案(试行第十版)》[2]。糖尿病的诊断标准参照中国2型糖尿病防治指南(2020年版)中T2DM的诊断标准[5],具有典型糖尿病症状:①加上空腹血糖≥7.0 mmol/L;②或加上随机血糖≥11.1 mmol/L;③或加上葡萄糖负荷后2 h血糖≥11.1 mmol/L;④或加上糖化血红蛋白≥6.5%;无典型糖尿病症状者需改日再次复查确认。
1.3排除标准 主要排除1型糖尿病;妊娠期糖尿病;特殊类型糖尿病;药物相关性高血糖;入院24小时内死亡的患者;临床资料及实验室检查资料不完善者。
1.4观察指标 主要收集T2DM合并COVID-19患者的年龄、性别、体重指数(BMI)、血压、主要临床症状、是否合并高血压等其他基础疾病、吸烟史等基本资料;并收集患者住院期间随机血糖,糖化血红蛋白、血气分析、血常规、肝功能、乳酸脱氢酶(LDH)、肾功能、电解质、心肌损伤标记物、N末端B型利钠肽原(NT-ProBNP)、凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)、降钙素原(PCT)、C反应蛋白(CRP)、D-二聚体(DD)、细胞因子等实验室检查指标,以及胸部CT、痰培养结果和死亡原因,并对入院初期及终末期相关指标进行对比。
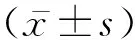
2 结 果
2.1流行病学资料及一般特征 本组54例死亡病例发病时间为2022年12月1日至2023年2月28日。54例死亡患者中,男44例(81.48%),女10例(18.52%),男女比例4.4∶1;年龄在46~94岁,平均(74.31±10.64)岁。其中年龄≥60岁者47例(87%);合并其他基础疾病者50例(92.6%),依次为高血压(81.5%)、冠心病(33.3%)、脑血管疾病(33.3%)、慢性肾脏疾病(20.4%)、肿瘤(11.1%)等,其中合并2种及以上基础疾病者40例(74%);入院初期随机血糖波动在3.9~28.3 mmol/L,平均(13.987±5.176) mmol/L;终末期随机血糖波动在1.9~18.1 mmol/L,平均(9.561±3.887) mmol/L。收缩压91~191 mmHg(1 mmHg=0.133 kPa),平均(135.31±22.31) mmHg;舒张压53~110 mmHg,平均(75.94±12.73) mmHg;BMI( 16.44~31.38) kg/m2,平均(24.06±3.43) kg/m2,其中BMI≥24 kg/m2有28人(51.85%) ,BMI≥28 kg/m2有7人(12.96%);从发病至死亡时间为3~58 d,平均(15.85±12.59) d。糖尿病病程1~44年,平均(14.29±10.51)年;吸烟史:共22例(40.74%),全为男性。
2.2临床表现的特点 54例死亡病例主要累及循环系统及呼吸系统,其中主要临床症状以胸闷(27/54,50%)、气喘(25/54,46.23%)、咳嗽(16/54,29.63%)、咳痰(14/54,25.93%)、发热(11/54,20.37%)、乏力(8/54,14.81%)、意识不清(8/54,14.81%)等为主。其他一些临床表现还包括畏寒、腹痛、昏迷、咯血、呼吸困难、黑便、呼吸急促、头晕、口唇紫绀、胸痛、晕厥等。见表1。

表1 54例T2DM合并COVID-19死亡患者的临床表现
2.3实验室检查结果 54例T2DM合并COVID-19死亡患者经积极降糖、控制血压、抗感染、抗病毒、纠正酸碱电解质平衡紊乱、部分患者予以输注成分血、人血白蛋白等综合治疗后,患者死亡前血常规:44.44%的患者白细胞计数≥10×109/L,62.96%的患者中性粒细胞计数≥7×109/L,所有患者的淋巴细胞计数均<5×109/L,29.63%的患者血小板≤100×109/L。因患者入院后病情较危重,故血沉、细胞因子仅有入院初期数值,血沉[42(22,75)] mm/L,白介素6(IL-6)[52.8(16.18,181.4) pg/ml],白介素8(IL-8)[10.54(11.98,33.15) pg/ml],白介素10(IL-10)[2.11(1,5.05) pg/ml],均较正常范围升高。
与入院初期检查结果相比,54例死亡患者死亡前最后一次血糖、酸碱度、红细胞计数(RBC)、白蛋白(ALB)、球蛋白明显下降。二氧化碳分压(PCO2)、乳酸(Lac)、乳酸脱氢酶(LDH)、钠离子(Na)、肌红蛋白(Myo)、PT、PCT、CRP、DD明显升高,差异均有统计学意义(P均<0.05)。见表2。
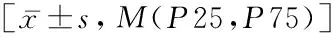
表2 54例T2DM合并COVID-19死亡患者入院初期及终末期实验室检查指标
2.4影响T2DM合并COVID-19死亡患者危险因素的 Logistic 回归分析 将入院初期与终末期的差异有统计学意义的相关指标纳入单因素分析,并将单因素分析中有意义的指标如血糖、PCO2、Lac、LDH、ALB、Na、Myo、PT、PCT、CRP、DD等纳入二元Logistic 回归分析,结果显示PCO2、LDH是影响T2DM合并COVID-19患者死亡的独立危险因素。见表3。
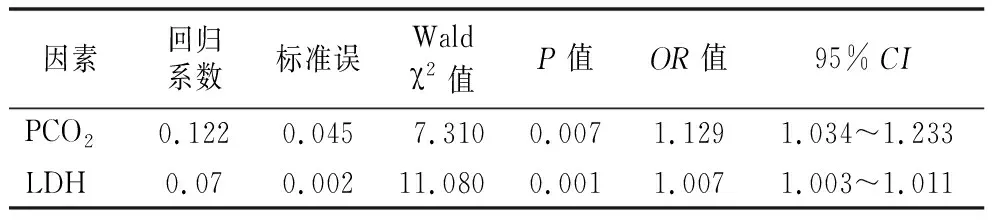
表3 54例T2DM合并COVID-19死亡患者危险因素二元Logistic回归分析
2.5胸部CT及痰细菌培养结果 54例死亡患者中,96.3%(52/54)的患者胸部CT影像学改变为双肺存在大片斑片状阴影及磨玻璃样影,仅3.7%(2/54)的患者表现为单肺发生病变;22.2%(12/54)的患者胸部CT表现为纤维条索影,18.5%(10/54)的患者胸部CT表现为结节状高密度影,11.1%(6/54)的患者胸部CT表现为实变影,5.5%(3/54)的患者胸部CT表现为片絮状模糊影;81.5%(44/54)的患者同时合并双肺胸腔积液。
54例患者入院后痰细菌培养阳性25例(46.3%),其中44%痰菌阳性患者细菌种类数≥2种。合并感染最多的细菌为鲍曼不动杆菌11例(44%),且药敏试验提示对大多数抗生素耐药。其他以铜绿假单胞菌8例(32%),肺炎克雷伯杆菌5例(20%),金黄色葡萄球菌4例(16%),嗜麦芽窄食单胞菌4例(16%)感染为主,其他感染的细菌还包括阴沟肠杆菌、粘质沙雷菌、奇异变形菌、屎肠球菌等;痰真菌培养阳性者8例(14.8%),50%为白色念珠菌,37.5%白假丝酵母菌,25%同时合并≥2种真菌感染,其他感染的真菌还包括光滑念珠菌、曲霉菌。
2.654例T2DM合并COVID-19患者的诊疗情况及死亡原因 入院后积极降糖、控制血压、纠正酸碱及电解质平衡紊乱、抗病毒、抗细菌及抗真菌感染、激素应用、保肝、护肾、部分病人予以输注人血白蛋白及成分血、营养支持、镇静等综合性治疗,在终末期均予以血管活性药物维持血压,大部分患者辅以有创机械通气或无创呼吸机辅助通气治疗,部分患者予以应用连续性肾脏替代治疗(CRRT)。
呼吸衰竭为直接死亡原因者占33.3%(18/54),多脏器功能衰竭者占20.4%(11/54),肺部重症感染者占18.5%(10/54),呼吸心跳骤停者占7.4%(4/54),急性冠脉综合症者占5.6%(3/54),心力衰竭者占3.7%(2/54),间质性肺炎者占1.9%(1/54),冠状动脉粥样硬化性心脏病者占1.9%(1/54),感染性休克者占1.9%(1/54),中枢神经系统感染者占1.9%(1/54),大面积脑梗死者占1.9%(1/54),消化道穿孔者占1.9%(1/54)。
3 讨 论
COVID-19与糖尿病之间的关系较为复杂,可以相互促进,互为风险因素。糖尿病患者由于存在血脂、血糖等代谢紊乱,致吞噬细胞活性、中性粒细胞趋化功能、T细胞功能等固有免疫及适应性免疫应答均降低[6-8],容易合并感染。并且SARS-CoV-2感染还可能会诱发新发糖尿病,其相关作用机制及疾病演变规律目前仍处于探索阶段。故对已有的临床死亡病例进行深入归纳总结及剖析研究,具有一定的临床意义。
本组病例临床症状主要以胸闷气喘为首发症状,其他症状还主要包括咳嗽、咳痰、发热等呼吸系统疾病的常见症状。并且本组病例入院时病情较重,入院查胸部CT有96.3%的患者胸部CT影像学改变为双肺存在大片斑片状阴影及磨玻璃样影,其次为条索影、结节影、实变影,与相关研究结果一致[9-10]。其中有81.5%的患者存在双侧胸腔积液,这也可能是患者首发症状为胸闷气喘而不是咳嗽、发热,与相关研究不一致的原因之一[9, 11-12]。并且由于高龄、免疫力低下患者易合并肺部感染,且老年性肺炎常缺乏典型的呼吸道症状[13]。本组病例死亡患者平均年龄为(74.31±10.64)岁,其中年龄≥60岁者47例,占死亡总人数的87%。高龄患者通常由于合并症多,脏器功能衰竭,同时免疫力低下易发感染,而导致重症感染多,病死率高。中国疾病预防控制中心通过对72314例病例分析总结提示,随着年龄的升高病死率不断上升,年龄≥80岁以上者病死率可达14.8%,并且既往有基础疾病者病死率增加,糖尿病患者合并COVID-19病死率为7.3%,高血压患者合并COVID-19病死率为6%[14]。除年龄之外合并基础疾病多也是造成病死率高的原因之一,本组病例中有92.6%的患者合并其他基础疾病,其中合并2种及以上基础疾病者占74%,依次为高血压(81.5%)、冠心病(33.3%)等,与朱晖等[11]、陆文峰等[15]研究结果一致。分析原因可能与糖尿病患者体内的血管紧张素转换酶-2 (ACE2)水平高于一般人群[16],ACE2与SARS-CoV-2具有较高的结合亲和力,使SARS-CoV-2进入宿主细胞并在多个部位广泛表达[17],导致这些组织更易遭受SARS-CoV-2的攻击,从而导致多器官功能衰竭的发生,同时这也可能是导致COVID-19患者症状出现多样化的原因[18]。本组病例多为高龄、T2DM且合并基础疾病多,合并COVID-19后易导致各脏器功能更难维持,进而更容易造成多器官功能衰竭的发生,而引起患者发生死亡。
在实验室检查方面, PH、RBC、ALB、球蛋白降低,血糖、PCO2、Lac、LDH、Na、Myo、PT、PCT、CRP、D-D升高是T2DM合并COVID-19患者的危险因素,与张炜宗等[19]的研究部分是一致的,张炜宗等结果还表明淋巴细胞减少及IL6升高与COVID-19的不良预后相关,可能因淋巴细胞表达SARS-CoV-2 受体而被病毒直接攻击和炎症因子水平的升高如IL-6诱导淋巴细胞的凋亡有关。本组病例淋巴细胞计数均<5×109/L,IL-6水平较正常范围明显升高为[52.8(16.18,181.4) pg/ml],但却不是T2DM合并COVID-19患者的危险因素,导致结果不一致的原因分析可能与本组病例样本量小,并且由于患者入院时病情较重,相关炎症因子只有入院初期指标而未能与终末期进行对比有关。相关研究表明NLR也可以预测疾病的进展并与COVID-19的死亡率独立相关。在COVID-19感染后淋巴细胞减少,特别T细胞和NK细胞明显减少,而B细胞则处于较低水平; COVID-19感染后可溶性二聚体细胞因子(IFN-γ)防御机制受损,病理性中性粒细胞增多,过度激活免疫系统,导致NLR的增加[20]。本组病例终末期NLR虽较入院初期升高[13.11(5.75, 21.58) vs 8.87(7.38, 23.69)],但却不是T2DM合并COVID-19患者的独立危险因素,与仇玄等[21]研究结果不一致,考虑与本组病例样本量较小有关。
冠状病毒感染后糖耐量正常患者血糖升高,糖尿病患者的空腹血糖会更高[22]。而血糖水平的升高可直接增加SARSCoV-2复制,由于免疫系统和炎症反应的失调,可能会引起致命的并发症[23-24]。本组病例入院初期血糖水平为(13.987±5.176) mmol/L,较终末期明显升高。相关研究证实,非危重病例入院时血糖水平升高是进展为危重甚至死亡的独立危险因素[25-26]。提示冠状病毒感染后血糖水平升高,而较高的血糖水平与COVID-19不良预后相关。本组病例中96.3%的糖尿病患者因病情危重入住我院重症监护室,为避免因高血糖引起急性并发症,大多数患者应用胰岛素降糖治疗; 25.92%的患者入院前即应用胰岛素治疗,有研究表明接受胰岛素治疗的个体感染COVID-19的风险高于非胰岛素治疗的个体(OR:1.43; 95%CI:1.34-1.52)[27]。应用胰岛素治疗增加SARS-CoV-2感染者的死亡[28],可能与其易引起低血糖相关。临床中不仅要防治高血糖引起的急性并发症,还要在应用胰岛素降低血糖的同时加强血糖监测,避免低血糖的发生,进而减少患者不良预后甚至死亡的发生。
本研究结果还提示PCO2、LDH升高是T2DM合并COVID-19患者的独立危险因素。相关研究表明机体感染COVID-19后可以出现呼吸困难、肺炎的相关症状,导致PO2降低,进而造成组织缺氧,最终发展为急性呼吸窘迫综合征[29-30],危重症患者由于肺的不均一性也会引起肺泡的死腔增加,进而引起二氧化碳潴留[31]。对于呼吸衰竭的患者来说,尽早行气管插管有创呼吸支持治疗对于延缓或减少多器官功能衰竭是有益的。本组患者入院初期PO2及终末期PO2并未显著降低,考虑与大部分患者应用呼吸机治疗有关。终末期PCO2较入院初期显著升高,考虑PCO2升高可能也是造成患者病情恶化加速患者死亡的危险因素之一。选择正确的呼吸支持治疗措施提高PO2,以及出现呼吸衰竭后对呼吸机的应用时机的准确把握,对于降低COVID-19患者的病死率有积极作用。LDH广泛存在于各种组织中,是糖酵解反应中重要的酶系。本研究结果发现LDH的升高是T2DM合并COVID-19患者的独立危险因素,与以往研究结果一致[32-33]。COVID-19患者循环中LDH明显升高,LDH的升高可以明显造成肺部损伤,引起间质性肺损伤,最终导致呼吸窘迫综合征,甚至死亡[33]。
在临床工作中对于T2DM合并COVID-19患者如出现PH、RBC、ALB、球蛋白降低,血糖、PCO2、Lac、LDH、Na、Myo、PT、PCT、CRP、D-D升高,尤其是PCO2、LDH升高时,应警惕病情恶化的可能,及早予以抗感染、抗病毒、应用免疫球蛋白、补充白蛋白,出现呼吸窘迫时及早予以机械通气、必要时予以CRRT等相关治疗,以改善患者的不良预后。
本研究的局限性在于:患者入院时病情危重,致使炎症细胞因子仅收录入院初期数值,未能与终末期进行对比,并且因大部分患者为危重症导致未能充分安排复查胸部CT。本研究收录的病人数有限,最新流调显示中国人糖尿病患病率已达12.8%,故未来应该开展更多、更大样本量的研究去探索T2DM合并COVID-19的具体机制,为临床治疗提供更有价值、更可靠的参考信息。

