163例急性早幼粒细胞白血病患者随访结果分析
董整荣,陶千山,沈元元,董 毅
(安徽医科大学第二附属医院 血液科,安徽 合肥 230601)
急性早幼粒细胞白血病(Acute promyelocytic leukemia, APL)是急性髓系白血病的特殊亚型,其特征是t(15;17)(q22;q12)易位,导致早幼粒细胞白血病(PML)基因和维A酸受体(RARα)基因(PML-RARα)的融合。APL总体发病率较低,占成人AML病例5%~8%[1],临床上以严重的出凝血障碍为突出特点,起病凶险,早期死亡率高。在过去的30年里,APL已经从一种高度致命的疾病转变为一种高度可治愈的疾病,APL的完全缓解率升至90%以上,5年无进展生存期(Progression free survival, PFS)和总生存期(Overall survival,OS)均在80%以上。但治愈所有APL患者的道路上仍存在挑战[2], 5%~10% 患者因早期死亡 (Early death, ED) 或复发而治疗失败,有报道ED率甚至高达18%[3]。虽然有许多文献讨论APL预后因素,因为病例数较少,结论不一,仍存在较大争议[4],因此仍需要更好地了解涉及APL的临床和生物学因素,进一步减少ED,整体提高患者的生存期,现将我院163例APL患者13年随访结果进行分析总结,探讨影响APL生存的预后因素。
1 资料与方法
1.1病例选择 单中心回顾性研究,对2010年1月至2022年12月安徽医科大学第二附属医院收治新诊断163例APL患者进行数据分析,包括人口统计学、临床血液学特征、治疗、毒性、并发症和预后。APL的诊断以临床表现、形态学、免疫表型、细胞遗传学和分子生物学为基础。不同意治疗、既往曾因任何恶性肿瘤接受过化疗或放疗的患者被排除在本研究之外。纳入患者均根据诊断时的总白细胞(WBC)和血小板(PLT)分为[5]:WBC>10×109/L为高危、中危为PLT≤40×109/L,WBC≤10×109/L,低危为PLT>40×109/L且WBC≤10×109/L。记录所有患者的基线凝血参数、肝肾功能、电解质和QTc间期。所有参与研究的患者或监护人均获得知情同意并通过伦理委员会审核。
1.2治疗方案 治疗方案参照中国APL诊疗指南2018年版[5]。中低危患者选择无化疗方案:维A酸(alltrans retinoic acid, ATRA) 联合亚砷酸(arsenic trioxide, ATO),高危患者达到CR后,给予3~4个疗程的缓解后化疗,包括柔红霉素、去甲氧柔红霉素、高杉尖杉酯碱单用或联合阿糖胞苷。在诊断和治疗期间对患者进行支持治疗。出血发生时给予血小板、新鲜冰冻血浆或冷沉淀,维持纤维蛋白原>1 g/L。在出现分化综合征的迹象时,患者每12小时给予10 mg地塞米松,直到体征和症状消失,建议暂时停药和调整剂量,以管理与药物相关的血液学和非血液学毒性[6-7]。
1.3随访 通过电话或查看门诊或住院病历来完成随访,末次随访时间2023年1月。PFS是指从诊断到疾病进展或死亡的时间,OS的定义是从诊断到最后一次随访或死于任何原因的时间。
2 结 果
2.1患者临床特征 本研究纳入有完整资料的163例初治APL患者,血红蛋白77.7(32.0~143.0) g/L,WBC计数14.55(0.23~122.00)×109/L,血小板计数29.42(1.0~134.0)×109/L,纤维蛋白1.47(0.20~5.68) mg/dl,PT为13.87(9.60~0.80) s,APTT为28.27(16.50~57.60) s,大于60岁患者占14例(8.6%),148例(90.8%)患者达到了完全缓解,附加染色体核型 ( Additional chromosomal abnormalities, ACA) 患者23例,其中复杂核型8例,其他常见ACA有+8、der(15)、-7、-6、del(6)、i(17q)、+9、del(16)、add(9)(p23)、add(17)(q21)、+15等。Fms样酪氨酸激酶3基因(Fms-like tyrosine kinase 3 gene, FLT3-ITD)是最常见的突变,其他特征见表1。

表1 患者临床特征
2.2ED患者的临床特征 未达到CR患者15例,其中ED患者13例,因此ED是影响患者疗效的主要因素。将所有患者根据是否发生早期死亡分成两组,ED患者年龄高于非ED组(P<0.01);WBC计数显著高于非ED组(P=0.004) ;高危组ED比例显著增加(P=0.001),见表2。

表2 早期死亡患者的临床特征
2.3患者生存分析 随访截至2023年1月,中位随访时间为42.5(0.1~156)月,5年的PFS为73.3%,OS率79.5%,中位PFS及OS均未达到,见图1~2。
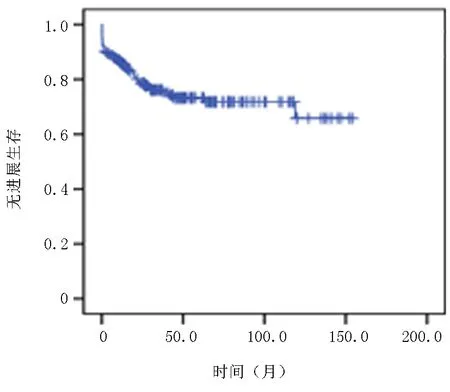
图1 患者无进展生存

图2 患者总生存
2.4影响APL患者PFS和OS的单因素分析 对APL患者PFS及OS进行单因素分析,ACA、FLT3突变、危险分层、性别不影响患者生存。年龄对PFS(P<0.01)和OS(P<0.01)产生影响,治疗方案影响患者OS(P=0.021),见表3。

表3 影响APL患者 PFS及OS单因素分析
2.5影响APL患者PFS和OS的多变量分析 将单因素分析有统计学意义的变量纳入Cox回归模型进行多因素分析,仅年龄是影响PFS(P<0.01)和OS(P<0.01)独立预后因素,而治疗方案对PFS(P=0.213)和OS(P=0.097)无影响。
3 讨 论
通过13年的随访,本研究表明APL患者发病中位年龄35岁,小于14岁患者26例,大于60岁患者14例,同时发病率呈逐年增长,是严重威胁中青年健康的恶性疾病之一[8]。在过去20年中,由于ATRA和ATO等药物的应用、诊断工具、分子监测、支持性治疗的改进,APL的生存取得了显著的进步,成了AML中最可能治愈的亚型[9],本研究5年PFS为73.3%,5年OS为79.5%,中位PFS及OS均未达到,较部分文献报道略低[4],可能与失访较多有关。同时也发现影响ALP患者生存的因素越来越多,因为其发病率较低,各中心报道尚不统一[10-14]。
APL是一种高度可治愈的疾病,但ED挑战仍然存在,而且在ATRA加ATO时代,真实世界的数据很少。本研究从2010-2022年,共有163名APL患者,虽然经历治疗方式改变,APL患者的OS和PFS显著改善,早期死亡率没有显著下降。值得注意的是,年龄较大和WBC计数较高可以确定ED率极高,也代表这两种情况都是治愈所有患者的障碍[15]。也有发现ED患者中PT、APTT和D-二聚体升高,纤维蛋白原水平较低,但仅观察到了危险分层和出血史与凝血参数的相关性,但仅仅血小板计数和白细胞计数与ED相关,然而,凝血参数没有观察到与ED相关性[16]。本研究中ED组纤维蛋白原水平降低,但与非ED组差异无统计学意义,但无论出血症状如何,在诊断疑似APL患者时都必须检查凝血参数,除早期使用ATRA外,还应输注新鲜冷冻血浆,减少出血导致死亡。治疗模式的演变可以降低ED率,改善临床结果,并使患者免受化疗的毒性。APL对蒽环类药物的敏感性,使这种致命的疾病可以治愈,但死亡率很高。ATRA-ATO提高了生存率,但回顾性研究发现早期死亡仍然是个问题[17]。Nauffal等[18]也报道了ATRA的应用时机和ED之间缺乏关系,这表明患者其他相关因素影响不良的早期结局。考虑到当前ATO+ATRA时代的复发率非常低,现在应该修改生存风险评分,以专注于ED而不是复发的风险。这些高风险和极高风险组包括所有白细胞计数大于5×109/L的患者以及白细胞计数较低但年龄较大的患者,年龄成为预测ED的重要因素这一事实值得深究[19]。众所周知,年龄是急性白血病发病机制和预后以及凝血系统病理的主要因素,研究衰老对白血病或凝血系统本身的影响是否有助于增加早期死亡风险,这将是一件有趣的事情,可以识别隐藏在先前归类为低风险中的高风险患者[20]。如果应用积极的针对老年患者支持性手段,可以挽救这些患者,也许目前指导治疗的APL的整个风险分层系统应该进行改良,并关注ED的风险,应纠正将年龄作为重要预后因素,临床工作中如果使用白细胞计数分层,应与年龄相关。如何进一步因此降低ED,是我们需要思考的问题,早诊断早治疗,疾病早期尽量减少化疗药物使用,高龄及高危患者应用更加积极的支持性手段和精细的检测手段。此外,感染是白血病患者最常见的并发症和死亡危险因素[21],加强防控等措施或许对减少ED有所帮助。
其次,争议较大的是合并FLT3-ITD突变与ACA对预后的影响。一项回顾性队列研究,包括60例APL患者,发现FLT3-ITD是5年PFS的独立不良因素,ACA是5年OS的独立不良因子,在化疗加ATRA治疗的APL患者中,FLT3-ITD和ACA与较差的OS和PFS结果相关[22]。有文献指出FLT3-ITD突变不影响以ATO和ATRA为基础的方案治疗成人APL患者的生存结果[23]。有报道APL患者ACA阳性率31.6%,接受化疗加ATRA治疗,无和有ACA在CR(分别为92.3%和66.7%,P=0.025)、3年OS(分别为92%和65.0%,P=0.017)和3年PFS(81.4%和44.4%,P=0.024)方面的差异有统计学意义[24]。有研究对仅接受ATO治疗的患者进行了汇总分析,以确定ACA和(或)复杂核型的预后重要性,证明了仅仅携带复杂核型ACA的患者的生存率较低(P=0.002),但总体ACA患者无影响(P=0.142)[23]。本研究发现ACA阳性率(14.1%)及FLT3-ITD突变率(11.7%)远低于其他文献[25],对APL患者的PFS与OS进行单因素与多因素分析时,并未观察FLT3-ITD突变及ACA对预后产生不利影响,前期也做过报道[26]。目前文献结果的差异性可能与病例数较少或选择治疗方案的差异性有关,仍需要进一步验证。
再者,治疗方式的改变对预后的影响。中国APL诊疗指南推荐中低危患者一般采用ATRA-ATO的无化疗方式,高危患者加用巩固化疗[5],与ATRA-ATO加化疗相比,ATRA-ATO在高危APL中的疗效仍然未知。一项随机的多中心非劣效性III期研究,以比较ATRA-ATO和ATRA-ATO加化疗在新诊断的所有风险APL中的疗效,患者被分配接受ATRA-ATO诱导、巩固和维持,或ATRA-ATO加化疗诱导,然后接受3个周期的巩固治疗,并用ATRA-ATO维持治疗。在非化疗组中,使用羟基脲来控制白细胞增多,两组完全缓解率均为97%。在所有风险分层患者中,非化疗组和化疗组的2年无病生存率分别为98%和97%(P=0.62),高危患者分别为94%和87%(P=0.52),研究表明,ATRA-ATO在治疗所有风险APL患者方面具有与ATRA-ATO加化疗相同的疗效[27]。另外有研究评估ATRA-ATO的无化疗应用于高危APL,结果发现2年的DFS和OS分别为94%和100%,所有患者在巩固期结束时均达到了完全的分子缓解[28]。有报道阿糖胞苷联合伊达比星加ATRA的标准化疗方案并未改善高危APL患者的治疗结局,就治疗相关并发症和死亡率或治疗结局而言,蒽环类药物加ATRA加阿糖胞苷不如ATO加ATRA[29]。本研究中联合化疗患者78例(47.9%),其中高危患者29例,低中危患者49例,因为其他因素21例高危患者没有遵循指南联合化疗,但多因素Cox回归分析APL患者是否加用化疗不影响PFS及OS,与文献报道一致[27-28]。因此在低风险患者中,APL经ATRA和ATO治疗后,大部分患者可以治愈,在高危患者中,尽量减少化疗已被证明是可行的。
综上所述,年龄和风险分层是导致APL患者早期死亡的影响因素,高龄是APL患者不良PFS和OS的独立影响因素,患者危险度分层应考虑加入年龄因素,而FLT3-ITD突变、ACA及是否加用化疗对APL患者的ED、ORR以及长期生存没有产生影响,高危APL患者减少化疗是可行的。

