TNF-α-308基因多态性与胃癌易感相关性的meta分析
吕 畅,周利明
(华北理工大学 生命科学学院,河北 唐山 063210)
胃癌是世界上最重要的癌症之一,根据全球癌症统计数据显示,截至2020年胃癌在全球范围发病率排名第五,死亡率排名第三[1]。胃癌的发生是由多因素影响的复杂过程,其详细的发病机制仍在探索,目前越来越多的研究发现宿主遗传易感性如易感基因的单核苷酸多态性可能在胃癌发生中起重要作用[2-3]。
肿瘤坏死因子α (tumor necrosis factor-α, TNF-α)是一种多功能促炎细胞因子,参与分化、凋亡、脂质代谢等生物学过程,在慢性炎症和恶性疾病的发生发展中具有重要作用。TNF-α基因启动子区域-308位点的多态性目前研究较为广泛,该位点在启动子区可能发生G-A转换,这种单核苷酸多态性变化可能影响基因的转录水平,进而影响疾病的发病机制。近些年研究发现TNF-α-308位点多态性与炎症性肠病 (Inflammatory Bowel Disease, IBD)、肝癌、结直肠癌等多种疾病有关[4-6]。
TNF-α-308G/A单核苷酸多态性和胃癌易感的相关性探索在国内外已经有许多试验,研究样本来源于不同种族、基因分型方法不同等原因使得结果存在争议,小样本的研究不足以提供充分的证据确定TNF-α-308单核苷酸多态性与增加胃癌发病风险的相关性。近年来,相关研究仍在更新发表,本文综合国内外符合条件的研究进行meta分析,按照胃癌发病地区,基因分型方法进行相关亚组分析,评估TNF-α-308位点多态性与胃癌之间的关联,为胃癌的发生发展,治疗与预防提供依据。
1 资料与方法
1.1文献检索 计算机检索Pubmed,Web of Science,Embase,Cochrane library,万方数据和中国知网数据库,收集有关TNF-α-308位点多态性与胃癌易感性的文章,检索时间为各数据库建库到2022年6月1日。采用主题词与自由词相结合的方式,中文检索:肿瘤坏死因子,TNF-α-308,胃癌,单核苷酸多态性;英文检索术语为:(Tumor Necrosis Factor-alpha OR TNF-alpha OR TNF-α)和(Stomach Neoplasms OR gastric cancer OR stomach cancer OR gastric carcinoma)和(Polymorphisms, Genetic OR gene polymorphism OR polymorphisms OR variant OR mutation)。
1.2纳入与排除标准 纳入的研究符合以下标准:描述TNF-α-308基因多态性与胃癌相关性的研究;研究类型是病例-对照研究;有详细的基因型数据。排除的标准如下:重复数据;病人确诊为胃癌;信息不足导致数据提取不完整的研究;会议,书信,综述型研究。
1.3数据提取和质量评价 由2名研究者按照如上标准筛选文献,独立提取资料,进行交叉核对。若存在争议,通过讨论的方式达成一致。资料提取内容包括:第一作者、发表时间、地区、基因分型方法、病例组和对照组基因型、基因分布及频数。采用纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale, NOS)评价纳入研究的质量,评分范围为0~9分,分数越高,纳入的研究质量越好。
1.4统计学方法 用STATA 16.0进行统计分析。合并的OR(odds ratio,OR)值以及95%CI(Confidence Interval,CI)用于衡量TNF-α-308基因多态性与胃癌的相关性与关联强度,通过Z检验确定合并OR值的显著性,P<0.05表示TNF-α-308基因多态性与胃癌易感性显著相关。Q检验和I2统计评估研究间的异质性,P<0.1或I2>50%,各项研究存在较大异质性,采用随机效应模型合并总体结果;反之采用固定效应模型。对照组的哈迪-温伯格平衡定律(Hardy-Weinberg equilibrium, HWE)通过χ2检验判断。以等位、显性、隐性、纯合、杂合5种不同的遗传模型评估TNF-α-308基因多态性与胃癌易感的相关性,并按照地区和基因型检测方式进行亚组分析;依次剔除单个研究进行敏感性分析;Egger检验对发表偏倚进行评估。
2 结 果
2.1文献检索结果与基本特征 依照拟定的检索策略和纳入与剔除文献标准,41篇符合条件的全文研究被纳入分析[7-47],见图1。

图1 Meta分析文献收集流程图
41项研究共计7528例病例和10924例对照。种族按照地理位置分为亚洲,美洲,欧洲和非洲,其中亚洲地区涉及15项针对中国人的研究。基因分型采用RFLP、Taqman等其他方法;HWE检验结果显示,10项对照组基因型偏离了HWE[8, 11, 14, 30, 32, 34, 42- 43, 45, 47];NOS质量评价结果显示,41篇文献偏倚风险评分均大于或者等于6。纳入研究的基本特征和偏倚风险评价结果见表1。
2.2Meta分析结果 所有的遗传模型下异质性均较大,采用随机效应模型。Meta分析结果显示等位,杂合,显性模型TNF-α-308基因多态性与胃癌易感风险增加显著相关(A vs G,OR=1.21, 95%CI:1.01~1.44; AG vs GG,OR=1.26, 95%CI: 1.07~1.49; AA+AG vs GG,OR=1.22, 95%CI: 1.00~1.47)。纯合,隐性模型的差异均无统计学意义(AA vs GG,OR=1.23, 95%CI: 0.84~1.80; AA vs GG+AG,OR=1.21, 95%CI:0.90~1.63)。剔除10项不符合HWE平衡的研究后,结果无显著变化。提取中国人的数据后发现杂合,显性模型下该位点多态性与增加中国胃癌风险显著相关(AG+AA vs GG,OR=1.33, 95%CI: 1.08~1.64; AG vs GG,OR=1.39, 95%CI: 1.04~1.87)。
相关研究中,以幽门螺旋杆菌阴性感染胃癌患者的基因分型数据为对照组,数据完整的研究有5篇,试验组共计391例,对照组116例。结果显示TNF-α-308基因多态性与增加幽门螺旋杆菌感染胃癌易感性无关(A vs G,OR=1.10, 95%CI: 0.78~1.56; AA vs GG,OR=1.10, 95%CI: 0.46~2.63; AG vs GG,OR=1.14, 95%CI: 0.70~1.86; AA+AG vs GG,OR=1.14, 95%CI: 0.71~1.83; AA vs GG+AG,OR=0.99, 95%CI: 0.46~2.12)。
2.3亚组分析结果 按照种族划分亚组,异质性检验结果显示研究间存在异质性,均采用随机效应模型。结果显示,在亚洲人群中,等位、杂合和显性模型TNF-α-308基因多态性与增加胃癌风险显著相关亚洲地区等位模型(A vs G,OR=1.29, 95%CI: 1.04~1.61; AG vs GG,OR=1.35, 95%CI:1.06~1.71; AA+AG vs GG,OR=1.36, 95%CI:1.07~1.73)。欧美洲地区在任何遗传模型下,均未发现TNF-α-308基因多态性与胃癌易感性的关联(A vs G,OR=1.15, 95%CI: 0.95~1.40;A vs G,OR=1.00, 95%CI: 0.51~1.96),而非洲地区结果与之截然相反(A vs G,OR=4.40, 95%CI: 1.96~9.9),见图2~6。

图2 基于不同地区对TNF-α-308多态性与胃癌易感性的森林图(等位模型,A vs G) 注:点表示各项研究的OR值;横线表示95%CI;底部菱形表示合并后的OR值和95%CI
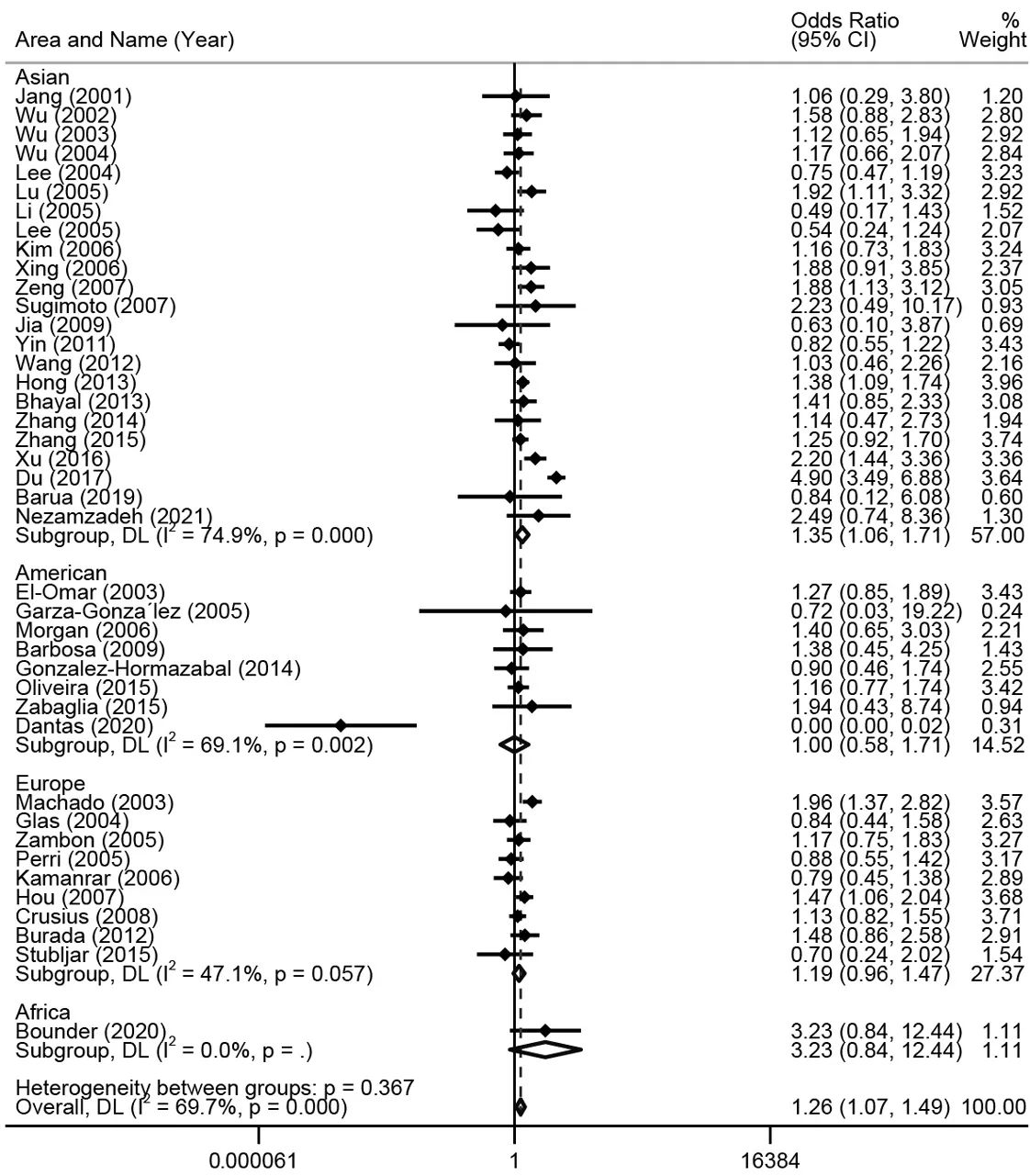
图3 基于不同地区对TNF-α-308多态性与胃癌易感性的森林图(杂合模型,AG vs GG)

图4 基于不同地区对TNF-α-308多态性与胃癌易感性的森林图(显性模型,AA+AG vs GG)

图5 基于不同地区对TNF-α-308多态性与胃癌易感性的森林图(纯合模型,AA vs GG)

图6 基于不同地区对TNF-α-308多态性与胃癌易感性的森林图(隐性模型,AA vs AG+GG)
按照不同的基因分型方法划分亚组,18项研究采用RFLP的基因分型方式,8项研究采用Taqman分型,另外还采用了DSASP、ARMSPCR、直接测序、芯片检测等方法,相关研究偏少,将其归为其他组,共计15项。结果显示,用Taqman的基因分型方法的研究之间均不存在异质性,所有遗传模型中,TNF-α-308基因多态性与增加胃癌患病风险有关(A vs G,OR=1.35, 95%CI:1.19~1.53; AA vs GG,OR=2.05, 95%CI: 1.35~3.10; AG vs GG,OR=1.29, 95%CI: 1.12~1.49; AA+AG vs GG,OR=1.34, 95%CI: 1.17~1.54; AA vs AG+GG,OR=1.35, 95%CI: 1.19~1.53)。RFLP和其他基因分型的研究亚组中异质性较大,采用随机效应模型,等位和纯合模型RFLP分型方式TNF-α-308基因多态性与增加胃癌风险存在显著相关性(A vs G,OR=1.36, 95%CI: 1.02~1.83; AA vs GG,OR=1.72, 95%CI:1.08~2.75),其他模型和分型方式均显示不相关。
2.4敏感性分析与发表偏倚 敏感性分析结果显示,依次排除每项研究后合并OR值没有实质性改变,表明meta分析的稳定性和可靠性比较强。Egger检验没有显示任何发表偏倚的统计证据(A vs G,P=0.280, 95%CI: -3.05~0.91; AA vs GG,P=0.420, 95%CI: -1.721~0.738; AG vs GG,P=0.082, 95%CI: -2.27~0.24; AA+AG vs GG,P=0.147, 95%CI: -2.86~0.44; AA vs AG+GG,P=0.82, 95%CI: -1.13~0.90)。见图7。

图7 TNF-α-308多态性与胃癌易感性的敏感性分析 a:等位模型,A vs G; b:纯合模型,AA vs GG; c:杂合模型,AG vs GG; d: 显性模型,AA+AG vs GG; e: 隐性模型,AA vs AG+GG 注:圆圈表示剔除该项研究后的合并OR值;横线表示置信区间的上下边界
3 讨 论
胃癌的发生是环境因素和基因相互作用等多因素参与的复杂过程。近些年分子发病机制相关研究的不断开展使得癌症发生机制以及易感性与个体遗传变异之间关系逐步清晰。TNF-α作为在恶性疾病发生发展中的促炎因子,相关研究越来越多,其中308G/A是TNF-α启动子区最常研究的单核苷酸多态性位点。研究表明TNF-α-308G/A位点多态性与提高TNF-α表达水平,TNF-α的血浆浓度,炎症程度,C反应蛋白水平(C-reactive protein, CRP)等因素有关,进而增加IBD、肝癌、结直肠癌的易感风险[4-6]。然而,对于胃癌,最新发表的2项研究结果均说明TNF-α-308位点多态性会增加胃癌易感风险[45-46],而Nezamzadeh等[47]认为在伊朗地区二者无关,先前发表的meta分析结果尚具争议[48-49]。本次meta分析综合相关病例对照研究,探究TNF-α-308位点多态性与胃癌以及幽门螺旋杆菌感染胃癌易感性之间的关联。
分析结果显示,等位,显性和杂合模型下TNF-α-308基因多态性与胃癌风险增加显著相关。当对胃癌发病地区进行亚组分析时,仅在亚洲地区等位,显性和杂合模型的结果均表明TNF-α-308基因多态性与胃癌风险增加相关;相同的结论体现在中国人的15项研究中,且该结果与在中国进行的较大样本的实验研究[35]和Du等[42]meta分析的结果一致,但与部分学者结论相反[32-33, 41],本次分析的结果说明,在中国人中A基因携带者比G基因携带者胃癌发病风险增加30%~40%。欧洲和美洲地区均未体现二者的相关性,然而非洲地区仅有1项研究,其亚组分析结果显示TNF-α-308基因多态性显著增加胃癌发病风险,后续需要纳入更多该地区的数据进一步分析。不同地区结果存在差异,有几种可能的原因:样本量存在偏差,非洲地区和欧洲地区纳入的研究量较小;不同地区饮食和环境,胃肠道疾病与癌症的发病率不同。对基因分型方法进行分层分析,Taqman方法进行基因分型时,TNF-α-308基因多态性与胃癌风险增加显著相关,与Yang等[48]的结果一致,不同方法的基因分型可能会影响病例对照试验胃癌的相关数据,结果显示该位点多态性与感染幽门螺旋杆菌胃癌的易感不相关。
本研究存在一些局限性,对胃癌发病地区的亚组分析中非洲地区样本不足,幽门螺旋杆菌感染的胃癌的样本规模太小,以及考虑到一些负面结果难以被发表使得样本收集困难等因素,均难以得出科学可靠的结论;研究仅对308G/A位点多态性进行分析,另外与还应综合考虑胃癌分期,患者性别,年龄以及基因与基因,基因与表型,基因与环境等其他宿主遗传因素对胃癌发病的影响。
综上,亚洲地区TNF-α-308基因型多态性与增加胃癌的易感性存在一定的关联。由于目前纳入的研究存在局限,未来需要更大规模的严谨的科学研究进一步证实,为胃癌的早期诊断与防治提供依据。

