聚合物微球皮克林乳液法制备吸附水环境中双氯芬酸研究
勾小一 ,李云, Zia Ahmad ,陈吉平, 朱秀华
(1.大连海事大学 交通与运输工程学院,辽宁 大连 116026;2.大连交通大学 材料科学与工程学院,辽宁 大连 116028;3. 中国科学院大连化学物理研究所,辽宁 大连 116023;4. 大连交通大学 环境与化学工程学院,辽宁 大连 116028)
非甾体抗炎药物(NSAIDs)是临床上常用的一类解热镇痛抗炎药,常见有布洛芬、双氯芬酸、萘普生及酮洛芬等[1-4]。我国NSAIDs的使用量在逐年增加,其用量之大已接近于抗生素。由于其在污水处理厂中难以有效去除,导致该类药物活性物质持续不断地进入水体中,造成持久性水环境污染。2012年欧盟委员会将双氯芬酸列为新增12种水环境优先污染物之一,并提出其在内陆地表水中的年平均环境质量标准(AA-EQS)为0.1 μgL。近年来,NSAIDs类污染物已在全世界范围内的污水、地表水、地下水以及饮用水中被检出[5-9],并被证明对生态环境和人类健康具有一定的危害。因此,研究水中NSAIDs药物的高效去除技术具有非常重要的实际意义[10-11]。
吸附法是一种廉价且易于操作的技术,处理设施简单。活性炭、黏土、壳聚糖、纤维素、硅胶、大孔树脂、层状硅酸盐等传统吸附剂存在选择性低、吸附位点差、再生性差等缺点。因此,探索和开发具有高选择性、高吸附能力、无二次污染的吸附材料具有重要意义。在吸附剂表面产生或引入具有高亲和力的高密度吸附位点是一种低成本且有效的非甾体抗炎药吸附方法[12]。
Pickering于1907年发现固体材料可以稳定乳液液滴,并将这种乳液命名为皮克林乳液。皮克林乳液的原理大致如下:利用两亲性的固体颗粒作为乳化剂,在油水界面自组装,以减小界面张力,使乳液稳定。可用于皮克林乳液聚合的固体材料包括SiO2、碳酸钙、TiO2、Fe2O3、蒙脱土、氧化石墨烯、聚(甲基丙烯酸二乙基氨基乙酯)等[14-18]。
本文采用皮克林乳液聚合方法以2-(二乙基氨基)乙基甲基丙烯酸酯为单体、二乙烯基苯为交联剂,纳米SiO2为乳化剂,采用皮克林乳液聚合法制备了粒径均一,带有叔胺基的聚(2-(二乙基氨基)乙基甲基丙烯酸酯-二乙烯基苯)(P(DEAEMA-DVB))微球。然后采用2,3-环氧丙基三甲基氯化铵的季胺基官能团进行修饰,得到P(QA-DVB)(QA, quaternized amine)。以非甾体抗炎药中的双氯芬酸药物为目标物,考察了pH、吸附时间对吸附容量的影响。该吸附剂不仅结合了高比表面积、快速传质及超支化分子高密度功能团,还具有吸附容量大等优点,适用于水中非甾体抗炎药的快速、高效去除。
1 实验方法
1.1 实验试剂
双氯芬酸(diclofenac, DIC)、纳米SiO2(12 nm)购于Sigma-Aldrich(美国),二乙烯基苯(divinylbenzene, DVB)、1,4-丁二醇二缩水甘油醚(1,4-butanediol diglycidyl ether, BDDE)和偶氮二异丁腈(2,2-azobisisobutyronitrile, AIBN)购自北京百灵威科技有限公司(中国),2-(二乙基氨基)乙基甲基丙烯酸酯(DEAEMA)、1-十二醇购自TCI公司(日本)、2,3-环氧丙基三甲基氯化铵购自江苏艾康生物医药研发有限公司(中国)。其他分析纯试剂(例如氢氟酸、三乙胺、氢氧化钠、氨水、甲苯等)均购自天津大茂化学试剂有限公司(中国)。为了除去自由基阻聚剂,DVB在使用前需要进行碱洗、干燥和减压蒸馏,DEAEMA在使用前需要过碱性氧化铝小柱。实验中使用电阻率为18.2 MΩ/cm的高纯水是由美国Milli-Q Advantage A10的纯水机净化而来的,实验中所使用的化学试剂如无特殊说明都是分析纯,而且没有经过进一步的净化。
DIC储备溶液(1 mg/mL)是将一定量DIC溶解在纯甲醇中制备而成。所得到的储备液放置在-20 ℃的冰箱中避光保存。不同浓度DIC溶液用50% MeOH稀释储备液制得。现用现配所需各浓度样品溶液,并于4 ℃的冰箱中储存待用。双氯芬酸物理性质与结构购见表1。
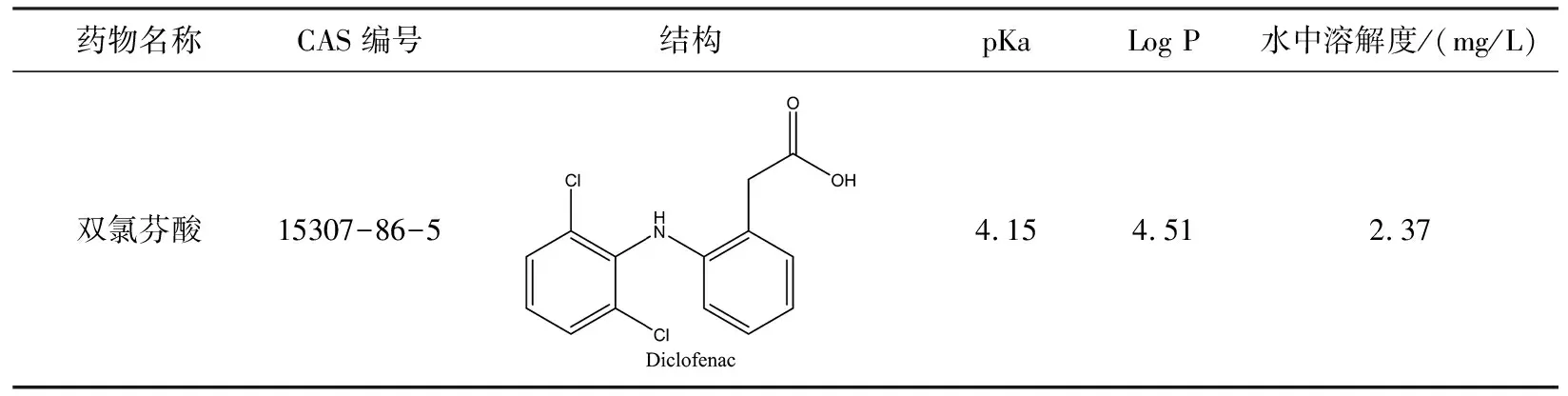
表1 双氯芬酸的物理性质和结构
1.2 材料制备方法
本章节中的微球是使用一步法皮克林乳液聚合法合成的。首先称取0.422 g 1-十二醇、22.5 mg AIBN、1.2 mL甲苯、3 mmol DEAEMA与3 mmol DVB在试管里通过涡旋进行混合,称为A,将A持续通入氮气。再将120 mg硅球与10 mL纯水在试管中混合并超声1 min,称为B。接下来向B溶液中加入A溶液,用匀浆机以6 000 r/min的速度快速搅拌1 min,得到皮克林乳液。然后将乳液放置于60 ℃的水浴锅中发生24 h聚合反应。反应结束后过滤得到的复合材料用氢氟酸浸泡24 h,之后抽滤并用去离子水洗涤至中性得到DEAEMA-DVB微球。使用甲醇作为提取溶剂,进行索氏抽提12 h,除去材料中未反应的杂质。称取1 g DEAEMA-DVB微球与15 mmol 2,3-环氧丙基三甲基氯化铵在水/甲醇(v∶v= 50∶50)溶液中,在60 ℃水浴中搅拌反应3 h,制备得到P(QA-DVB),吸附剂的制备示意图见图1。
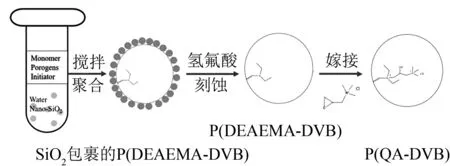
图1 P(QA-DVB)微球制备示意图
1.3 材料表征
材料的比表面积及孔径分布通过氮气吸附仪测定。首先将粉末材料(约100 mg)加入已准确称重的样品管内,经过脱气100 ℃真空干燥8 h后再次称重,获得材料的准确质量,然后对材料进行氮气的吸附与脱附,最后材料的比表面积通过BET(Brunauer Emmet Teller)方法进行计算,孔体积及孔径分布通过BJH(Barrett Joyner Halenda)方法进行计算;材料的扫描形貌和EDS光谱通过场发射扫描电子显微镜(SEM)在高真空模式下加速电压为0.01~30 kV的条件下进行表征。
1.4 研究方法
药物吸附方法:批量进行的目标药物吸附实验均在带塞锥形瓶中进行,批量实验时每个锥形瓶中含有40 mg/L质量不等的吸附剂,100~200 mL体积不等含有目标药物的溶液。将含有吸附剂与目标药物溶液的锥形瓶放置在25 ℃下以120 r/min 的速度充分振摇2 h,再将锥形瓶中的溶液通过0.45 μm聚四氟乙烯滤膜过滤。
吸附动力学研究:以固定的药物溶液起始浓度(200 mg/L)在不同的时间间隔(1、2、5、10、20、30、40、50和60 min)采集样品,获得吸附动力学数据。
溶液pH影响研究:在同一药物浓度溶液(200 mg/L)下,用0.3 mol/L NaOH或HCl将溶液pH调节至2、3、5、7,来评价溶液pH对吸附剂吸附效果的影响。除了评价pH对吸附效果的影响实验外,溶液pH均保持在7。
药物去除效率(Re)和吸附剂平衡吸附容量(qe)根据以下方程式计算:
(1)
(2)
式中:C0和Ce分别是溶液中药物的初始浓度和平衡浓度,mg/L);V是溶液的体积,L;m是吸附剂的质量,g。
吸附剂再生:使用过的吸附剂于室温下再生。首先,将吸附实验使用过的吸附剂从锥形瓶中过滤出;其次,用2%的氨水-甲醇溶液对吸附剂进行2次反复洗涤;最后,将吸附剂在真空烘箱中60 ℃干燥过夜,留待进一步使用。重复类似的再生过程,进行次循环实验研究。
2 结果与讨论
2.1 表征结果
2.1.1 SEM表征
使用扫描电镜对合成的纳米微球形貌进行表征,电镜扫描图见图2。由于纳米SiO2会自组装在乳液液滴的表面,阻止液滴聚合,所以其浓度会影响液滴的大小和稳定性,因此我们考察了2个不同水平(80 mg和120 mg)的纳米SiO2加入量对聚合物微球形貌的影响。图2为不同SiO2添加量下微球形貌。由图2可知,合成的微球尺寸都比较均匀,图2(a)中粒径为15~30 μm,图2(b)中粒径为15~20 μm,形状均为球形。两者相比较,后者粒径分布更加均匀。为了获得粒径均匀的聚合物微球,最终选择120 mg纳米SiO2用于制备皮克林乳液。

图2 P(QA-DVB)微球的SEM图像
2.1.2 氮气物理吸附-脱附
为了考察不同比例的聚合单体与交联剂对微球孔径的影响,考察了3个比例下(VDEAEMA∶VDVB= 1∶1,1∶4,1∶10)微球的孔径与吸附性能。从图3中可以看出,3种比例下合成的微球具有相似的吸附等温线和回滞环。根据国际理论和应用化学联合会(IUPAC)关于等温线的分类,图3中氮气吸附-脱附等温线属于“IV”,带有H2迟滞环,表明材料内部既有微孔也有介孔。分别使用BET算法和BJH理论计算它们的比表面积、孔体积和孔径分布,结果见表2。通过表2可以看到,当VDEAEMA∶VDVB= 1∶1时,材料比表面积最大,作为吸附剂材料,当比表面积增加时,意味着暴露的吸附位点更多,所以在后续的实验中选择VDEAEMA∶VDVB= 1∶1的比例合成吸附剂。
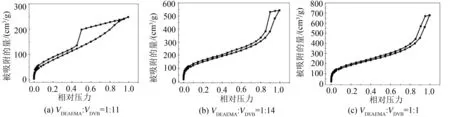
图3 氮气-吸附脱附等温线

表2 吸附剂的结构与性质
2.2 条件评价
2.2.1 溶液pH的影响
对吸附反应而言,pH是影响较大的一个反应条件。因此探讨pH对水中双氯芬酸去除的影响是很有必要的。因为碱性条件下的双氯芬酸与吸附材料均带负电,会产生静电排斥力,所以不研究pH >7的情况。在进行实验之前,用0.3 Mol/L NaOH或HCl将溶液的pH分别调节至2、3、5、7,考察pH对双氯芬酸回收率的影响。在pKa附近的pH范围内,pH的微小变化会导致电离和保留的重大变化。当pH ≤ pKa时,酸性药物都以分子的形式存在,当pH>pKa时,酸性药物电离后带有负电荷。高于其pKa的更高pH会导致酸性目标化合物的电离程度增加,使得酸性药物通过静电作用被吸附。如图4所示,随着pH的增加,回收率也随之增大,当pH等于7时,电离程度最大,所以回收率最大,因此后续的实验的pH都选为7。
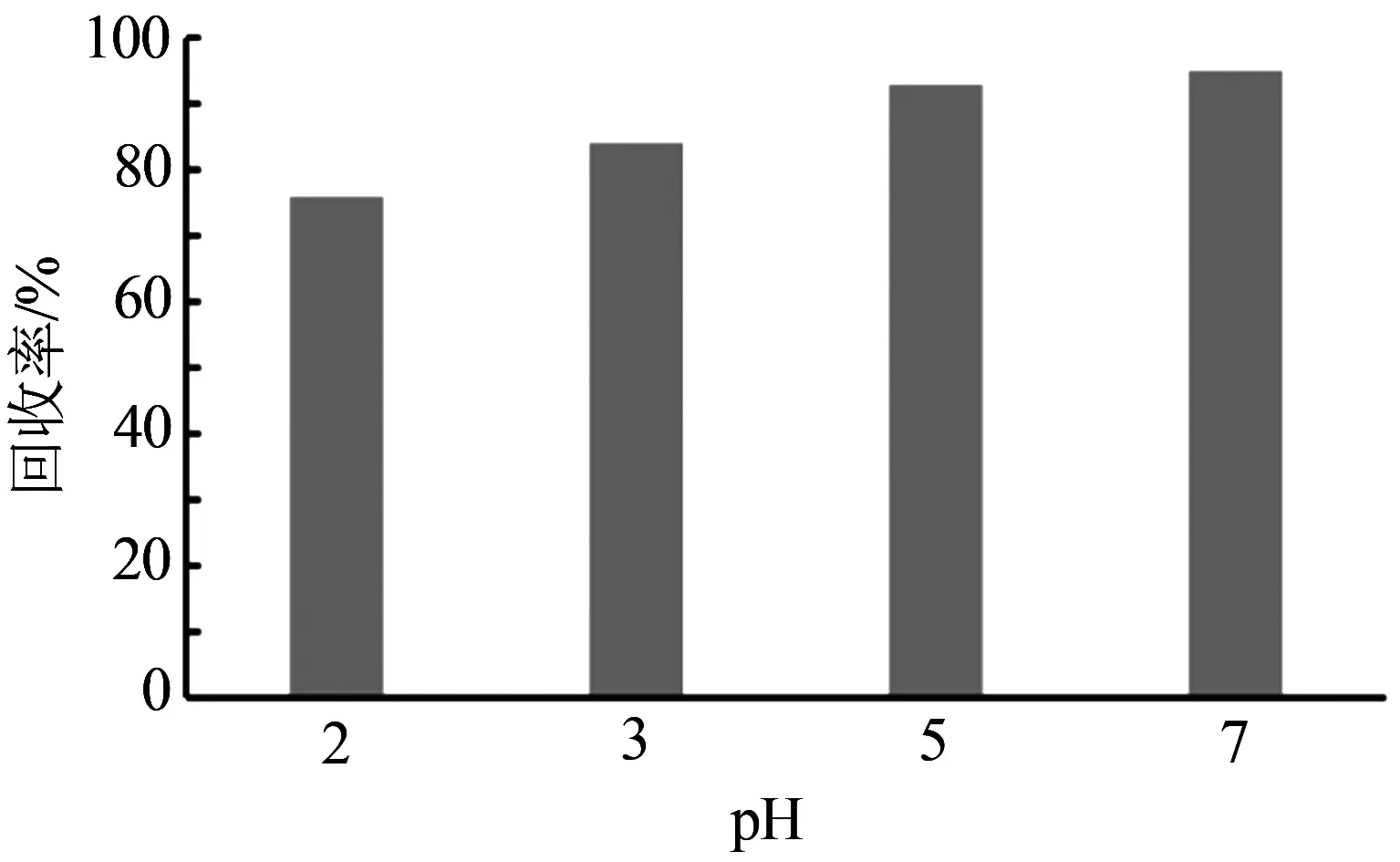
图4 不同pH下的吸附效果
2.2.2 时间对吸附效果的影响
不同时间点双氯芬酸吸附量与吸附时间的关系见图5。将40 mg吸附剂添加到200 mL,200 mg/L的双氯芬酸溶液中。将含有吸附剂与目标药物溶液的锥形瓶于25 ℃、120 r/min的速度充分振摇2 h,将锥形瓶中溶液通过0.45 μm聚四氟乙烯(PTFE)滤膜过滤。
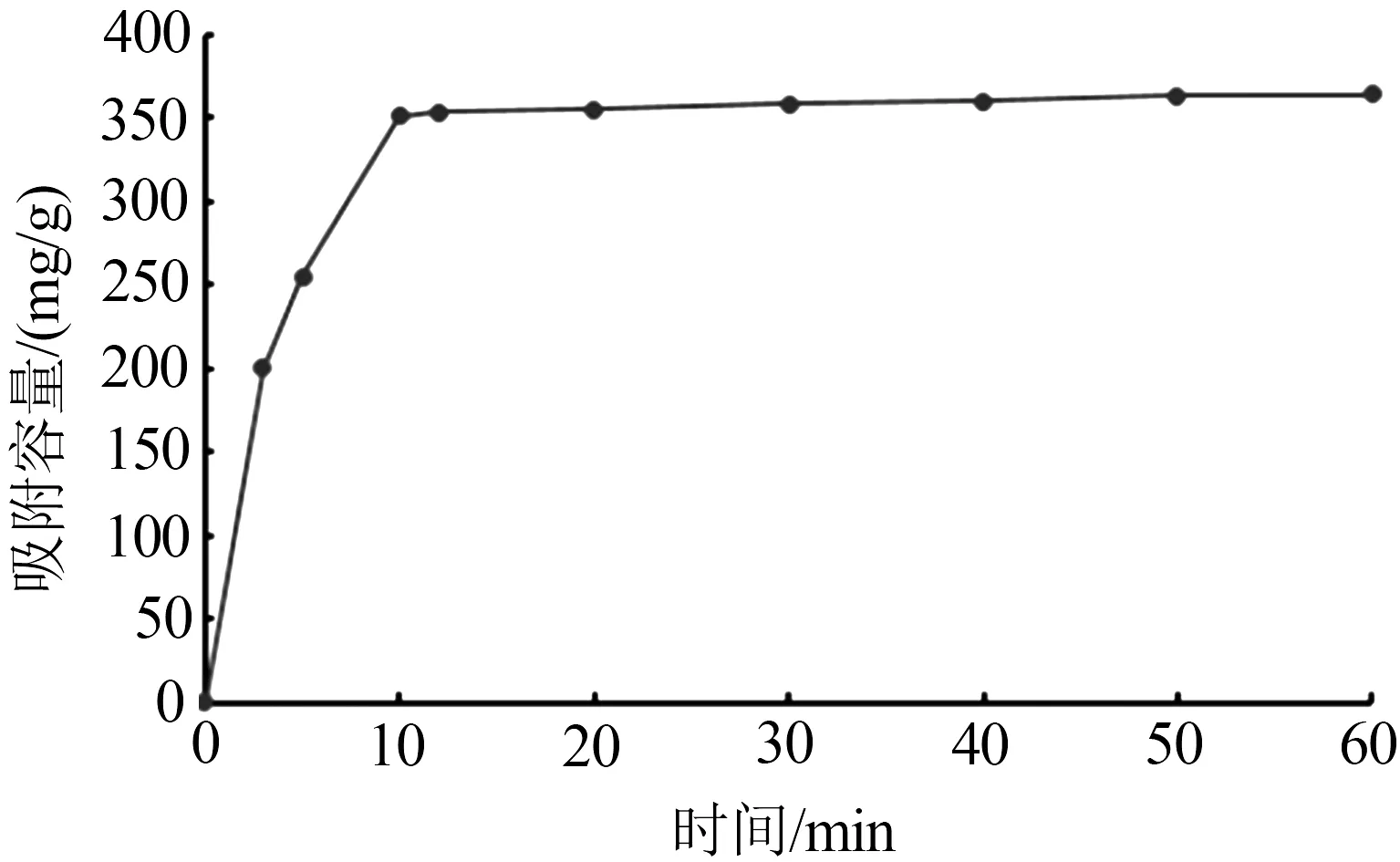
图5 吸附时间对吸附效果的影响
吸附初始阶段,吸附量随着吸附时间的增加(0~10 min)急剧上升,表明在该吸附阶段溶液中的吸附质与吸附剂表面具有较高的亲和力,对双氯芬酸的吸附速度很快,且吸附剂表面充满了未被占用的吸附位点。此后,吸附进入平缓阶段(10~60 min),吸附量的变化趋势较小,对双氯芬酸的吸附基本饱和,吸附过程已经接近平衡。这是因为在吸附的初始阶段,溶液中双氯芬酸浓度最高,吸附剂上的吸附位点也较多,此时吸附剂对双氯芬酸的吸附主要发生在吸附剂外表面,空间位阻作用较小,其外扩散阻力也较小,因此双氯芬酸能快速被吸附;然而,由于吸附剂上旳吸附位点的数量是一定的,随着吸附时间的延长,吸附剂上吸附位点相应减少,同时溶液中吸附质浓度也降低,而且当表面吸附位点被占满之后,吸附质需要向内部扩散,扩散阻力和空间位阻也逐渐增大,因此吸附速率变得缓慢,吸附容量增加的速度变缓。当达到吸附平衡的时候,最大吸附容量为363.5 mg/g。
2.2.3 P(QA-DVB)的再生和重复利用性
可重复利用性是评价吸附材料经济适用性的重要参数。如图6所示,再生吸附剂经过5次吸附-解吸循环后仍保持90%的吸附效率。吸附量随循环次数减少主要是由于一些未被完全洗脱的目标物占据了结合位点,另一个原因就是在洗脱的过程中存在吸附剂的损失。P(QA-DVB)对双氯芬酸去除的良好再生性能进一步证实了所开发的超支化吸附材料可以成为一种很有前途的去除水中双氯芬酸的吸附剂。
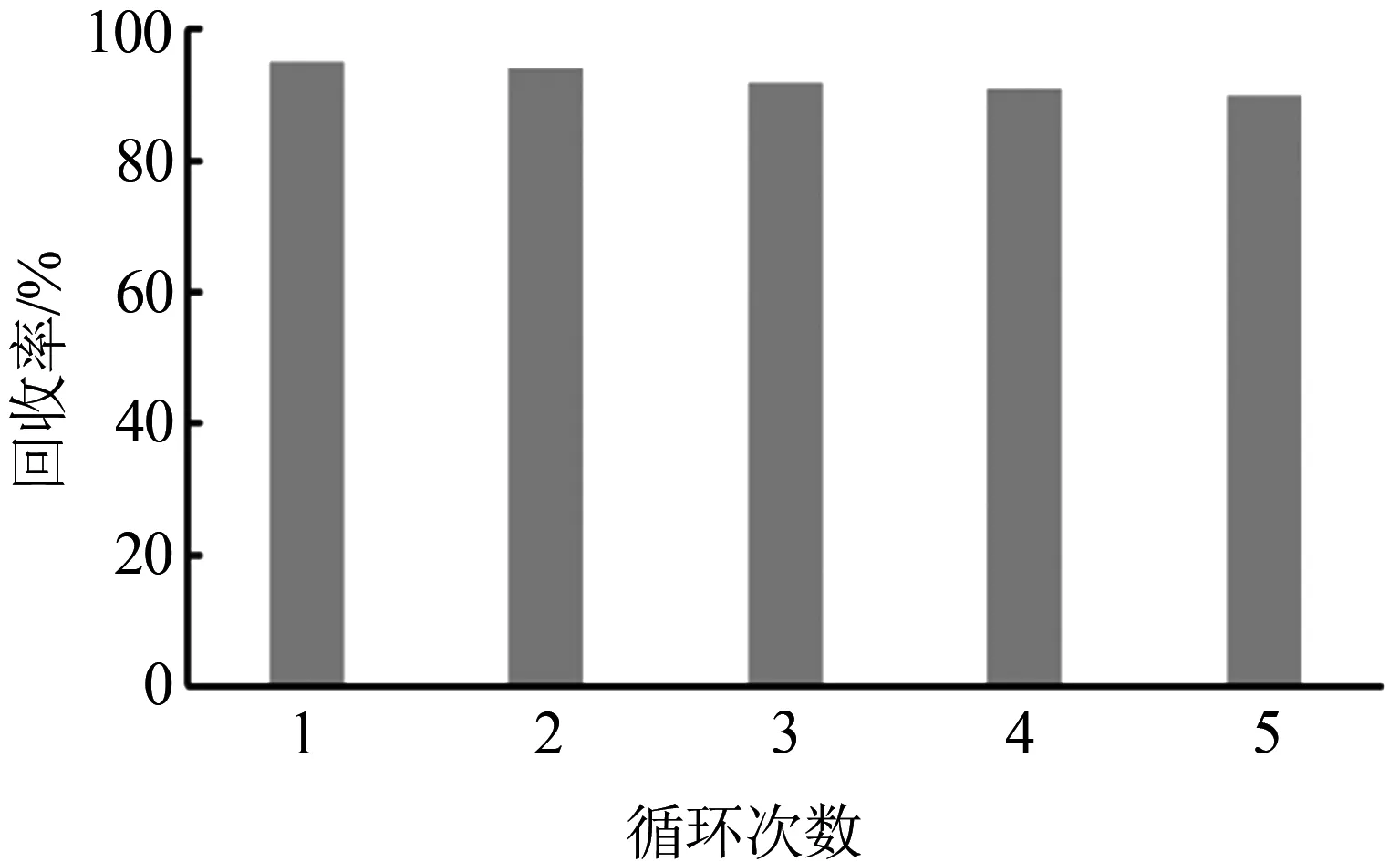
图6 P(QA-DVB)对双氯芬酸回收率的影响
3 结论
(1)本文采用皮克林乳液聚合法制备了粒径均匀的聚合物微球P(DEAEMA-DVB),使用2,3-环氧丙基三甲基氯化铵对P(DEAEMA-DVB)进行环氧化合物季胺化,制备了一种新型的吸附材料P(QA-DVB)。P(QA-DVB)最佳合成条件:SiO2用量为120 mg、VDEAEMA∶VDVB= 1∶1。合成的微球粒径为15~20 μm,大小均匀,比表面积最大,为674 m2g。
(2)在pH为7的条件下,P(QA-DVB)吸附效果最佳。当水中200 mg/L双氯芬酸达到平衡时,其最大吸附容量为363.5 mg/g。5次循环利用,其吸附效率仅降低了5%,说明P(QA-DVB)是一种可重复使用的吸附剂,可用于从水体中去除双氯芬酸,是一种有实用前景的环保材料。

