基于正交试验优选醋氯芬酸分散片制备工艺
文/晏业行 尚海宾 靳利利 杨双杰
本文第一作者晏业行、第三作者靳利利、通讯作者杨双杰均就职于河南诺美药业有限公司;第二作者尚海宾就职于白云山汤阴东泰药业有限责任公司。
醋氯芬酸是一种新型、强效解热、镇痛、抗关节炎药物——为更高效地将醋氯芬酸制成分散片,本文对醋氯芬酸分散片的制备工艺进行了研究。基于正交试验L9(3)4对其主要功能性辅料用量进行了选择,并以分散片的性状、鉴别、有关物质、溶出度等为考察指标,对醋氯芬酸分散片的制备工艺进行了优化。最终制得的醋氯芬酸分散片在各项检查中均符合标准要求,优化的醋氯芬酸分散片制备工艺重现性好,分散均匀、有效成分溶出快,为醋氯芬酸分散片的生产提供了参考依据。
分散片与普通片剂、胶囊剂等固体制剂相比,具有服用方便(可直接吞服、嚼服或在水中分散后服用)、崩解迅速、分散均匀、有效成分溶出快、吸收快和生物利用度高等优点,便于老人、幼儿和吞咽困难的患者用药,是较受欢迎的剂型,便于携带运输贮存[1-4]。
醋氯芬酸是一种新型、强效解热、镇痛、抗关节炎药物,临床上适用于骨关节炎、类风湿性关节炎和强直性脊椎炎引起的疼痛和炎症的症状治疗,难溶于水,常见剂型为普通片剂和硬胶囊剂[5],为利用分散片的优点,将溶解性差的醋氯芬酸制成分散片,对醋氯芬酸分散片的辅料用量和制备工艺进行优化,为醋氯芬酸分散片的生产提供必要的参考依据。
1.实验材料
1.1 设备与仪器
WF-30B型万能粉碎机、CH-200型槽型混合机、YK-160型摇摆式颗粒机、FL-200型沸腾制粒干燥机、SBH-800型三维摆动混合机、ZP37型旋转式压片机、JC-TP型分析天平、BJ-2型崩解测试仪、LC-20AT型高效液相色谱仪以及SDR1911型紫外可见分光光度计。
1.2 试药与试液
乙醇、0.6%铁氰化钾溶液、0.9%氯化铁溶液、1%盐酸、磷酸、醋酸钠、乙酸、双氯芬酸钠、磷酸二氢钾、氢氧化钠以及乙腈。
2.实验过程
2.1 醋氯芬酸分散片制备
(1)因素水平确定
醋氯芬酸分散片规格为0.1 g,制备处方由原料醋氯芬酸,填充剂和崩解剂羧甲基淀粉钠(CMS-Na)、微晶纤维素(MCC)、低取代羟丙纤维素(L-HPC)、交联聚维酮(PVPP)[6-9],甜味剂和矫味剂阿司帕坦[10],润滑剂硬脂酸镁等辅料组成[11-12]。
调节羧甲基淀粉钠用量,选择MCC、L-HPC、PVPP的用量为影响因素,每个因素设3个水平。醋氯芬酸分散片辅料用量正交试验的因素水平详见表1。
(2)实验方法与结果
采用L9(3)4正交表安排试验,以分散片的分散时间为考察指标。正交试验安排及结果详见表2,分散均匀性方差分析结果详见表3。

表2 醋氯芬酸分散片功能性辅料制备工艺正交试验安排及结果
(3)方差分析
从正交试验结果和方差分析可以得知:各因素、水平之间无显著差异,影响最大的因素为A,即MCC,其次为L-HPC,再次为PVPP;影响因素的主次顺序为A>B>C;最佳辅料用量为A3B2C3,即MCC用量为 15%,L-HPC 用量为10%,PVPP用量为 10%。
(4)结果分析
根据醋氯芬酸分散片分散均匀性方差分析,确定醋氯芬酸分散片原料用量,综合考虑各功能性辅料用量,进行醋氯芬酸分散片制备工艺中试验证。
2.2 醋氯芬酸分散片制备工艺中试验证
2.2.1 中试验证方法
天旱时,于移栽前一天的下午在苗床上要浇一次透水,用4.5-6 cm的楠竹刀片起苗,确保根上多带土,移栽后及时淋定根水(淡粪水)以减少伤根并有利于栽后成活与早发苗。
取原料醋氯芬酸约40%,取辅 料:20%的CMS-Na、15%的MCC、 10%的L-HPC以及10%的PVPP 。
制备工艺为:将原料醋氯芬酸粉碎100目,细粉与辅料CMSNa(内加15%该辅料)、MCC、L-HPC、PVPP等置混合机混合10 min→加入润湿剂(纯化水适量)→混合3 min→摇摆制粒(16目)→干燥(温度为70±5℃,时间约为2.5 h)→摇摆整粒(16目)→总混20 min(加入5%的CMS-Na 、2%的硬脂酸镁)→压片(冲头Φ9 mm浅凹、转速控制在25~30 r/min)。每次实验1万片,实验3次。按《中华人民共和国药典(2020年版)》中规定的检验方法进行检验,以颗粒的性状、含量和分散片的性状、鉴别、有关物质、溶出度、分散均匀性、含量等作为综合考察指标,进行醋氯芬酸分散片的中试工艺验证。
2.2.2 颗粒检查
(1)合格标准
颗粒性状:应为白色或类白色颗粒。
颗粒水分:≤2.5%。
颗粒含量:本品所含醋氯芬酸(C16H13Cl2NO4)应为标示量的39.5%~42.5%。
(2)检查结果

图1 颗粒含量检查高效液相色谱图

表4 醋氯芬酸分散片颗粒检查结果
(3)结论
按拟定的醋氯芬酸分散片制备工艺进行制粒中试验证,物料混合、制粒、整粒、干燥、总混等工艺步骤、工艺参数均符合工艺要求,颗粒的性状、水分、含量等各项检查均符合质量标准要求,检验数据重现性好,检查结果符合规定。
2.2.3 分散片检查
(1)合格标准
性状:应为白色或类白色片。
有关物质:供试品溶液的色谱图中,如有与双氯芬酸保留时间一致的色谱峰,按外标法以峰面积计算,不得超过醋氯芬酸标示量的0.4%;其他单个杂质(除阿司帕坦辅料峰外)的峰面积不得大于对照溶液中醋氯芬酸的峰面积(0.2%),其他各杂质峰面积的和不得大于对照溶液中醋氯芬酸峰面积的5倍(1.0%)。
溶出度:限度为不少于标示量的80%。
分散均匀性:应在3 min内全部崩解并能通过710 µm筛网。
含量测定:本品所含醋氯芬酸(C16H13Cl2NO4)应为标示量的95.0%~105.0%。
(2)检查结果
醋氯芬酸分散片检查结果见表5,含量测定见高效液相色谱图2。
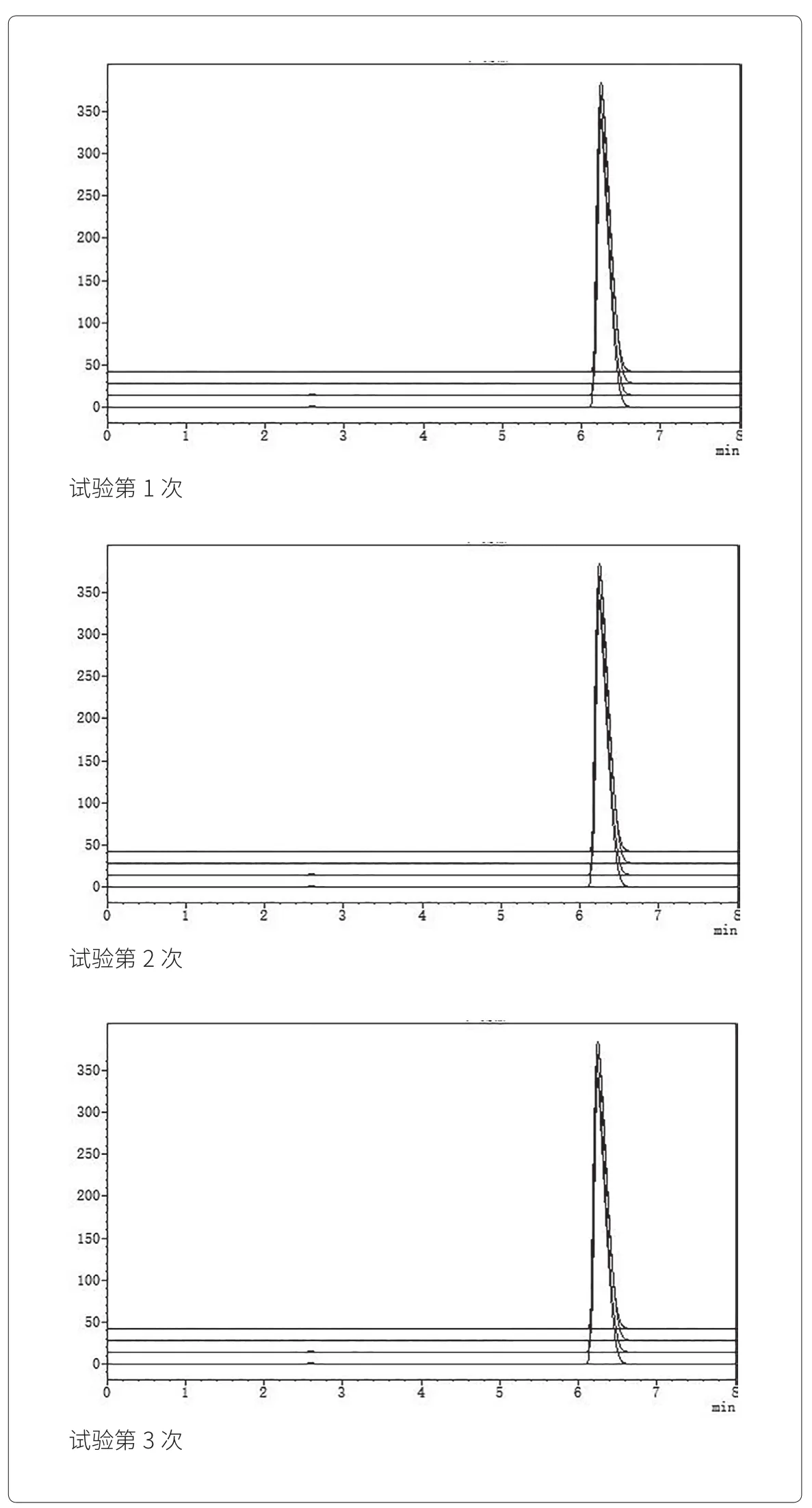
图2 含量测定检查高效液相色谱图
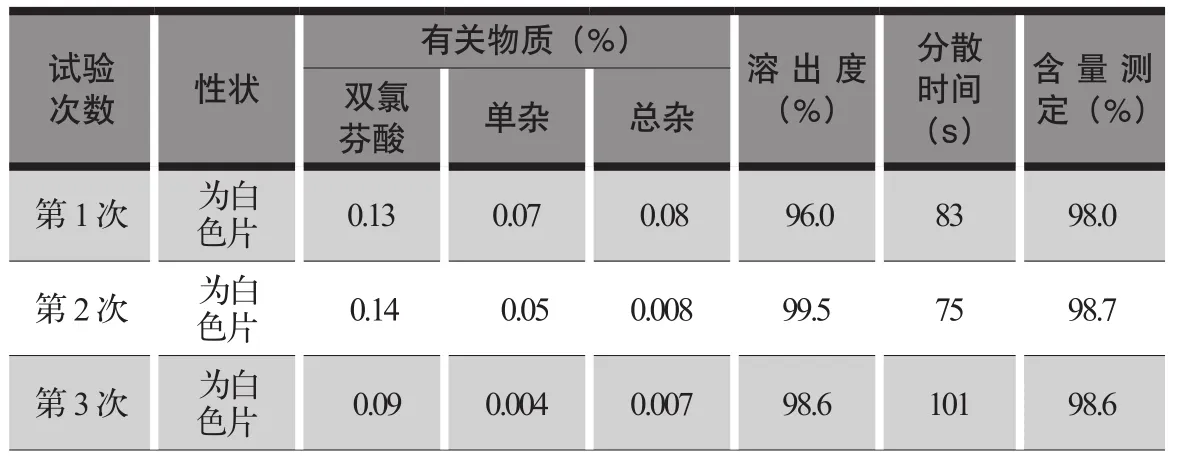
表5 醋氯芬酸分散片检查结果
(3)结论
按拟定的醋氯芬酸分散片制备工艺进行压片中试验证,压片工艺步骤、工艺参数均符合工艺要求,分散片的性状、有关物质、溶出度、分散均匀性、含量测定等各项检查均符合质量标准要求,检验数据重现性好,检查结果符合规定。
3.结语
本文基于正交试验L9(3)4对醋氯芬酸分散片制备工艺进行了优化,并通过中试实验验证了其可用性,为制药企业生产醋氯芬酸分散片提供了一定的参考。
但也应注意到,分散片作为一种固体剂型也有其局限性:在生产过程中,一般会要求将原料药(尤其是难溶性药物)进行微粉化处理,增加了生产工序;由于要选择良好的崩解剂,成本较高;质量要求相对较高,质量标准控制难度较大;分散片的储存条件较一般片剂要求更高,由于分散片使用的崩解剂量较大,吸湿性较强,对包装材料的防潮效果要求更高,这可能会增加包装及储存成本。因此,为充分发挥分散片的效用,还有待对其生产、储存进行全面的探索。

