5-甲氧基水杨醛缩3-羟基-2-萘甲酰肼席夫碱的合成及其荧光性质研究
潘自红,刘巧茹,胡飞宇,曹可生
(1.平顶山学院 化学与环境工程学院,河南 平顶山 467036;2.平顶山学院 应用化学重点实验室,河南 平顶山 467036)
0 引言

课题组在前期席夫碱化合物研究[9-10]的基础上,通过5-甲氧基水杨醛和3-羟基-2-萘甲酰肼反应合成了一种新的席夫碱,并对其与不同金属离子作用前后的荧光性质的变化情况进行了分析,旨在为光致、热致变色发光材料、荧光分子探针的合成及其应用研究奠定理论基础.
1 实验部分
1.1 仪器与试剂
仪器:TENSOR 37型傅里叶变换红外光谱仪(德国Bruker公司); AVANCE Ⅲ HD型核磁共振波谱仪(400 MHz,瑞士Bruker公司);Vario Macro Cube型元素分析仪(德国Elememtar公司);UV-2550型紫外-可见分光光度计(日本 Shimadzu公司);F-7000分子荧光光谱仪(日本Hitachi公司);DF-101S集热式恒温加热磁力搅拌器(河南省予华仪器有限公司).
试剂:5-甲氧基水杨醛;3-羟基-2-萘甲酰肼;Zn(NO3)2·6H2O;AgNO3;La(NO3)3·6H2O; Ce(NO3)3·6H2O;SrCl2·6H2O;Ni(NO3)2·6H2O;Pb(NO3)2·6H2O;CdCl2·2.5H2O;Cu(NO3)2·3H2O;乙醇;二甲亚砜(DMSO);超纯水等.所用试剂均为分析纯.超纯水、自来水经学院制水机处理获得.
1.2 标题席夫碱的合成
1.2.1 实验原理
利用羰基和含有氨基的化合物发生加成-消除反应生成席夫碱.反应方程式如下:
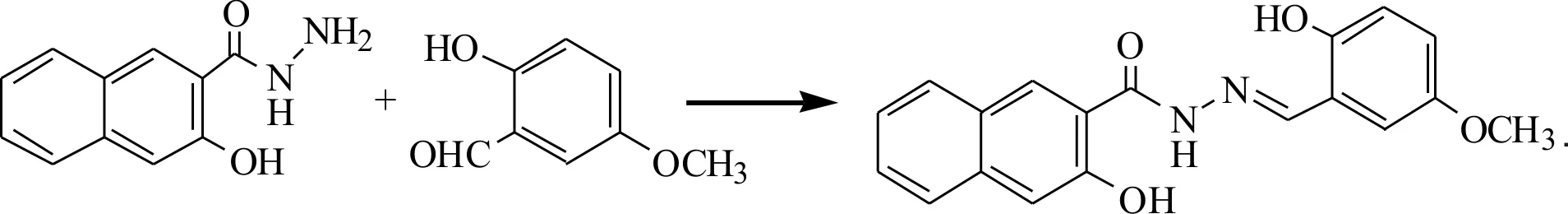
1.2.2 实验过程
精密称取0.304 2 g(2 mmol) 5-甲氧基水杨醛、0.404 4 g (2 mmol) 3-羟基-2-萘甲酰肼置于100 mL圆底烧瓶中,加入40 mL无水乙醇使其溶解,在恒温磁力搅拌中, 78 ℃条件下加热回流反应2.5 h,得黄色溶液.待自然冷却至室温,静置过夜后产生淡黄色沉淀,过滤,用少量乙醇洗涤 2~3次,干燥后得淡黄色粉末状固体0.468 g,产率69.6%.熔点(m.p.):289.5 ℃~290.5 ℃.
1.3 标题席夫碱的荧光性质测定
1.3.1 溶液的配置
精密称取按1.2.2节所述方法合成的标题席夫碱化合物,采用逐级稀释的方法,以DMSO为溶剂配制成浓度为1×10-5mol/L的溶液.以超纯水为溶剂,分别配制含1×10-5mol/L金属离子 (Zn2+、Cu2+、Ni2+、La3+、Ce3+、Sr2+、Pb2+、Cd2+、Ag+)的盐溶液,避光低温保存.
1.3.2 激发波长的确定
首先,用DMSO为参比,通过紫外-可见分光光度计,获取标题席夫碱的最大吸收波长为325 nm.然后,移取一定体积的1.3.1节配制的席夫碱溶液于石英比色皿中,设置激发波长为325 nm,通过分子荧光光谱仪检测席夫碱的荧光发射光谱.最后,依据所得荧光发射光谱中的最佳发射波长反测激发光谱,寻找标题席夫碱的最佳激发波长.
1.3.3 荧光性质检测
首先,选择荧光检测方法,设置325 nm为激发波长和合适的狭缝宽度,检测上述席夫碱配体(L)溶液及其与不同金属离子(如Ag+、Ni2+、Pb2+、Cu2+、La3+、Ce3+、Cd2+、Zn2+、Sr2+等)作用后的荧光发射光谱.
然后,根据荧光发射光谱图分析席夫碱的荧光强度与金属离子作用前后的变化情况,找出有显著变化的特征离子,并对其进行进一步的荧光检测.取席夫碱溶液120 μL,分别加入20 μL、30 μL、40 μL、50 μL、60 μL、80 μL、120 μL、150 μL 浓度为1.0×10-5mol/L的特征金属离子溶液,检测该席夫碱随着特征离子含量变化的荧光发射光谱,根据实验结果推测席夫碱与金属完全络合时的摩尔比.
2 结果与讨论
2.1 红外光谱
主要IR数据(σ/cm-1):3 438,3 356,3 161,3 055,3 018,2 931,1 745,1 651,1 627,1 607,1 562,1 514,1 471,1 365,1 253,1 232,973,727,622.

2.2 核磁共振谱
1H NMR数据(δ/10-6,氘代溶剂为DMSO):10.90(s,1H),10.25 (s,1H),8.70(s,1H),8.46 (s,1H),7.50~7.91(m,3H),7.18~7.37 (m,3H),6.89~7.05(m,3H),3.837(s,3H).

2.3 元素分析
元素分析C19H16N2O4实验值(计算值)/%:C,67.82(67.85);H,4.76(4.79);N,8.31(8.33);O,18.99(19.03).
2.4 标题化合物的荧光激发波长的选择
图1为标题席夫碱在DMSO溶液体系中的荧光激发光谱和发射光谱.
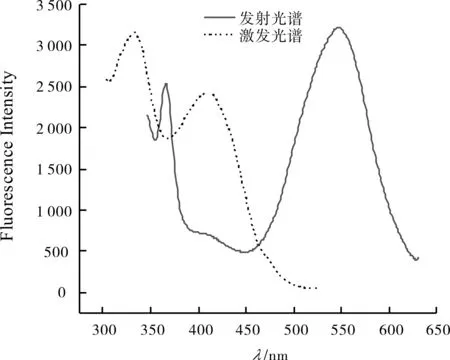
图1 标题席夫碱的荧光激发光谱和荧光发射光谱

2.5 与不同金属离子作用后的荧光发射光谱
设置325 nm为激发波长,狭缝宽度为5 nm,测得该席夫碱与各种金属离子作用前后的荧光发射光谱,如图2所示.

图2 标题席夫碱在不同金属离子作用下的荧光发射光谱
由图2可知,金属离子和席夫碱作用形成的络合物能使席夫碱的荧光强度发生改变,与不同金属离子作用后的最大荧光强度顺序为:Ag+>配体>La3+>Zn2+>Sr2+>Ce3+>Ni2+>Cd2+>Cu2+>Pb2+.当席夫碱溶液中加入Ag+后,荧光强度略有增加,其他金属离子则使席夫碱的荧光强度发生不同程度的减弱,其中 Pb2+使席夫碱的荧光强度降低最显著,甚至出现了荧光猝灭现象.
由图2可以看出,除了Zn2+外,其他金属离子与席夫碱作用后测得发射光谱中最大荧光强度处的发射波长几乎不变,变化幅度在10 nm内.而Zn2+与席夫碱作用后的荧光发射波长减少了40 nm,出现了较明显的蓝移,估计是其在与席夫碱配体结合时的配位模式不同所致[11].
2.6 Ag+、Pb2+含量对席夫碱荧光强度的影响
为了更好地研究变化较大的特征金属离子与席夫碱反应的具体情况,按1.3.3节所述方法,分别精确测量了Ag+、Pb2+的加入量对席夫碱荧光强度的影响.用移液枪精密量取席夫碱溶液120 μL于比色皿中,定量加入不同体积的金属离子溶液,充分反应后,检测不同含量的金属离子与席夫碱作用后的荧光强度,其最大荧光发射强度结果如图3所示.
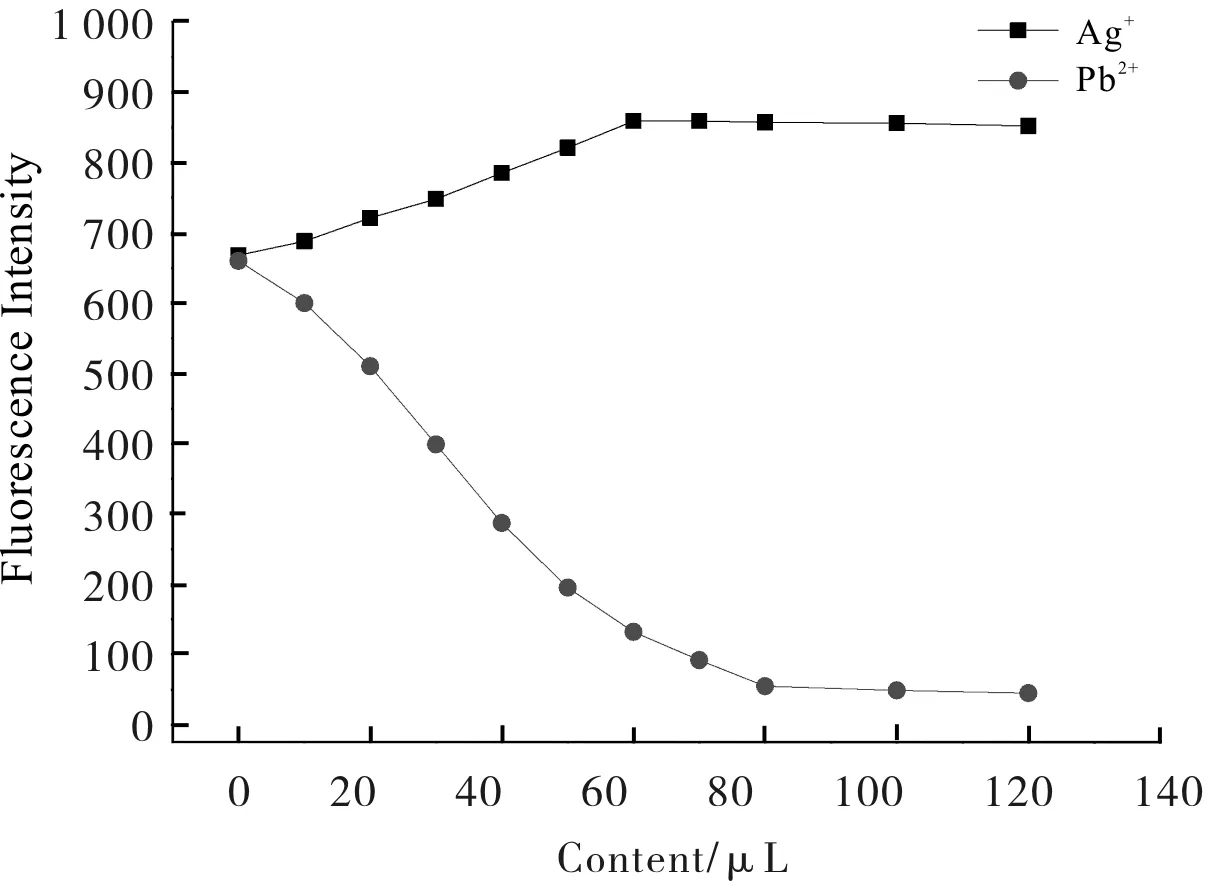
图3 Ag+、Pb2+含量对席夫碱荧光强度的影响
由图3可以看出,随着加入Ag+体积的增加,席夫碱的荧光强度逐渐增加,加入60 μL Ag+溶液时荧光强度增加到最大值,然后趋于稳定.可以推测,当Ag+与席夫碱的含量比为12时,完全络合形成络合物,该络合物的荧光活性大于席夫碱的荧光活性.
随着加入Pb2+体积的增加,席夫碱的荧光强度逐渐降低,当加入80 μL Pb2+溶液时荧光强度降低最大,然后趋于稳定.由此可以推测,当Pb2+与席夫碱的含量比为23时,完全络合形成络合物,该络合物的荧光活性显著降低,出现了荧光猝灭现象.
3 结论
5-甲氧基水杨醛和3-羟基-2-萘甲酰肼反应,合成了一种新的席夫碱化合物,通过红外光谱仪、元素分析仪、核磁共振仪对其结构进行了表征.荧光测试结果表明,不同金属离子能使席夫碱的荧光强度发生不同程度的改变.其中Ag+与席夫碱作用形成配合物后的荧光强度增强,其他金属离子均使席夫碱的荧光强度减小,Pb2+使席夫碱的荧光强度降低最为显著,甚至出现了荧光猝灭现象.由此可以预测,5-甲氧基水杨醛缩3-羟基-2-萘甲酰肼席夫碱与Ag+形成的配合物可作为潜在的荧光材料,该席夫碱亦有望作为荧光分子探针应用于Pb2+的监测及定量分析.

