冷等离子体联合L-谷氨酸与盐胁迫对红小豆萌发富集γ-氨基丁酸的效果及工艺条件
许庆鹏,姜秀杰,张家瑜,魏春红,周航庆,张东杰
(黑龙江八一农垦大学食品学院,黑龙江大庆 163319)
红小豆是一种高蛋白、低脂肪、多营养的小杂粮,在国际上有“红珍珠”的美称。γ-氨基丁酸(γ-Aminobutyric acid,GABA)是一种非蛋白质氨基酸,在动植物中微量存在但具有不可替代的作用。作为植物中一种逆环境生长因子,GABA 在植物萌发生长阶段大量富集。GABA 在动物体内是一种重要的抑制性神经递质,除此之外,还有安神、保肝护肾、降糖降压等多种生理功效。GABA 在2009 年被中国列为新资源食品,并规定其摄入量不得超过500 mg/d[1]。因此,利用植物富集法开发GABA 相关功能性食品更容易得到消费者青睐。
豆类的发芽是一种植物凝集素积累,改善营养均衡的最廉价处理方式。发芽可以使豆子中大分子物质如淀粉、蛋白质和脂肪分解为小分子,还使其中具有生物功能的活性成分如GABA、多酚等急剧升高。国内外学者研究发现以豆类为原料,提供其发芽所需的一般或特殊环境条件,使其抗逆环境基因表达,影响初级代谢、次级代谢物合成,培养成营养价值更高的豆芽[2]。周一峰等[3]研究正常发芽条件下花豆发芽过程中GABA 的变化,发现30 ℃浸泡14 h,35 ℃发芽22 h,GABA 的含量最高为0.40 mg/g。左娜等[4]研究发现通过谷氨酸钠、抗坏血酸等诱导黄豆和绿豆发芽,GABA 富集量分别达到0.3025 mg/g 和0.2783 mg/g。Jiang 等[5]研究发现,真空联合谷氨酸钠胁迫发芽使红小豆中的GABA 含量显著提高,并对相关基因的表达研究发现谷氨酸脱羧酶(Glutamic acid decarboxylase,GAD)基因表达与GABA 的积累呈正相关。吕秋洁等[6]研究比较了L-谷氨酸(L-Glutamic acid,L-Glu)和谷氨酸钠(Monosodium glutamate,MSG)诱导紫糙米发芽,发现LGlu 较MSG 更利于GABA 的积累。曾晴等[7]研究不同盐种类对大豆发芽富集GABA 的影响,发现氯化钠和氯化钙胁迫发芽GABA 含量明显高于氯化钾、氯化镁、氯化铁等其他盐类。因此,通过低氧、超声[8]、冻融[9]、化学物质诱导等技术方法生产高GABA 豆芽或者其他食品是可行的且潜力巨大,尤其是在低温大气压等离子体[10]、酸性电生功能水[11]等新兴技术诱导粮食种子发芽生产高GABA 食品方面缺乏探索性研究。
冷等离子体(Cold Plasma,CP)被认为是物质的第四种状态,仅次于固态、液态和气态。物理上,它是部分或完全电离的气体混合物,含有活性物质,如激发态粒子、活性氧(Reactive oxygen species,ROS)、活性氮(Reactive nitrogen species,RNS)和OH 自由基[12]。现代研究发现等离子体和种子发芽之间的相互作用包括种皮改性、反应物种、种子灭菌、热量和紫外线辐射与分子现象(包括转录和表观遗传调控)相关的表达,可以促进生物活性物质积累,提高芽的生物活性[13-14]。因此使用CP 提高豆芽中生物活性成分是芽菜行业可持续发展的一项有前途的技术。与热加工技术相比,冷等离子体技术具有节能环保、加工效率高、成本低、适用于大型系统等特点[15]。Chen 等[16]研究了冷等离子体处理对发芽糙米中GABA 含量变化的影响,糙米经冷等离子体处理(3000 kV,10 min)后发芽,其GABA 的含量达到最高为28 mg/100 g。CP 技术产品种类有很多,其中在大气压力下产生的非热等离子体,称之冷大气压力等离子体(Cold atmospheric pressure plasma,CAPP)[17]。考虑到未来工厂化生产的简便性及可行性,CAPP 的优点在于不使用低压设备和通入惰性气体的方法下也可产生等离子体气体,因此CAPP 更适用于高GABA 芽菜工厂化生产的实际情况。
目前,CP 已被证明在提高谷物GABA 积累方面具有潜在的作用,但对发芽豆类的研究较少。因此,本实验旨在探究CAPP 处理对红小豆发芽期GABA 的影响,为冷等离子体技术在提高谷物活性物质应用提供研究基础。利用响应面试验对CAPP处理的红小豆发芽培养液进行优化,以期为高GABA芽菜生产提供一些理论参考。
1 材料与方法
1.1 材料与仪器
红小豆 品种珍珠红,大小均匀,直径约0.5 cm,大庆农贸市场购置;γ-氨基丁酸(≥99.9%)Sigma公司;次氯酸钠、苯酚、乙醇、硼酸 分析纯,上海陆都化学试剂厂。
HH-2 数显恒温水浴锅 金坛市科兴仪器厂;CPX3800H-C 超声波清洗机 EMERSON 公司;TU-1810PC 紫外可见分光光度计 北京普析通用仪器有限责任公司;LPWS 恒温恒湿培养箱 上海陆谱科技有限公司;CPS-1 型大气压冷等离子体杀菌机 南京农业大学协同苏州屹润食品科技有限公司及南京屹润等离子科技有限公司联合开发。
1.2 实验方法
1.2.1 红小豆处理及萌发工艺流程 红小豆种子→等离子体处理→培养液浸泡→培养箱发芽→测定芽豆GABA
1.2.2 冷等离子体处理 将随机选取的红小豆种子(每组约200 个)置于样品盒中平铺成一层,将样品盒塑封。打开箱门,将样品盒放在移动平台上缓慢上升至极板距离为40 mm 处,设置冷等离子处理条件为:电压90 kV,频率120 Hz,反应时间20 min(放电时间60 s/次,放电次数20 次)。关闭箱门,开始反应。
1.2.3 培养液浸泡 将冷等离子体处理的红小豆清水洗5 遍并除去悬浮瘪粒,然后用0.1%的次氯酸钠浸泡20 min,用蒸馏水冲洗3 遍,分别用CaCl2溶液、NaCl 溶液、L-Glu 溶液和蒸馏水浸泡15 h。
1.2.4 培养箱发芽 将浸泡后的红小豆放入发芽盒,盖上4 层纱布,放入温度35 ℃湿度85%的培养箱中培养,平均每2 h 向培养箱中红小豆喷淋1 次相应溶液。
1.2.5 单因素实验设计
1.2.5.1 冷等离子体处理时间对GABA 含量的影响 控制等离子体电压90 kV,频率120 Hz,设置反应时间为:0 min(放电时间60 s/次,放电次数0 次)、10 min(放电时间60 s/次,放电次数10 次)、20 min(放电时间60 s/次,放电次数20 次)、30 min(放电时间60 s/次,放电次数30 次)。使用蒸馏水培养液浸泡和喷淋,放入培养箱中发芽,每12 h 取一次样,测定红小豆GABA 含量。
我带着你,走在海边,脑子里又想起了自己童年时的那片海,想起了海边的那几块礁石。小时候,我们还常常爬到礁石上玩,可现在礁石不见了,有人说它们被淹没到了海水里,有人说它们被加工成了度假村里的假山,也有人说它们被冲到另一个海滩去了……
1.2.5.2 冷等离子体处理电压对GABA 含量的影响 控制等离子体频率120 Hz,反应时间20 min,设置电压为:30、60、90、120 kV。使用蒸馏水培养液浸泡和喷淋,放入培养箱中发芽,每12 h 取一次样,测定红小豆GABA 含量。
1.2.5.3 冷等离子体处理频率对GABA 含量的影响 控制等离子体电压90 kV,反应时间20 min,设置频率为:60、90、120、150 Hz。使用蒸馏水培养液浸泡和喷淋,放入培养箱中发芽,每12 h 取一次样,测定红小豆GABA 含量。
1.2.5.4 NaCl 浓度对GABA 含量的影响 控制等离子体电压90 kV,频率120 Hz,反应时间20 min。培养液分别使用25、50、75 mmol/L 的NaCl 溶液浸泡和喷淋,放入培养箱中发芽,每12 h 取一次样,测定红小豆GABA 含量。
1.2.5.5 CaCl2浓度对GABA 含量的影响 控制等离子体电压90 kV,频率120 Hz,反应时间20 min。培养液分别使用2、4、6 mmol/L 的CaCl2溶液浸泡和喷淋,放入培养箱中发芽,每12 h 取一次样,测定红小豆GABA 含量。
1.2.5.6 L-Glu 浓度对GABA 含量的影响 控制等离子体电压90 kV,频率120 Hz,反应时间20 min。培养液分别使用1、2、3 mg/mL 的L-Glu 溶液浸泡和喷淋,放入培养箱中发芽,每12 h 取一次样,测定红小豆GABA 含量。
1.2.6 红小豆芽培养液优化设计 通过对单因素实验结果的分析,按照Box-Behnken 试验设计方案,以GABA 含量为响应值,对发芽时间、CaCl2浓度、L-Glu 浓度、NaCl 浓度四个因素分别取三个水平进行响应面试验,通过Design Expert 13 软件对29 组试验数据进行分析,并预测等离子体处理富集γ-氨基丁酸的最佳工艺条件。试验因素及水平如表1 所示。
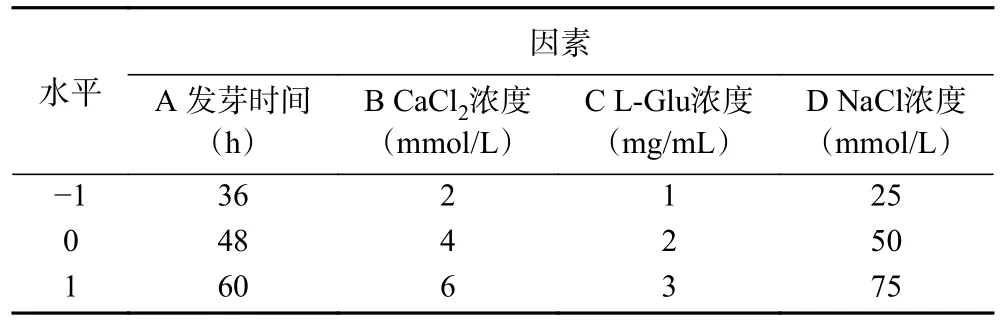
表1 Box-Behnken 试验因素及水平Table 1 Factors and levels of Box-Behnken experiment
1.2.7 GABA 含量测定 参照姜秀杰等[18]的方法稍作修改,将样品烘干粉碎,过100 目筛。用蒸馏水定容到50 mL(样品为1.0 g),30 ℃超声提取2 h,滤纸过滤。8000 r/min 离心10 min,取上清液备用。将GABA 标品配制成0.1、0.2、0.3、0.4、0.5 mg/mL 的标准溶液绘制成标准曲线。取不同浓度标准液或样品上清液1 mL,加入1 mL 硼酸缓冲溶液(pH9.0),2 mL 5%重篜酚溶液(w/v),1 mL 10%次氯酸钠溶液,充分混匀。沸水浴10 min,冰水浴降温约15 min,溶液颜色由黄色慢慢变为蓝绿色,待化合物颜色稳定后加入60%乙醇2 mL,再次混合均匀。645 nm 波长下测定吸光度。
1.3 数据处理
2 结果与分析
2.1 未处理与不同CAPP 时间处理对红小豆发芽过程中GABA 含量的影响
本实验中从种子吸水达到饱和的状态开始计时,即发芽0 h。在正常发芽情况下,发芽72 h 红小豆的营养生长阶段基本结束并开始生殖生长阶段[19],此时其内部结构发生较大改变不再适合人类食用,因此发芽时间在72 h 之后的芽豆不再测定GABA。
GABA 属于抗逆环境的活性物质,起促进生长代谢作用,随发芽时间不断延长,在芽成熟后植物体内便也达到平衡状态[20-21]。观察未处理与处理组红小豆发芽过程中GABA 富集量的变化见图1,在发芽0~72 h 内,红小豆在正常发芽条件(未等离子体处理)下,随发芽时间的延长GABA 含量不断增加;CAPP 处理的红小豆随发芽时间的增加GABA 含量不断增加,但在发芽48 h 后不再明显升高。造成这种现象的原因是等离子体可以缩短种子萌发期,Filatova 等[22]研究等离子体有促进种子早熟作用,结果表明石竹种子在等离子体作用下,种子胚内的生命物质被激活,种皮软化,从而加快了种子萌发和出苗的速度。

图1 未处理和不同CAPP 时间对红小豆发芽过程中GABA 含量的影响Fig.1 Effects of untreated and different CAPP time treatments on GABA content during germination of adzuki bean
未处理与不同CAPP 时间处理的红小豆在同一发芽时间GABA 富集量的变化见图1。在发芽0~24 h 阶段,正常发芽的红小豆GABA 含量缓慢上升,而等离子体处理组GABA 含量增加明显。造成该现象的原因可能是CAPP 处理的红小豆吸水速度快,吸水程度高,快速激活了种子中的内源酶。种子吸收水分程度取决于三个因素:种子的组成、种皮的湿润性和水分[23]。相同种子和水分情况下,等离子体处理可以改变种子表面的化学结构和粗糙度,导致种子的湿润性发生巨大变化。已有研究证实空气等离子体处理后种皮与水的表观接触角急剧减小,导致种子的湿润性增加[24-25]。ALVES JUNIOR 等[26]更深入研究等离子体处理对豆科种子吸水两大部位(珠孔和肺门)的变化,发现离子体处理增加肺门的水分吸收量,同时珠孔表现出更开放的形态。在发芽24~48 h 时,CAPP 处理20 min 和30 min 的红小豆GABA富集效果都较好。在发芽48~72 h 时,只有CAPP处理20 min 组的GABA 富集效果较好,且含量较高。造成这种情况的原因可能是等离子体处理种子的时间越长,ROS 和RNS 对种子的刺激越大,伤害越深。因此,在红小豆发芽前期等离子体刺激越大合成GABA 越多。当等离子体时间为20 min,在发芽48 h 就达到顶峰,为104.601±1.192 mg/100 g。发芽72 h 时最高为106.718±1.030 mg/100 g,但从成本方面考虑选择等离子体处理时间为20 min,发芽时间48 h。
2.2 CAPP 电压对红小豆发芽过程中GABA 含量的影响
控制冷等离子体装置的时间为20 min,频率为120 Hz 不变,观察红小豆正常发芽与不同等离子体电压在发芽过程中GABA 富集量的变化。由图2可知,使用不同电压等离子体处理的红小豆,其GABA 含量随发芽时间延长而不断增加,最后趋于平衡。其中等离子体电压为120 kV 处理红小豆,其GABA 含量呈先上升后下降趋势。除电压为120 kV外,各组等离子处理的红小豆都呈上升趋势,且电压越大,红小豆GABA 含量越高。原因可能是种子在等离子体处理过程中,电压越高空气被电离的混合物越多,混合物中多种活性基团和粒子能够与种皮及表面微生物的发生更强烈的反应[27],从而促进种子吸水,阻碍微生物生长,使种子更易发芽,GABA 含量升高。若对红小豆离子体处理电压过高,则没有上述的生长代谢趋势,反而有部分的豆子表面出现明显的电流打击的伤痕,其伤口破坏了豆子的免疫屏障,容易被有害微生物入侵。当等离体电压为120 kV,红小豆发芽时间为24~72 h 阶段内,其GABA 呈先下降后不变的趋势,说明电压过大时对种子的萌发以及GABA 富集有抑制作用,其抑制机理有待深入研究。何瑞等[28]研究也发现相同结果,当大气压等离子体处理电压为3.4 kV 时最有利于穿心莲种子萌发,继续加大电压,当大气压等离子体处理电压为5.95 kV 时则对穿心莲种子的萌发有强烈抑制作用。因此控制一个合适的等离子体电压才能最有利于种子萌发,针对不同种子其最佳等离子体电压也不同。因此,针对CAPP 处理红小豆种子最佳电压为90 kV。
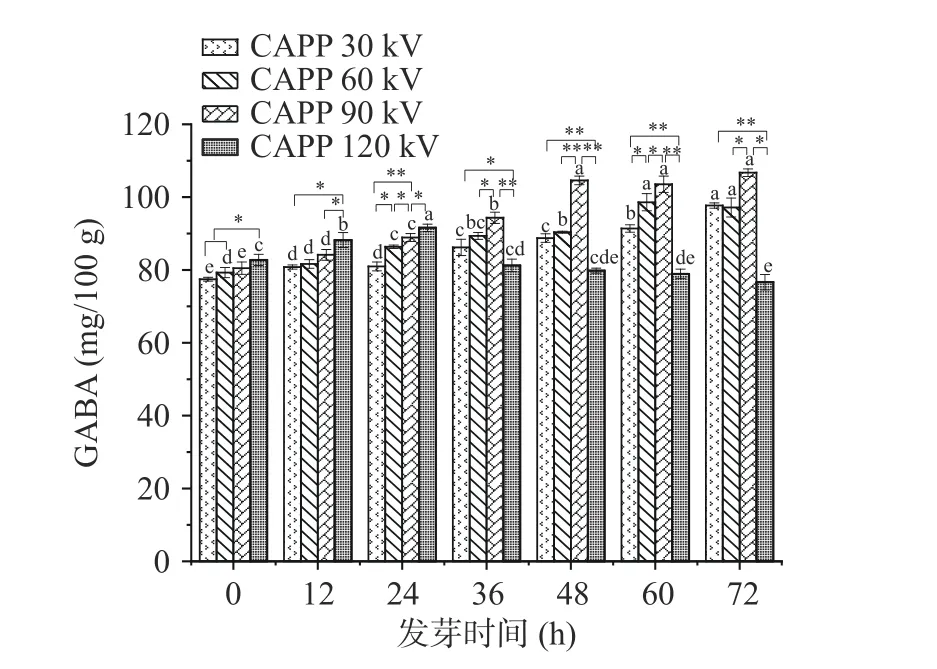
图2 CAPP 电压对红小豆发芽过程中GABA 含量的影响Fig.2 Effect of CAPP voltage on GABA content during germination of adzuki bean
2.3 CAPP 频率对红小豆发芽过程中GABA 含量的影响
控制冷等离子体装置的时间为20 min,电压为90 kV 不变,观察不同等离子体频率条件下红小豆发芽过程中GABA 富集量的变化。由图3 可知,不同频率的等离子体处理红小豆,随萌发时间的延长,其GABA 含量呈先升高后平稳的趋势。等离子体处理频率越高其GABA 富集的含量也越高。120 Hz 和150 Hz 等离子体处理红小豆,发芽48 h 之后GABA含量分别达到最高为104.601±1.192 mg/100 g 和101.467±2.225 mg/100 g,两者无显著性差异,继续发芽其GABA 含量也无明显变化。已有研究表明通过优化原料基质特性(如水分含量)和调整等离子体电源设置(电压,频率)以增加反应物质的产生,可以提高微生物灭活效率[29]。但因红小豆表面呈拓扑结构,具有空隙和波纹化的粗糙表面可以在一定程度上保护植物细胞和表面微生物免受等离子体产生的ROS 和RNS 侵害[30]。改变冷大气压等离子体机器的频率是加速种子吸水,发芽,增加植物幼苗生长的有效手段。频率小于90 Hz 时等离子体的处理效率较低,对微生物抑制作用较低,对刺激红小豆发芽作用也较弱,频率在120~150 Hz 时等离子体处理对红小豆的刺激较大,有利GABA 的富集。因此,为延长机器使用寿命,等离子体处理红小豆的最佳频率为120 Hz。
2.4 NaCl 对红小豆发芽过程中GABA 含量的影响
将等离子体处理的红小豆分为4 组,依次喷洒不同浓度的NaCl 溶液,观察不同浓度NaCl 溶液处理的红小豆发芽过程中GABA 的富集情况。由图4可知,CAPP+NaCl 处理组的GABA 含量高于等离子体处理组。随着NaCl 的浓度增加,GABA 的含量呈先升高后减小的趋势,当发芽时间为48 h,NaCl 浓度为50 mmol/L 时,GABA 含量达到最高为122.456±1.888 mg/100 g。这是因为NaCl 对植物富集GABA的两条途径都有促进效果。AL-QURAAN 等[31]研究NaCl 对发芽小麦进行处理发现5 个品种小麦的GAD基因表达上调。因此,在GABA 支路途径中NaCl 会上调红小豆GAD的相关基因表达,提高GAD酶活性,富集GABA。在多胺降解途径中,XING等[32]研究表明在NaCl 处理下,大豆胚根的二胺氧化酶(Diamine oxidase,DAO)活性增强,促进多胺(Polyamines,PAS)降解,富集GABA。Yang 等[33]研究发现NaCl 处理使豆芽氨基醛脱氢酶(Aminoaldehyde dehydrogenase,AMADH)、GAD 和DAO活性分别提高了39.7%、28.4%和21.2%。除此之外,还有研究表明NaCl 刺激植物产生氧化应激,不仅会提高超氧化物歧化酶和过氧化氢酶活性,还能增加苯丙氨酸氨裂解酶,肉桂酸4-羟化酶和4-香豆酸辅酶A 连接酶的活性和表达,这些反应与表达也会减小GABA 合成抑制剂的作用[34-35]。因此,25~75 mmol/L 的NaCl 培养液有利于CAPP 红小豆富集GABA,50 mmol/L NaCl 培养液效果最佳。
2.5 CaCl2 对红小豆发芽过程中GABA 含量的影响
将正常发芽的红小豆分为4 组,依次喷洒不同浓度的CaCl2溶液,观察不同浓度CaCl2溶液处理的红小豆发芽过程中GABA 的富集情况。由图5可知,CAPP+CaCl2处理的豆子随发芽时间延长,GABA 呈先升高后降低的趋势。2 和4 mmol/L CaCl2处理的红小豆在发芽在48 h 后才有明显差异,4 mmol/L CaCl2处理的红小豆富集效果更好。4 mmol/L CaCl2处理的红小豆在发芽48 h 时达到最高为114.62±1.593 mg/100 g。植物中的GABA 合成主要来自GABA 支路中由谷氨酸脱羧酶(GAD)催化的不可逆的α-谷氨酸脱羧反应[36]。GAD 是一种Ca2+/钙调蛋白依赖型酶,具有一个钙调蛋白结合区,其活性受Ca2+/Ca M 控制[37]。王珊珊等[38]研究表明提高培养液中Ca2+浓度,促进Ca M 区域与钙离子结合可以提高GAD 的活性,从而加快谷氨酸合成GABA。朱云辉等[39]研究发现Ca2+浓度达到6.0 mmol/L 时,发芽苦荞中GABA 含量达到最大,此后随着Ca2+浓度增大,GABA 含量呈减小趋势。因此,CaCl2在2~6 mmol/L范围内处理红小豆发芽有助于富集GABA,4 mmol/L的CaCl2培养液效果最佳。

图5 CaCl2 对红小豆发芽过程中GABA 含量的影响Fig.5 Effect of CaCl2 on GABA content during germination of adzuki bean
2.6 L-Glu 对红小豆发芽过程中GABA 含量的影响
将正常发芽的红小豆分为4 组,依次喷洒不同浓度的L-Glu 溶液,观察不同浓度L-Glu 溶液处理的CAPP 红小豆发芽过程中GABA 的富集情况。由图6 可知,随发芽时间的延长,GABA 的含量呈先增加后下降的趋势,当使用L-Glu 浓度为1、2 mg/mL处理CAPP 红小豆时,发芽48 h 达到最大为117.518±1.634、118.264±1.804 mg/100 g。L-Glu 是谷氨酸脱羧酶(GAD)的唯一底物[40]。在外源溶液中添加LGlu 可以提高植物的渗透调节能力,增加底物从而增加GABA 含量。长时间限制谷氨酰胺合成,或减少蛋白质合成,或增加蛋白质降解,可使GABA 富集,这是由于谷氨酸含量增多可使GABA支路中碳流量增加,并调节谷氨酸脱羧酶的活性[41]。陈慧等[42]用1.0 mg/mL 的MSG 溶液处理蚕豆发芽,结果发现GAD 活性变化趋势与GABA 含量变化相似。因此,使用1~3 mg/mL 的L-Glu 培养液可以提高红小豆GAD 的酶活,增加GABA 含量。2 和3 mg/mL 的L-Glu 培养液效果都较好,且差别不大。
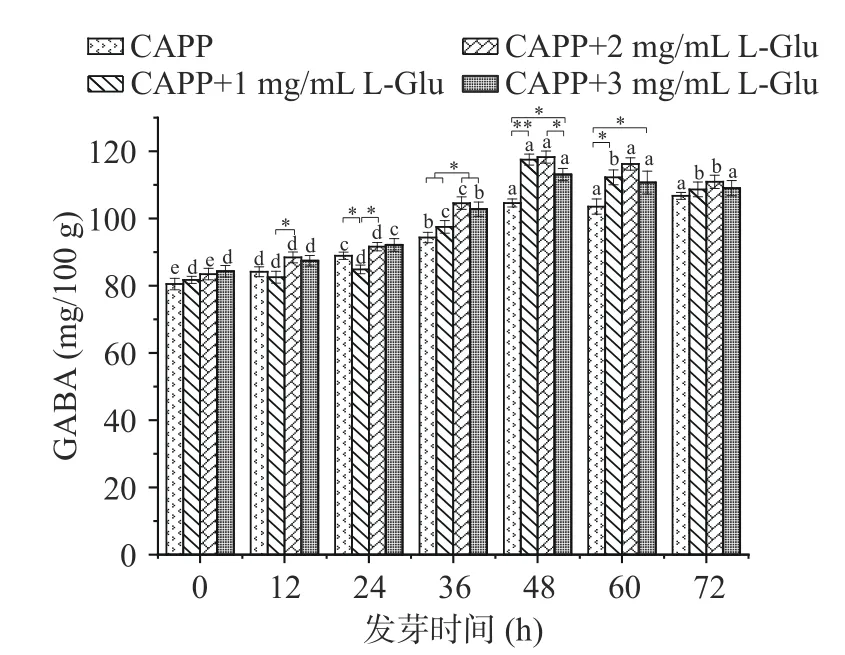
图6 L-Glu 对红小豆发芽过程中GABA 含量的影响Fig.6 Effect of L-Glu on GABA content during germination of adzuki bean
2.7 响应面优化GABA 富集工艺
2.7.1 回归模型的建立及方差分析 通过单因素实验结果,发现冷等离子体处理90 kV,120 Hz,20 min 红小豆种子有利于发芽和富集GABA,且NaCl、CaCl2和L-Glu 溶液三种诱导环境下,红小豆发芽后GABA 的富集量都明显提高。确定了4 个因素对L-Glu 联合盐胁迫发芽CAPP 红小豆富集GABA 的影响的4 水平,对29 个试验组进行3 次重复测量,响应面试验设计及结果见表2。

表2 响应面试验设计及结果Table 2 Response surface design and results
在此基础上,利用Design-Expert 13 软件对响应面进行设计与分析,并建立回归模型,得出二元回归方程为:
回归模型方差分析结果见表3。由表3 可知,一次项A、D 与交互项AD 和二次项A2、B2、C2、D2表现为高度显著(P<0.01),一次项B 与交互项CD表现为显著(P<0.05)。模型总体极显著(P<0.0001),说明预测结果与真实结果有相关性,决定系数R2=0.8970,失拟项不显著(P>0.05),说明残差是由随机误差引起。因此可知该模型拟合度较高,且误差在可接受范围内,表明可用于预测L-Glu 联合盐胁迫发芽CAPP 红小豆富集GABA 工艺参数。根据二元回归方程中一次项系数绝对值的大小,判定各因素对响应值影响的主次顺序为发芽时间(A)>NaCl 浓度(D)>CaCl2浓度(B)>L-Glu 浓度(C)。

表3 响应面回归模型方差分析Table 3 Analysis of variance with response surface regression model
2.7.2 响应面交互作用分析 响应面是用于描述因素与响应值之间关系的三维空间曲面图,可直观反映出各因素之间的交互作用,及其对L-Glu 联合盐胁迫发芽富集CAPP 红小豆GABA 含量的影响程度。图7~图8 呈现的是对红小豆富集GABA 有显著交互作用的响应面和等高线图。响应面坡度越陡峭,则表明响应值越敏感。
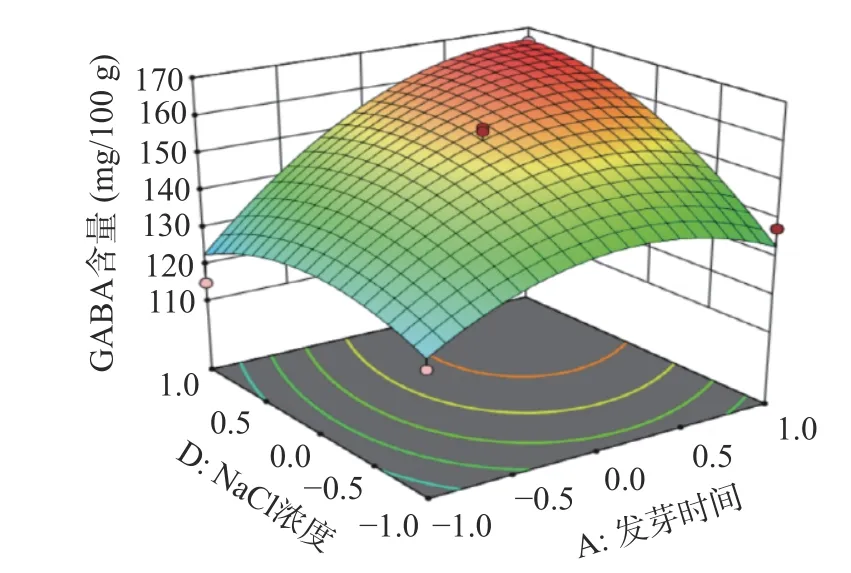
图7 发芽时间和NaCl 浓度交互作用的响应面图Fig.7 Response surface plots of the interaction between germination time and NaCl concentration
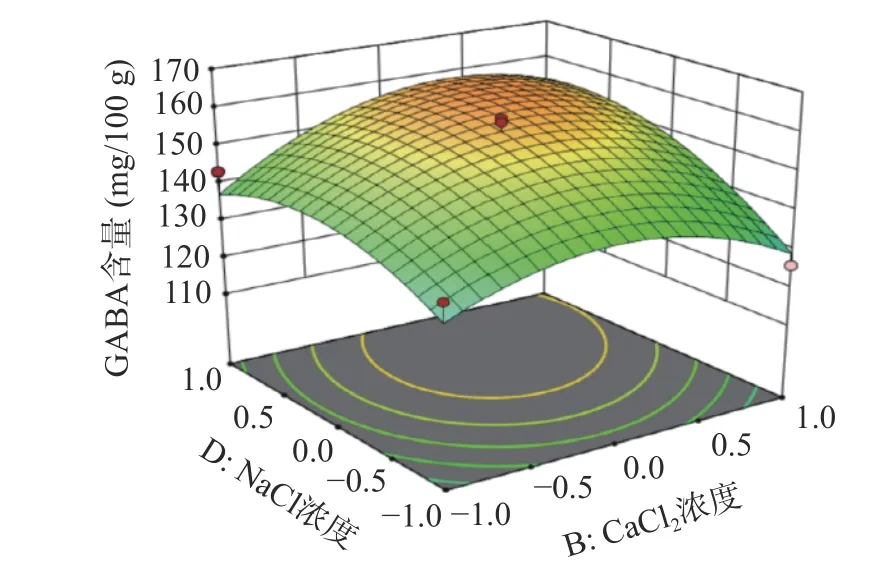
图8 CaCl2 和NaCl 浓度交互作用的响应面图Fig.8 Response surface plots of the interaction between CaCl2 and NaCl concentrations
发芽时间、NaCl 浓度二次项对发芽红小豆GABA 含量有显著影响,且等高线图呈椭圆状。由图7 可知,A、D 因素在较高水平条件下,响应值随着每个因素水平的增大而增大,当响应值增大到极值后,又逐渐减小。由于GABA 是红小豆在发芽时期合成的抗逆环境活性物质,尤其是在胚部分含量较多,随着胚芽发育其不断合成,当胚芽发育成熟其GABA 含量便不会明显增加。还有一种观点也认为NaCl 浓度增加会促进红小豆合成GABA,尹永祺等[43]研究发现NaCl 胁迫下多胺降解途径对大豆发芽富集GABA 贡献率大于30%。但盐离子浓度过高,超过植物承受的极限,就会导致GABA 的含量降低,最终表现为GABA 含量增加到极点后又逐渐减少。由图8 可知,NaCl 浓度和CaCl2浓度都增加对发芽红小豆GABA 含量明显提高,呈相互促进作用。任珺等[44]研究发现CaCl2有助于苦豆子的萌发和生长,有减轻盐胁迫的作用。当外源Na+将细胞质膜上的Ca2+取代,引起Na+浓度增加,Na+/Ca2+比值的平衡遭到破坏,此时外源Ca2+会通过细胞质膜和内膜的钙通道进入细胞质中,促进Ca M 区域与钙离子结合提高GAD 的活性,从而加快谷氨酸合成GABA[45]。外源Ca2+的施加也能促进细胞对K+和NO3-的吸收,补充细胞内Ca2+的不足,保护膜的稳定性,降低盐胁迫下离子毒害作用[46]。
2.7.3 最优条件的确定及验证 利用Design-Expert 13 软件对回归模型进行典型分析得到:发芽时间A=0.810551、CaCl2浓度B=0.179352、L-Glu 浓度C=0.21802、NaCl 浓度D=0.638318,将四个因素编码值转换成实际值为:发芽时间57.72 h、CaCl2浓度4.36 mmol/L、L-Glu 浓度3.22 mg/mL、NaCl 浓度65.95 mmol/L,上述为L-Glu 联合盐胁迫发芽富集CAPP 红小豆GABA 的最优工艺参数,在此条件下发芽CAPP 红小豆的GABA 含量是166.111 mg/100 g,为了验证回归分析的可靠性,将前期回归模型优化工艺参数调整为:发芽时间58 h、CaCl2浓度4.4 mmol/L、L-Glu 浓 度3.2 mg/mL、NaCl 浓 度66 mmol/L。按照上述最优发芽条件参数进行三次验证实验,结果得出发芽CAPP 红小豆GABA 含量的实际值是(160.23±2.91 mg/100 g),理论值与实际值的相对误差仅为3.54%,说明上述模型拟合较好,具有实际应用价值。
3 结论
本实验使用大气压冷等离子体装置处理红小豆种子联合盐胁迫的方法探究对其发芽富集GABA 的影响,发现大气压冷等离子体90 kV,120 Hz,20 min处理的红小豆种子最有利于发芽富集GABA。NaCl、CaCl2和L-Glu 都具有诱导豆类发芽富集GABA 的作用,且NaCl>CaCl2>L-Glu。再利用响应面优化最佳条件为发芽时间58 h、CaCl2浓度4.4 mmol/L、LGlu 浓度3.2 mg/mL、NaCl 浓度66 mmol/L,此条件下发芽CAPP 红小豆GABA 含量为160.23±2.91 mg/100 g,是原料红小豆GABA(22.5±0.2 mg/100 g)的7.12 倍。说明CAPP 红小豆在发芽过程中,辅以L-谷氨酸和盐处理,可有效提高GABA 富集量,进一步证明了萌芽有利于提升红小豆中营养活性成分,为合理利用杂粮豆类资源以及开发高GABA 功能食品提供新的思路和理论支持。但对于L-谷氨酸联合盐胁迫CAPP 红小豆发芽富集GABA 过程中体内的离子浓度及酶活力的变化未进一步探究,为深入了解红小豆发芽富集GABA 机制,后续可对GABA 合成相关酶的酶活及代谢途径进行研究。

