二甲双胍减轻阿霉素诱导的心脏毒性:基于AMPK通路
魏 佳,杨 强,林 琳,朱参战,魏 瑾
西安交通大学第二附属医院心内科,陕西 西安710004
阿霉素(DOX)又名多柔比星,是一种作用于人体DNA 的药物,从而阻断肿瘤细胞增殖和诱导细胞凋亡。广泛使用于化学治疗,其属于蒽环类抗生素家族[1]。然而阿霉素在临床使用时会产生不可逆的甚至可能危及生命的心脏损伤,包括各种类型的心律失常、心包及心肌炎、急性高血压、充血性心力衰竭甚至死亡,这导致临床实践中对这些药物的使用受到限制[2]。尽管经过了近60年的研究,阿霉素引起的心脏毒性的机理仍未被完全理解,涉及不同的潜在途径,从而导致心肌细胞死亡[3]。近年来研究发现,降糖药二甲双胍可降低阿霉素心脏毒性[4,5]并增加其抗癌活性[6]。其中涉及到体内一种重要的能量代谢通路——腺苷酸活化蛋白激酶(AMPK)通路[7]。然而,现有研究却存在一些争议,如在恒河猴实验使用AMPK的激活剂—MK8722(其是一种对12种哺乳动物AMPK通路的直接变构激活剂)后发现使用MK8722可引起心脏肥大,大鼠实验中给药6个月后心脏质量的增加比给药1个月后更大(表现为心电图QRS振幅增加)[8]。而目前对于二甲双胍抗阿霉素心脏毒性的疗效及其分子机制尚不明确。
因此,我们拟从以下几个方面进行初步探讨:①二甲双胍对于阿霉素引起的心脏毒性过程中起何种作用;②二甲双胍在对于阿霉素心脏毒性的保护作用是否通过AMPK通路;③AMPK通路在阿霉素心脏毒性中的作用是有利的还是有害的。如何改善和治疗阿霉素所致的心脏毒性一直是医学领域所关注的热点,本研究拟为二甲双胍防治阿霉素性心脏毒性提供一定的理论与实践依据。
1 资料和方法
1.1 临床研究
1.1.1 研究对象 西安交通大学第二附属医院2016年1月~2019年1月就诊的髓系白血病、非霍奇金淋巴瘤、乳腺癌联合使用阿霉素(盐酸表柔比星60 mg/m2或盐酸吡柔比星20 mg/m2或盐酸多柔比星50 mg/m2)进行阶段性化疗患者共123例为研究对象。其中43例联用二甲双胍(200 mg/d,试验组),80例未联用二甲双胍(对照组),对医疗数据库中记载的医疗记录及病历文件进行了回顾性分析。本研究为回顾性研究,已获批西安交通大学第二附属医院伦理委员会批准(2023308)。
1.1.2 排除标准 合并2型糖尿病使用二甲双胍者、联合服用抗心律失常药物或β受体阻滞剂等药物者。
1.1.3 研究方法 首先对两组患者进行基线资料对比,再使用自身对照及组间对照方法,回顾分析两组患者用药前后心肌损伤指标[血磷酸肌酸激酶同工酶(CKMB)水平、乳酸脱氢酶(LDH)水平]及心衰指标[血B型钠尿肽(BNP)水平、左心室射血分数(LVEF)、左室短轴缩短率(LVFS)]等的变化。
1.1.4 质量控制 本研究中患者心脏彩超由我院超声研究室专业医师进行测量校对,血液资料均由所在科室专业护士一对一采集,统一送往我院检验科进行分析,使用贝克曼生化分析仪进行检测。根据ISO15189《医学实验室-质量和能力的要求》检测心肌损伤及心衰相关指标,检测项目参加卫生部临检中心室间质量评价合格,室内质量控制日常开展并处于在控状态。
1.1.5 统计学分析 用Excel收集数据,使用SPSS 18.0软件进行统计分析。上述心肌损伤指标及心衰指标以均数±标准差表示,数据服从正态分布,组内前后比较及组间两两比较均采用t检验,使用Graphpad Prism 9.0软件作图,P<0.05时认为差异具有统计学意义。
1.2 基础研究
以24只6周龄AMPK α2敲除(AKO)小鼠为实验对象,24只6周龄野生型C57BL/6小鼠(WT)为对照(其中雄性12只,雌性12只)。实验期间动物饲养于西安交通大学医学院动物房,实验方案获西安交通大学实验动物管理委员会批准(2021244),并采取相关措施避免动物在手术中的疼痛。动物房设置的标准是:室内湿度55±5 ℃,温度22±2 ℃以及明暗交替各12 h。饲养笼透明,每笼小鼠不超过5个,小鼠可自由获取食物和水。
1.2.1 研究方法 将AKO组和WT组小鼠组内再随机分为4组,分别是对照组(Con)、二甲双胍组(MET)、阿霉素组(DOX)及二甲双胍联合阿霉素组(MET+DOX),6只/组。二甲双胍干预方法:MET组及MET+DOX组小鼠于实验第1~6天按200 mg/kg每日口服二甲双胍,Con组及DOX组不进行口服药物干预,自由获取水和食物;阿霉素干预方法:DOX组及MET+DOX组于实验第3天按20 mg/kg腹腔注射阿霉素,Con组及MET组腹腔注射等量生理盐水。各组小鼠于实验第6天麻醉后行心脏彩超检查,实验第7天处死小鼠,腹主动脉采血,并按要求留取血清及心脏组织。
1.2.1.1 心脏彩超检测 应用Vevo2100 型心脏超声诊断仪,于小鼠处死前1 d行心脏彩超检查。给小鼠吸入2%异氟烷麻醉,将小鼠固定在加热平台上,用脱毛膏去除胸毛,吸水纸擦去毛发,再用浸水脱脂棉擦干净皮肤,挤压耦合剂覆盖于胸腔部位,于胸骨旁左室长轴切面获得左心室M 型超声心动图,记录左室FS数值。
1.2.1.2 血清及心肌组织的提取 实验第7天处死小鼠,使用预先消毒好的手术器械,予2%异氟烷持续吸入麻醉小鼠,5~7 min即可。使小鼠仰卧位固定于工作台,打开腹腔,暴露腹主动脉,使用消毒好的剪刀镊子分离腹主动脉,腹主动脉取血后血清静置30 min,随后使用离心机离心3000 r/min、15 min,再将血清样本放置于冰箱(-80 ℃)中。随后打开胸腔,分离心脏,迅速将心脏转移到冷却板上的培养皿中,摘取心脏后分离左心室,并用生理盐水冲洗干净,分为两部分,一部分存放于液氮中,随后放置于冰箱(-80 ℃)中。另一部分放入10%的福尔马林溶液固定24 h,常规石蜡包埋,用于形态学等实验。
1.2.1.3 免疫印迹法检测P-AMPK和AMPKα2蛋白表达 采用组织裂解液抽提心肌组织总蛋白后,考马斯蓝染色法检测蛋白浓度;将变性蛋白样品行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后,转至聚偏氟乙烯膜。室温下经5%脱脂奶粉封闭1 h后,在P-AMPK(1∶3000)、AMPKα2(1∶1000)和β-actin(1∶20 000)抗体中室温孵育2 h;洗膜后,再在辣根过氧化酶标记的二抗(1∶2000)室温孵育1 h。经化学发光剂显影曝光后,以β-actin为内参,采用Image J软件分析系统扫描分析小鼠心肌组织中P-AMPK和AMPKα2蛋白表达水平。磷酸化-AMPK、AMPKα2、β-actin单克隆抗体购于CST(货号:2535、2757、93473)。
1.2.1.4 LDH 和心肌肌钙蛋白I(cTnI)的检测 血清LDH水平使用LDH ELISA试剂盒(购于上海碧云天生物技术有限公司进行检测。将存放在冰箱(-80 ℃)中的血清样本取出,首先将小鼠血清样品和LDH标准加入96孔板中,加入LDH测定缓冲液,每孔加48 μL,在每个孔中加入50 μL的混合物(混合物=48 μL LDH测定缓冲液+2 μL血清样品),开始计3 min后,然后用450 nm扫描,读取波长,依照试剂盒要求进行公式计算出LDH水平。血清cTnI水平使用cTnI ELISA试剂盒(购于上海谷研实业有限公司,货号:GOY-2535E)进行检测。将存放在冰箱(-80 ℃)中的血清样本取出,使用96 孔板,分别加入小鼠血清样品200 μL,标准200 μL,将平板放在摇床(150 r/min,25 ℃)上2 h,用弹性保鲜膜覆盖;然后进行第1次冲洗5次,每孔加入100 μL稀释剂,每孔加入100 μL HRP酶结合物。再将平板放在摇床(150 r/min,25 ℃)上1h,用弹性保鲜膜覆盖;进行第2次冲洗5次,向每孔中加入100 μLTMB溶液,用弹性保鲜膜覆盖,放置在摇床(150 r/min,25℃)上20 min,每孔加入100 μL停止液,轻摇混合,当所有溶液由蓝色变成黄色,读出96孔板在450 nm的波长,依照试剂盒要求进行公式计算出cTnI水平。
1.2.1.5 TUNEL法检测心肌细胞凋亡水平 ①固定和透化:15~25 ℃下用固定液将组织切片固定20 min,在PBS溶液中浸泡30 min,将玻片在Triton X-100工作液中在冰上孵育2~5 min,在室温下孵育切片1 h;②制备TUNEL反应混合物:取出100 μL标签溶液(样品瓶2)用于2个阴性对照,将总体积(50 μL)的酶溶液(样品瓶1)添加到剩余的450 μL标记溶液(样品瓶2)=总体积500 μL,搅拌均匀;③具体实验步骤:先小心吸出渗透溶液,用PBS冲组织切片2次,擦去多余的溶液以使切片干燥,在玻片切片上滴入50 μL的Tunel反应混合物,再用封口膜将切片覆盖,将载玻片置于37 ℃的潮湿环境中黑暗孵育1 h,用PBS冲洗玻片3次,擦去多余的溶液以使切片干燥,最后用荧光显微镜/共聚焦分析。
1.2.2 统计学分析 以均数±标准差表示数据整体分布情况,t检验用于两组数据之间的比较,单因素方差分析用于多组之间比较。GraphPad Prism 9.0 以及SPSS 18.0软件用来进行数据分析及作图。P<0.05时认为差异具有统计学意义。
2 结果
2.1 临床研究结果
2.1.1 两组患者基线资料对比 本研究共纳入试验组患者43例,对照组患者80例。两组患者基线资料见表1。由表可见,两组患者各基线资料相比差异无统计学意义(P>0.05)。

表1 两组患者基线资料对比Tab.1 Baseline characteristics of the two groups of patients
2.1.2 两组患者化疗前后各指标变化对比结果 80例对照组和43例试验组化疗前后心肌各指标变化(图1)。两组组内比较,对照组化疗后血CK-MB、LDH及BNP水平显著高于化疗前、EF及FS显著低于化疗前(P<0.05);试验组化疗后血CK-MB、LDH及BNP水平明显低于化疗前(P<0.05),EF及FS较化疗前无明显变化(P>0.05)。两组患者化疗后各指标比较,发现试验组患者化疗后血CK-MB、LDH及BNP水平明显低于对照组,EF值及FS值明显高于对照组(P<0.05)。
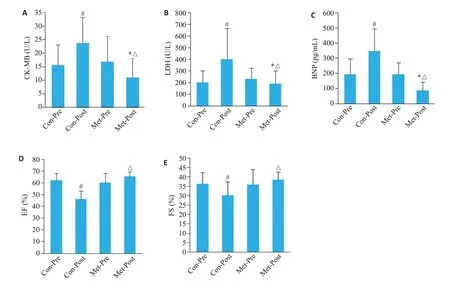
图1 两组患者化疗前后各指标对比图Fig.1 Comparison of the indicators before and after chemotherapy between the two groups (Mean±SD).A:Changes of CK-MB before and after chemotherapy;B: Changes of LDH before and after chemotherapy;C:Changes of BNP before and after chemotherapy;D:Changes of EF before and after chemotherapy;E:Changes of FS before and after chemotherapy.#P<0.05 vs Con-Pre;*P<0.05 vs Met-Pre;△P<0.05 vs Con-Post.
2.2 基础研究结果
2.2.1 心肌AMPK通路抑制效果的验证 AKO组内各组小鼠心肌AMPKα2蛋白表达水平均明显低于WT组;定量分析结果显示,与WT 组相比,AKO 组心肌AMPKα2抑制率为50%,达到了抑制要求,可用于后续实验研究(图2)。
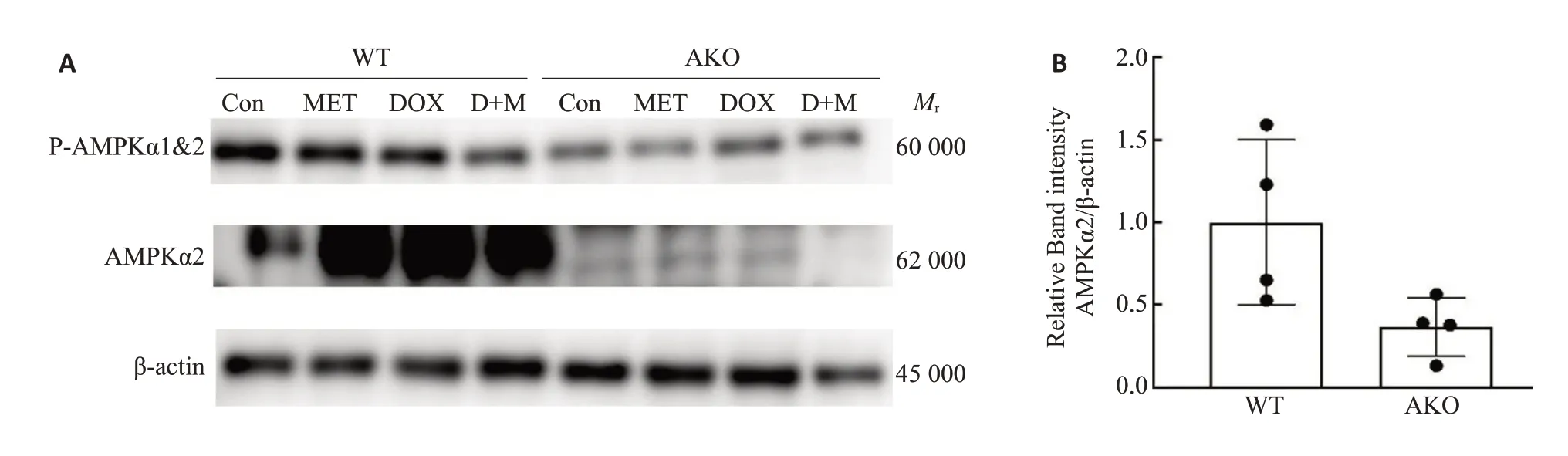
图2 WT小鼠和AKO小鼠AMPKα2表达情况Fig.2 Expression of AMPKα2 in wild-type(WT)mice and AKO mice.A:Western blotting for detecting P-AMPK and AMPKα2 protein expressions.B:Histogram analysis ofAMPKα2 in the two groups of mice.
2.2.2 小鼠心功能检测结果 各组小鼠左心室FS检测结果(图3)。与对照组比较,二甲双胍单药干预对两组小鼠FS均无明显影响(P>0.05);阿霉素单药干预使两组小鼠FS均显著降低(P<0.05),但AKO组降低程度轻于WT组(P<0.05)。二甲双胍与阿霉素共同干预,可使WT组小鼠降低的FS有所恢复(P<0.05),但对AKO组降低的FS无明显改善(P>0.05)。
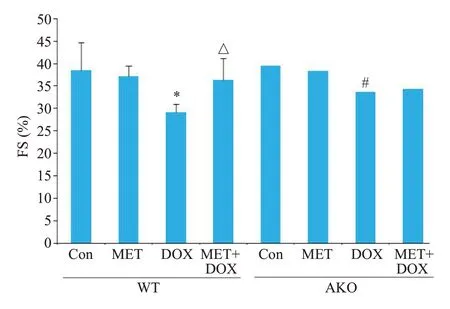
图3 WT组和AKO组小鼠左心室FS检测结果柱状图Fig.3 Histogram of left ventricular FS test of the mice in WT and AKO groups.*P<0.01 vs WT Con;△P<0.05 vs WT DOX;#P<0.05 vs WT DOX.
2.2.3 小鼠血清心肌损伤指标检测结果 各组小鼠血清LDH和cTnI检测结果(图4)。与对照组比较,二甲双胍单药干预对WT组和AKO组小鼠血清LDH和cTnI均无明显影响(P>0.05),阿霉素单药干预可使两组小鼠血清LDH和cTnI均显著升高(P<0.05),但AKO组小鼠血清LDH和cTnI升高程度轻于WT组(P<0.05)。与阿霉素单药干预组比较,二甲双胍与阿霉素共同干预,可使WT组小鼠血清升高的LDH和cTnI有所减轻(P<0.05),但对AKO组升高的LDH和cTnI无明显改善(P>0.05)。
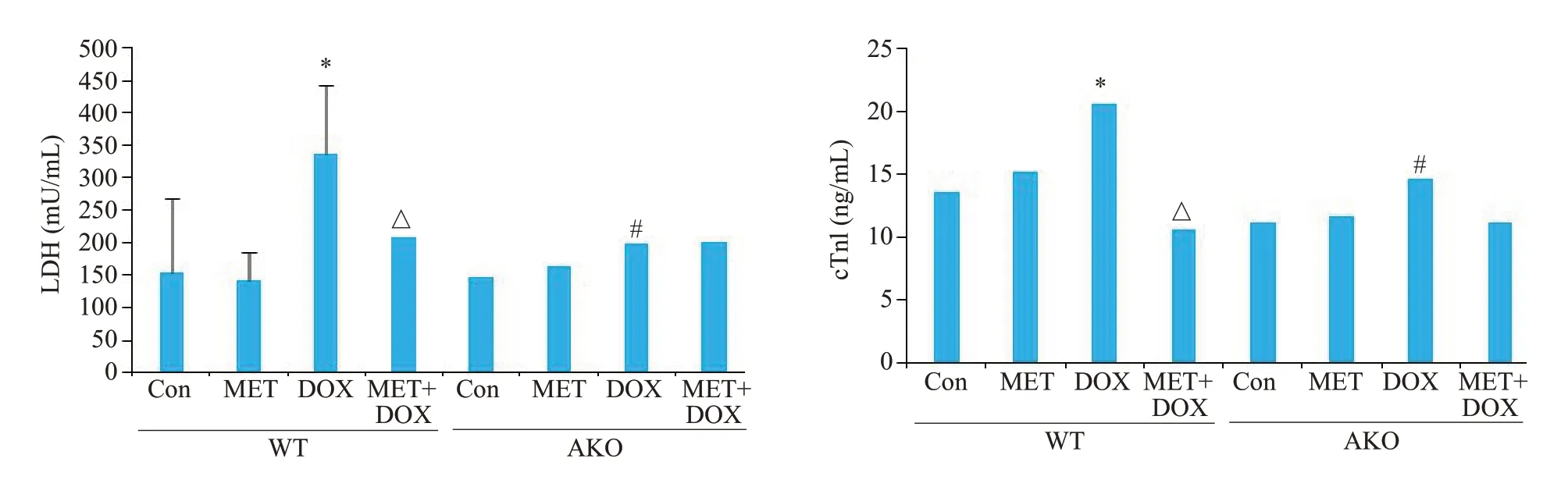
图4 WT组和AKO组血清心肌损伤指标检测结果柱状图Fig.4 Histogram of serum myocardial injury indexes in WT and AKO groups.*P<0.01 vs WT Con;△P<0.05 vs WT DOX;#P<0.05 vs WT DOX.
2.2.4 心肌细胞凋亡水平检测结果 如图5显示,与对照组比较,二甲双胍单药干预对两组小鼠心肌细胞凋亡水平无明显影响(P>0.05),阿霉素单药干预可使两组小鼠心肌细胞凋亡水平显著升高(P<0.01),但AKO组小鼠心肌细胞凋亡水平升高的程度轻于WT组(P<0.05)。与阿霉素单药干预比较,二甲双胍与阿霉素共同干预,可使WT组细胞凋亡水平的升高有所改善(P<0.05),但对AKO组细胞凋亡水平的升高无明显改善(P>0.05)。

图5 WT和AKO各组小鼠心肌细胞凋亡评价Fig.5 Evaluation of myocardial cell apoptosis in WT and AKO groups.TUNEL positive cells are shown by red fluorescence,and all cardiomyocytes are shown by blue fluorescence.A:TUNEL staining in WT group.B: TUNEL staining in AKO group.C: Percentage of apoptotic cardiomyocytes.*P<0.01 vs WT Con;△P<0.05 vs WT DOX;#P<0.05 vs WT DOX(A,B:Original magnification:×400).
3 讨论
本研究临床回顾性分析结果发现,未联用二甲双胍的对照组患者化疗后心肌损伤指标血CK-MB、LDH、BNP水平较化疗前升高,心功能EF和FS水平较化疗前降低,提示阿霉素在临床使用时有致心脏毒性作用。联用二甲双胍的试验组患者化疗后血CK-MB、LDH及BNP水平明显低于化疗前;比较两组患者化疗后上述指标发现,试验组患者化疗后血CK-MB、LDH及BNP水平较对照组降低,EF值及FS值较对照组升高,表明联合应用二甲双胍对阿霉素心脏毒性有一定的防治作用。
为了进一步研究二甲双胍心脏保护的可能机制,我们进行了AMPKα2通路敲除(AKO)的小鼠实验,结果发现阿霉素单药干预可使两组FS均降低,LDH、cTnI及心肌细胞凋亡水平均升高,但AKO组FS降低程度轻于对照组、LDH,cTnI及心肌细胞凋亡水平升高程度轻于对照组;二甲双胍与阿霉素共同干预,可使对照组小鼠降低的FS有所恢复,升高的LDH、cTnI及心肌细胞凋亡水平有所改善,但对AKO组上述指标无明显变化。此结果一方面表明二甲双胍干预后可使阿霉素引起小鼠心脏毒性的心功能得到改善、心肌损伤和心肌细胞凋亡水平减轻,另一方面提示AKO组小鼠使用二甲双胍干预后上述指标无明显改善,即提示二甲双胍可能通过AMPKα2通路抵抗阿霉素的心脏毒性作用。
阿霉素和相关的蒽环类抗生素在癌症治疗中起着核心作用,但其不可忽视的心脏毒性限制了临床使用,会导致患者引起严重的心肌病和充血性心力衰竭等[9,10]。阿霉素诱导心脏毒性的确切机制仍不明确,较为公认的作用机制包括氧化应激、线粒体损伤、DNA损伤、钙超载、细胞自噬和凋亡等[11-13]。二甲双胍是治疗2型糖尿病的一线口服降糖药,流行病学与临床观察显示二甲双胍还可以降低多种肿瘤的发病率,其作为一种潜在辅助抗癌药物引起了广泛关注[14]。同样,二甲双胍对阿霉素诱导的心脏毒性也起到保护作用,2018年上海瑞金医院进行了一项单中心、前瞻性、Ⅱ期临床试验,研究对象为经利妥昔单抗加环磷酰胺、阿霉素、长春新碱和泼尼松一线治疗后完全缓解的弥漫性大B细胞淋巴瘤和3B级滤泡性淋巴瘤患者,观察联合使用二甲双胍后对患者生存期影响[15]。结果提示接受二甲双胍维持治疗的患者总体生存率明显高于未接受二甲双胍维持治疗的患者,血清LDH水平降低,患者均受益于二甲双胍维持治疗。
维持能量平衡对于细胞和机体的生理稳态是至关重要的,研究表明二甲双胍的心肌保护作用可能与影响细胞能量代谢有关[16],因此我们了选取与能量代谢关系密切的AMPK通路进行机制探索。AMPK是机体能量代谢中的一种关键酶,其在大脑、肝脏、脂肪细胞和骨骼肌等代谢器官中均有表达,被称为人体的“能量代谢的主调节器”。AMPK是一个由αβγ亚基构成的异源三聚酶复合物[17]。其中,AMPKα2的表达在骨骼肌细胞和心肌细胞中明显占主导地位,而AMPKα1在许多分泌细胞中占主导地位,如乳腺组织、朗格汉斯细胞[18]等分布较多,且α2亚单位含量明显高于α1亚单位[19]。因此,本实验主要检测了AMPKα2蛋白用于后续实验研究。褪黑激素可通过激活AMPK通路来抑制阿霉素引起的线粒体功能障碍和形态障碍、细胞凋亡和氧化应激,这与我们的结论相符[20]。二甲双胍可能通过激活AMPK通路调节自噬/线粒体自噬的机制来减少阿霉素诱导的心肌细胞死亡[21]。因此,药理学上激活AMPK通路可以同时降低阿霉素诱导的心脏毒性并增强其抗肿瘤活性。
综上所述,本研究的主要发现是阿霉素在临床使用时导致了患者不同程度的心脏毒性;阿霉素联合二甲双胍后在一定程度减轻了此心脏毒性,并初步揭示了AMPKα2可能作为减轻阿霉素细胞毒性的新靶点。因此,我们的结果为阿霉素诱导的心脏毒性及其干预方法提供了新的认识。然而,本研究仍具有很多局限性,如临床研究部分由于纳入研究的患者人数较少,我们无法对这些因素进行分层,因此有必要对更多的患者进行未来的临床研究。此外,基础研究部分有待更深入的探索,如我们将验证能量代谢因素是否是阿霉素引起的心脏毒性的原因及确定与阿霉素联用时二甲双胍的心脏保护作用的具体机制及信号通路,以及是否存在AMPK之外的保护机制等。