转录组测序鉴定兔移植静脉桥血管再狭窄相关基因
周海深,杨利博,谢 诗,杨家明,张家庆
南方医科大学珠江医院胸外科,广东 广州510280
冠心病是导致人类死亡的首要病因[1],我国患者冠心病的发病率也越来越高[2,3]。20%~50%的大隐静脉(SV)桥血管在术后30 d~2年内出现狭窄或完全堵塞,晚期,约有40%的SV 桥会在10 年时完全堵塞,剩余未完全堵塞的血管尚有30%出现了不同程度的狭窄,供血受影响[4,5]。冠状动脉旁路移植手术的静脉桥血管再狭窄机制涉及众多的因素[1,6,7]。移植静脉血管平滑肌细胞(VSMC)的增殖是再狭窄发生的病理改变之一[7]。但是冠状动脉旁路移植手术(CABG)后的桥血管无论通畅情况如何,均不会再取出。只有在患者死亡后器官捐献或心脏疾病进入终末期,行心脏移植手术后才能获得静脉桥血管的标本。由于时效性的因素,尸检标本的核酸降解严重,难以进行基因检测。所以关于静脉桥血管基因方面的研究较少,较多的研究集中于终末期的心脏疾病[8,9]或心肌病方面的研究[10]。建立模拟冠脉旁路移植桥血管的动物模型是探索静脉桥血管增殖基因的途径之一[11-13]。庄建、张晓慎[12]教授使用猪的乳内静脉作为搭桥血管移植至冠脉上,构建了冠脉旁路移植手术模型,观察到了静脉桥血管的增殖。蓝斌教授[14]将兔的劲动脉吻合至颈静脉上,然后结扎双侧颈静脉,发现静脉血管有增殖改变。但上述动物模型的研究中未进一步进行基因水平的研究。
本团队前期构建了兔的腹主动脉置换手术的动脉模型[15,16],证明了:利用兔的腹主动脉置换可以模拟冠脉旁路移植手术桥血管的血流动力学改变,血流量与冠脉旁路移植手术后桥血管的血流量相当,研究的关注点是等离子体磺酸化丝素蛋白膜复合小口径血管的通畅率,没有进行小口径自体血管再狭窄方面的基因研究。另外本团队在研究中发现[15,16]:模型构建中腹腔操作部分损伤较大,容易出现术后兔死亡。本研究将兔的左侧颈外静脉移植至左颈动脉上,构建了冠脉旁路移植手术桥血管的动物模型,成功模拟出桥血管增殖的病理改变。由于增殖的静脉桥血管难以获得,动物模型构建的技术难度较高,目前关于冠状动脉旁路移植手术静脉桥血管再狭窄相关基因的研究较少[17],模型常选择鼠,但血流参数与人CABG差别较大。本团队[15,16]前期的研究中使用兔作为实验动物构建了小口径血管的实验模型,发现:兔的腹主动脉或颈动脉直径与人冠状动脉直径相当,血流量,波动指数相近,使用兔实验模型进行的研究有更大的可能在人类中重复。为了明确本动物模型能否在病理层面模拟SV桥血管再狭窄的改变,本团队利用连续缝合的方法将兔颈外静脉移植至颈动脉上,模拟出了静脉桥血管的增殖改变,如血管平滑肌细胞增生,类型由收缩型转变为合成型,细胞外基质分泌增加。筛查出引起静脉桥血管再狭窄的相关基因,为进一步研究静脉桥血管增殖提供研究方向。
1 材料和方法
1.1 兔颈外静脉-颈动脉血管移植模型构建
选取40只清洁SPF级实验用新西兰兔,采购于南方医科大学动物实验中心,体质量为2.0~2.5 kg,雌性。实验方案通过南方医科大学珠江医院动物实验研究委员会审批(LAEC-2021-165)。随机数法将40只实验用新西兰兔分为实验组(A组)、对照组(B组),A、B两组再分别分为2周组和4周组,每组各10只。使用3%戊巴比妥钠(上海新亚药业有限公司)经耳缘静脉注射麻醉,剂量为30 mg/kg,颈部皮肤剃毛,消毒,于左侧颈部气管旁切开皮肤约5 cm,显露左侧颈外静脉,长度约4 cm,结扎分支,千分尺测量血管直径。剪取颈外静脉血管约3 cm,置于盐酸罂粟碱溶液(山东北大高科华泰制药有限公司)中备用。分离左侧颈总动脉,长度约3 cm,中部横断,取出备好的颈外静脉血管,使用6-0不可吸收尼龙缝合线进行连续端端缝合。吻合完毕后使用千分尺测量移植血管外径,测量3次取平均值。最后间断缝合兔颈部肌肉及皮肤。术后予青霉素注射液(30 U/kg)(太极西南药业股份有限公司)肌肉注射预防感染。
实验组(A组)及对照组(B组)于术后第2周、第4周取出静脉桥血管,使用HE 的组织病理学染色方法,低倍显微镜下观察静脉桥血管组织切片,测量内膜及中膜厚度。
1.2 组织标本RNA-seq分析
取术后4周兔静脉桥血管标本及对照组血管标本各10只,进行RNA-seq分析(广州基迪奥生物科技有限公司),从而获取实验组与对照组之间的差异基因,再对差异基因进行富集分析。根据各个样本表达量的水平,使用PCA分析,评估样本间重复情况并对差异较大样本进行排除。差异表达分析的结果是基因表达水平检测中得到的reads count值,使用DESeq2软件分析。之后进行互作网络分析:应用STRING蛋白质相互作用网络数据库(http://string-db.org)对差异基因蛋白进行相互作用网络的构建。选定物种为兔,再导入分析后的差异基因,最后使用cytoscape构建互作关系网络图。
1.3 统计分析
实验过程中产生的数据使用SPSS 26.0软件进行分析。其中计量资料以均数±标准差的形式来表示。各个标本组间比较应用独立样本t检验进行分析,配对样本使用配对t检验,多组间数据比较应用方差分析处理结果。以P<0.05为差异具有统计学意义。
2 结果
2.1 动物实验结果
动物实验模型建立情况:对40只实验用新西兰兔进行颈外静脉-颈动脉血管搭桥手术,模型建立成功28只,12只失败。其中3只实验兔术后10 d内死亡,进行尸体解剖后考虑感染。8只术后取材时发现桥血管阻塞不通。1只行超声检查操作后死亡,考虑实验兔受到惊吓所致。其余实验兔模型均建立成功,至取材前术区无明显感染迹象,取材时血管通畅。后续补充实验新西兰兔12只,再次建立颈外静脉-颈动脉血管搭桥模型,并定期予以抗生素抗感染,模型建立成功(图1)。

图1 血管搭桥动物模型Fig.1 Animal model of vessel bypass.A:Left carotid artery of a rabbit.B:Left external jugular vein of a rabbit.C:External jugular vein-carotid anastomosis.
2.2 实验兔移植颈外静脉术前术后直径对比
手术前后测定颈外静脉血管直径变化,术前兔颈外静脉直径4.29±0.58 mm,术后即时测量的血管直径增大至5.32±0.65 mm,直径增加长度为1.04 mm,程度增加约24.2%。两组数据对比,差异具有统计学意义(P<0.05)。
2.3 组织学观察结果
对照组颈外静脉血管管壁较薄,内膜完整、管腔通畅,未见增厚。术后2周组,可见移植后桥静脉血管内膜增生明显,内皮细胞损伤修复、排列紊乱、部分平滑肌细胞;中膜可见大量平滑肌细胞增殖。术后4周组可见血管壁不均匀增厚,内膜损伤及修复明显,中膜明显增厚,平滑肌细胞迁移至内膜层。术后2周静脉桥血管明显增厚,术后4周静脉桥血管增厚更加明显(图2)。各组数据差异具有统计学意义(表1,P<0.05)。
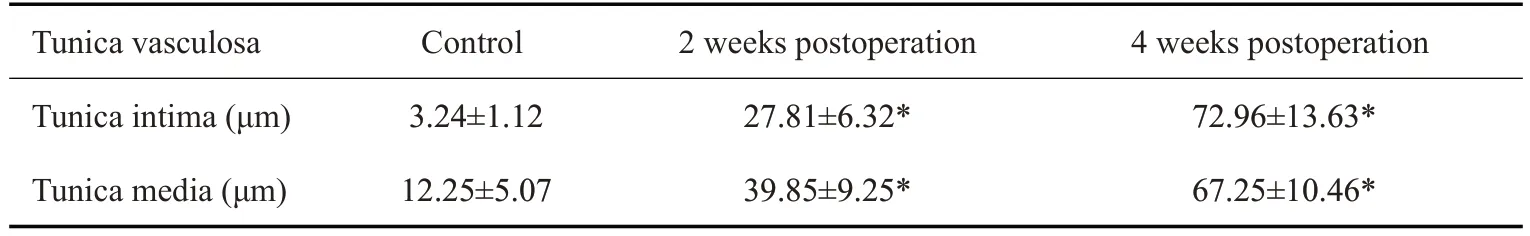
表1 正常静脉及术后桥血管管壁厚度Tab.1 Vascular wall thickness in normal jugular vein and venous grafts(Mean±SD)
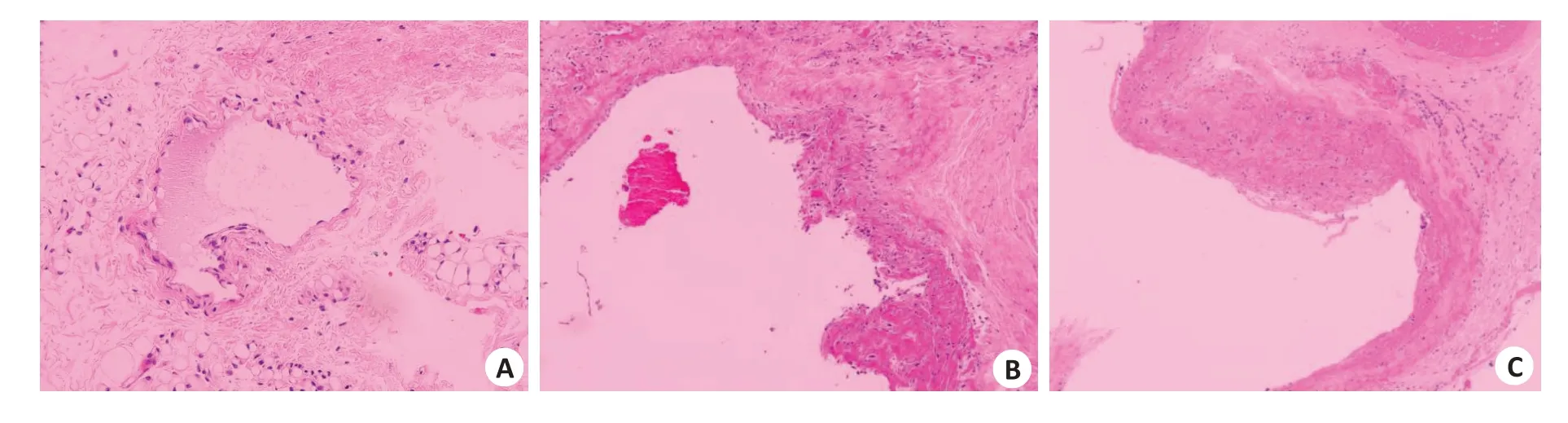
图2 静脉血管内膜Fig.2 Intima-media thickness of the engrafted vein(Original magnification:×100).A:Control group.B,C:Engrafted vein at 2 and 4 weeks after the operation,respectively.
2.4 转录组测序(RNA-seq)结果
2.4.1 组间差异基因整体统计结果 将对照组与实验组基因测序结果进行差异对比分析,以丰度超过2倍为准,共2191个,其中上调基因共1583个,下调基因608个。
2.4.2 差异比较火山图 根据各比较组的显著差异基因,我们进行火山图分析。越靠近两端的基因,差异程度越大(图3)。横坐标表示两个分组间的差异倍数对数值,纵坐标表示两个分组差异的FDR的负Log10值,红色(表达量上调)和蓝色(表达量下调)的点表示基因的表达量有差异,黑色表示没有差异。
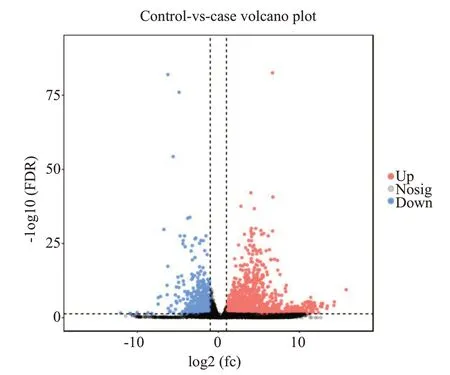
图3 差异比较火山图Fig.3 Volcano map of the differentially expressed genes between the two groups.
2.4.3 相互作用网络分析 根据显著性P值对富集后差异基因进行排序,选出实验组与对照组差基因差异最大的前500个基因通过String基因库进行相互作用网络分析,由于基因总数过多,故在String系统中设置可信度为高(High confidence 0.700),得到相互作用网络分析图如下,其中处于中心位置且与其他基因间相互作用较广泛的前20 个基因分别为:CD4、CD2、TLR2、CTSS、
PTPRC、IL2RG、SKY、LAT、ITK、PK3CD、BTK、CD28、ZAP70、CD19、MYH3、MYL2、ACTC1、PTPN8、PTPN22、CD86(图4)。然后进一步提高置信度为最高(Highest confidence 0.900),进一步筛选出仍处于中心位置的10 个Hub 基因,为CD4、ZAP70、SYK、CD28、PIK3CD、CXCR4、CCR5、ITK、CCL5、BTK(图5)。
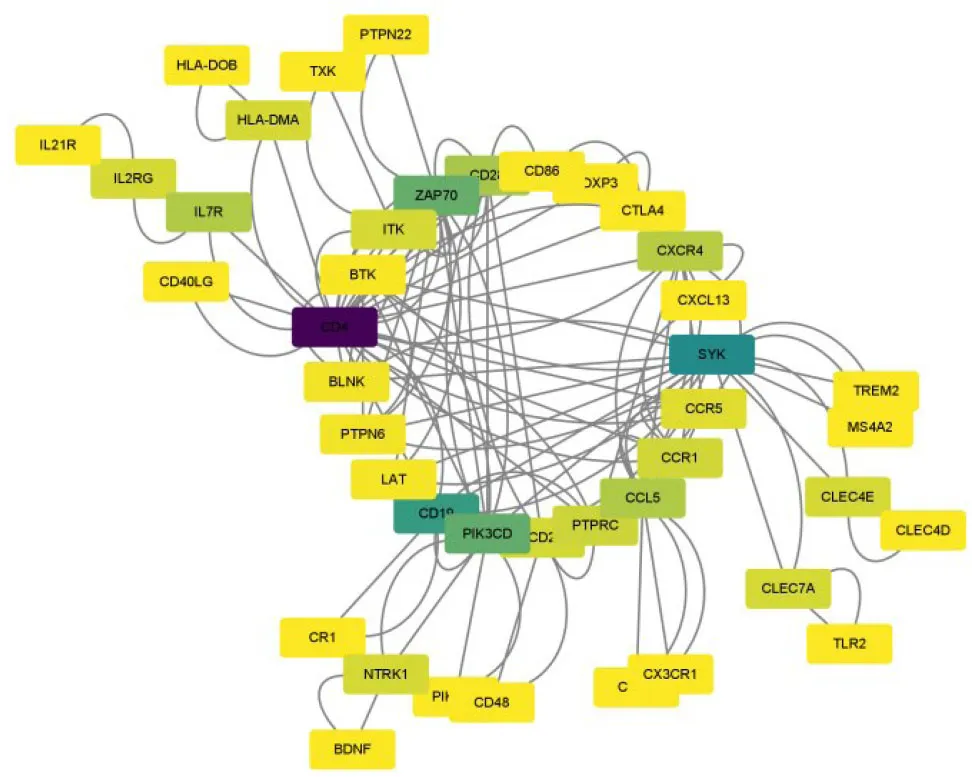
图4 互作网络分析图Fig.4 Interaction network analysis diagram.

图5 互作网络分析图(前10基因)Fig.5 Interaction network analysis of the top 10 genes.
3 讨论
目前自体静脉移植动物模型中,最常用的动物为小鼠、大鼠及兔[11,14,15,18]等,大型实验动物价格昂贵,饲养及手术所需条件高。常选择小鼠、大鼠和兔作为实验建模对象,且这几种动物的基因组与人类均有较高的同源性,兔体型相对较大,在静脉移植手术过程中血管吻合难度稍低,故本实验动物模型选用兔。我们将兔颈外静脉移植至同侧颈总动脉,吻合方式选择端端吻合。本团队前期研究证明了[15,16]:兔腹主动脉的血流量和直径和冠脉旁路移植手术的桥血管的流量相当,但模型构建的成功率低,故将动物模型进一步改进,将兔的颈外静脉移植至颈动脉上。在血管移植手术前后我们对移植静脉血管直径进行测量,发现移植后静脉血管在动脉血压下作用下,直径拉伸延长20%~30%。在模型中发现:血管平滑肌细胞可由本身较稳定的收缩型,转变为合成型,而合成型平滑肌细胞的增殖迁移能力较强,同时分泌细胞外基质,造成血管内膜增厚。术后2周及4周时,我们分别取出移植静脉桥血管,HE染色后进行病理学观察,发现术后2周时实验兔移植颈外静脉血管内膜发生增厚,术后第4周取材后观察,可见移植静脉桥血管内膜明显较对照组增厚,表明在术后2~4周,移植静脉桥血管内膜平滑肌细胞逐步增殖,引起血管内膜增厚。
移植静脉血管发生狭窄的机制复杂[19],但疾病的发生和发展,均与遗传物质的表达相关,本研究通过GO及KEEG对实验结果进行富集分析,进一步获取疾病相关基因的具体信息及相关通路等[9,20,21]。我们对实验兔术后28 d的移植静脉桥血管与对照组正常颈外静脉血管进行高通量测序分析,并对获取的遗传物质数据进行筛选排除,发现两组间具有差异的基因共计2191个,其中上调基因1583个,下调基因608个。其中可能存在众多基因的表达与移植静脉桥血管内膜的增生有关。我们经过GO及KEEG对所有差异基因进行富集分析,最终发现富集前20的term中存在部分已知与血管内膜增殖有明确关系,如趋化因子信号通路、细胞黏附分子相关通路、血小板激活、钙离子结合、GTPpase调节活性等。
我们将筛选出的前20个核心基因再进行高置信度筛选,寻找出仍处于核心位置的10个基因。这些基因有较大的可能是引起桥血管再狭窄的核心基因。对筛选的基因进一步分析,我们发现:其中的2个基因,脾相关酪氨酸激酶(SYK)和ZAP70(Zeta链的T细胞受体相关蛋白激酶70)两个基因处于核心位置的前列。SYK基因可介导多种跨膜受体信号转导,比如B细胞受体,并且可对破骨细胞的成熟、细胞黏附、血小板的激活以及血管发育等生物学过程进行调节[22,23]。它还可参与有纤维蛋白原介导激活的血小板黏附过程等[24]。在静脉桥血管内膜增生的进程中,SYK可能通过炎症、细胞黏附、血小板聚集等影响桥血管再狭窄这一病理过程。ZAP70 作为SYK 基因的重要旁系基因[25,26],经过GeneCards进行检索后发现,该基因的主要功能是调节成熟后T细胞的运动和黏附[27,28]、细胞因子的表达以及胸腺细胞的发育,另外对初级B细胞的发育和激活有一定促进作用[29,30]。炎症反应开始于静脉桥血管移植后,ZAP70可能通过激活或促进炎症细胞的粘附,促进静脉移植血管内膜增殖。
将兔颈外静脉血管移植至颈动脉上,静脉血管直径增宽约20%,移植后血管平滑肌细胞增殖,血管内膜及中膜增后,可模拟冠脉旁路移植手术后静脉桥血管再狭窄的病理改变。进一步基因筛查发现:CD4、ZAP70、SYK、CD28、PIK3CD、CXCR4、CCR5、ITK、CCL5、BTK可能是引起桥血管增殖的相关基因。
本实验结果可能为CABG术后静脉桥血管再狭窄的治疗提供更广泛的视角及实验基础,但由于实验样本量等客观因素限制,仍需进一步的深入研究来证实。
致谢:感谢广州基迪奥生物科技有限公司在兔静脉桥血管检测中提供的帮助,感谢南方医科大学珠江医院心血管外科的张雪花医生、吴阳医生在兔颈部血管彩超检查中给予的无私帮助。