高同型半胱氨酸通过Notch11/Hes1信号通路促进HT22细胞自噬和凋亡
张竞文,何 静,米晓娟,许贤瑞,田 英,燕 茹
宁夏医科大学1基础医学院//国家卫生健康委员会代谢性心血管疾病研究重点实验室,2总医院,宁夏 银川750004
高同型半胱氨酸血症(HHcy)是人类最常见的代谢异常之一[1-3],损害老年人、携带者和神经退行性疾病患者的认知和神经功能[1,4,5],是痴呆的一个独立危险因素[4,6,7]。除此之外,HHcy也与高血压、糖尿病等心血管和代谢性疾病有关[1,4,6],HHcy也是2型糖尿病患者发生微血管病变的独立危险因素[6,8]。了解HHcy所致损伤及其分子机制,将有助于HHcy所致疾病的预防和治疗[6,8]。
HHcy导致认知功能和神经功能损伤的机制尚不清楚[9,10]。研究提示[10-12],HHcy具有兴奋性神经毒性作用,通过激活NMDA 受体或减少突触前膜对谷氨酸再摄取,引发谷氨酸的兴奋性毒性,导致脑损害的发生[13,14]。HHcy导致DNA甲基化异常[15,16],诱导细胞凋亡[17,18]。Hes(hes)基因家族包括Hes1~Hes7七个同源基因,可分为激活型、抑制型两大类[19]。Hes1、Hes5属于抑制型基因,具有特征性的碱性螺旋-环-螺旋[20],Notch 信号通路调节Hes1、Hes5 的表达[20,21]。Hes1、Hes3和Hes5调节神经干细胞的增殖和分化[19,21]。前期动物实验研究可见,HHcy可降低嗅球和大脑神经元HES1 和HES5 的 表达[18,22]。但是,HHcy 是否通 过Notch1/Hes1信号通路参与自噬和凋亡调节尚不清楚。
根据microRNA基因芯片测序分析可见,Notch信号通路为差异miRNA富集的候选通路之一,同型半胱氨酸可作用于细胞凋亡、自噬、生长等[5,11,13]。本研究将以HT22小鼠海马神经元细胞系作为研究对象,采用同型半胱氨酸进行共培养,制备高同型半胱氨酸血症体外模型。通过细胞学、电子显微镜、流式细胞术、Western blot、Real-time PCR等技术,检测Hes1、Hes5、Jagged1、Notch1、Bcl-2、Bax、P62、LC3I、LC3II 的表达,探讨HHcy对神经细胞自噬和凋亡的影响及其Notch1/Hes1信号通路的作用。
1 材料和方法
1.1 材料
全蛋白提取试剂盒、SDS-PAGE 凝胶试剂盒、BCA试剂盒、5×电泳上样缓冲液、蛋白marker 等(凯基生物)。兔抗Hes1、兔抗Hes5、兔抗Jagged1、兔抗Notch1、兔抗bax、兔抗bcl2(Abcam),多克隆抗P62(Cell signal)、Beclin-1(Proteintech)、LC3(Proteintech),βactin、CCK8等(康为世纪生物)。HT22细胞(Procell)由宁夏颅脑疾病重点实验室-国家重点实验室培育基地馈赠。同型半胱氨酸(Hcy)、叶酸(Folic acid)、维生素B12(Sigma)等(国药集团)。
应用Primer8.3 软件设计针对Hes1等mRNA的引物探针。Primer3 网址:http://www.genome.wi.mit.edu/cgi-bin/primer/Primer3,BLAST 网址:http://www.ncbi.nlm.gov/cgi-bin/BLAST。引物顺序为(5'-3',3'-5')。GAPDH:CCTCGTCCCGTAGACAAAATG,TGAGG TCAATGAAGGGGTCGT;Hes1: CACGACACCGG ACAAACCA,GAGGTGCTTCACAGTCATTTCCA;Hes5: TACCTGAAACACAGCAAAGCCT,GGCCGC TGGAAGTGGTAAA;Notch1: CTTCGTGCTCCTG TTCTTTGTG,TCTTCGTCTCCCCACTCGTTCT;Jagged1: TCTACATAGCCTGTGAGCCTTCC,TCAC CAAGCAACAGACCCAAG;P62: GACAAGAGTAA CACTCAGCCAAGCA,TCCATCTGTTCCTCTGGC TGTC;LC3: ATCATCGAGCGCTACAAGGG,AGCC GAAGGTTTCTTGGGAG;beclin 1: GAGATTGGAC CAGGAGGAAGCT,GTGCCAAACTGTCCGCTGT G;Bcl2:TGACTTCTCTCGTCGCTACCGT,CCTGA AGAGTTCCTCCACCACC;Bax: GCCTTTTTGCTA CAGGGTTTCAT,TATTGCTGTCCAGTTCATCTCC A;β-actin:GCTGTCCCTDTATGCCTCTG,TTTGATG TCACGCACGATTT。引物由上海生工生物公司提供。
1.2 方法
1.2.1 细胞培养 细胞复苏后,接种于培养瓶内贴壁生长,置于37 ℃,5%CO2培养箱常规培养,培养液隔24 h更换。长至70%~80%时,制备细胞悬液传代培养。选择3~4代的细胞用于后续实验。采用CCK8试剂盒,检测细胞活力。
1.2.2 Hcy作用浓度筛选 Hcy浓度设定为0、20、50、100、200、500 μmol/L。根据CCK8检测结果,Hcy 100 μmol/L为最适浓度,培养48 h为最适时间。依此,本实验分组为:空白对照组(简称0组),高同型半胱氨酸组(简称100组),Hcy 100 μmol/L;高同型半胱氨酸维生素B干预组(简称100+fv组),Hcy 100 μmol/L+叶酸+维生素B12;空白对照+叶酸+维生素B12组(简称0+fv组)。
1.2.3 筛选Hes1 siRNA 将Hes1 siRNA干扰序列转染HT22细胞,培养48 h后,western blot检测Hes1蛋白表达,qPCR 检测Hes1 mRNA 水平。所用3 条片段:si-Hes1-373、si-Hes1-1227、si-Hes1-1292。根据Western blot、qPCR检测的结果,筛选出最优的Hes1 siRNA片段为si-Hes1-1292。其序列为:sense GAAUUUGGG AGCUGUUUAUTG,antisense AUAAACAGCUCCC AAAUUCTG。
1.2.4 Hes1重组质粒构建 以小鼠cDNA为模板,PCR扩增Hesl 基因,上下游引物分别为5'-GCCGATAT CGCCACCATGCCAGCTGATATAATGGA-3'和5'-TA ACTCGAGGC TCTCAGTTCCGCCACGGTCT-3',目的片段约861 bp。将穿梭载体pAd-Track用EcoR V和XhoI双酶切后获得的骨架片段与Hes1基因片段连接,经测序验证,获得携带Hes1 的质粒。限制性内切酶EcoR I和XhoI双酶切,酶切片段为3720 bp和6182 bp,5%琼脂糖凝胶电泳鉴定。
1.2.5 Real-time PCR 采用Trizol 试剂盒提取总RNA,逆转录cDNA 合成,逆转录的反应体系总体积25 μL,42 ℃1 h,70 ℃5 min,已合成的cDNA放入-20 ℃冰箱保存。检测PCR 扩增产物;PCR 反应液置于FTC-3000 实时定量荧光Real-time PCR 仪上进行PCR 扩增反应。
计算机系统自动记录荧光信号,用ΔΔCt法统计:
A=ΔCt=Ct(待测样本目的基因)-Ct(待测样本内参基因);B=Ct(对照样本目的基因)-Ct(对照样本内标基因);K=ΔΔCt=A-B;表达倍数变化=2-K
1.2.6 Hes1 siRNA 转染细胞 转染细胞按说明书操作。取对数增殖期的细胞,按照每孔8×105/孔平铺在6孔板,稳定培养24 h;Lipofectamine 2000 分别与对应siRNA 预混配置成工作液,100 nmol/L,室温孵育25 min;待细胞生长融合度约50%时,更换siRNA预混工作液,继续37 ℃孵育1 d后更换含血清培养液,继续培养1~2 d;收集细胞,Western blot检测各组Hes1蛋白表达,筛选出最优的Hes1干扰片段。
1.2.7 统计分析 采用SPSS 20.0 软件分析。Student's检验和SNK检验,进行不同分组之间的两两比较,以P<0.05时认为差异具有统计学意义。
2 结果
2.1 细胞生长情况
培养48 h可见,各组细胞生长状况接近,细胞比较丰富(图1)。空白对照组(0组)胞体丰满、不规则形,片状生长,细胞可见突起(图1A)。高同型半胱氨酸组(100组)中死亡细胞明显增加(图1B),高同型半胱氨酸维生素B干预组(100+fv组,图1C)和维生素B组(0+fv组)可见少量死亡细胞(图1D)。
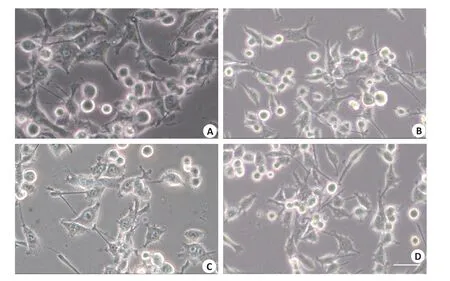
图1 HT22细胞生长情况Fig.1 Growth of HT22 cells in different groups.A:Scattered dead cells in blank control group.B:Increased dead cells in 100 μmol/L Hcy-treated cells.C:Scattered dead cells in 100+fv group.D:Scattered dead cells in 0+fv group.Scale bar=50 μm.
2.2 细胞凋亡
培养48 h后,Annexin V-FITC/PI流式细胞检测结果可见(图2),分别与0组(图2A)、100+fv组(图2C)和0+fv组(图2D)比较,高同型半胱氨酸组(图2B)凋亡细胞的比例均明显升高(图2E);与高同型半胱氨酸组比较,100+fv组和0+fv组凋亡细胞比例明显降低(图2E)。

图2 HT22细胞凋亡检测结果Fig.2 Flow cytometry for detecting cell apoptosis in different groups.A: 0 group,B: 100 group.C:100+fv group.D: 0+fv group.E: Histogram of apoptotic proportion,*P<0.05 vs 0 group;#P<0.05 vs 100 group,n=3.
2.3 超微结构变化
透射电子显微镜观察可见,培养48 h,对照组细胞结构完整,线粒体、内质网等细胞器形态正常(图3A);在Hcy 100 μmol/L 组,细胞结构基本完整,细胞质明显水肿淡染,线粒体肿胀、空泡化,可见多个自噬体(图3B);在100+fv组,也可见线粒体肿胀、空泡化、自噬体,但程度轻于Hcy 100 μmol/L组(图3C);在100+fv组,偶见自噬体(图3D)。

图3 HT22细胞超微结构Fig.3 Ultrastructure of HT22 cells in different groups.A:Normal mitochondria(M)in 0 group.B:Mitochondrial swelling,vacuolation(V),and increased autophagosome(AS)in 100 group.C:Autophagosomes(AS)in 100+fv group.D:Autophagosomes(AS)in 0+fv group.Scale bar=1 μm.
2.4 Western blot结果
Western blot结果显示(图4),在Hcy 100 μmol/L组,Bax表达增加,Bcl-2表达降低,Bax/Bcl-2比值明显高于0组和100+fv组(P<0.05);P62相对值在Hcy 100 μmol/L组明显低于对照组(图4,P<0.05),LC3II/LC3I比值在Hcy 100 μmol/L 组高于0 组和100+fv 组(P<0.05);Beclin1在Hcy 100 μmol/L组未见明显变化(图4)。

图4 凋亡和自噬相关蛋白Western blot结果Fig.4 Western blotting of the proteins related with apoptosis and autophagy in different groups.A:Western blots of the proteins.B:Bar graph of Bax/Bcl-2 and LC3II/LC3I ratios.C:Bar graph of relative values of P62 and Beclin1.*P<0.05 vs 0 group;#P<0.05 vs 100 group;n=3.
HES1、HES5、Notch1 和Jagged1 蛋 白Western blot 结果可见(图5),在Hcy100 μmol/L 组,HES1、HES5、Notch1和Jagged1蛋白表达比值明显低于对照组(P<0.05),100+fv 组明显高于Hcy 100 μmol/L 组(图5,P<0.05)。
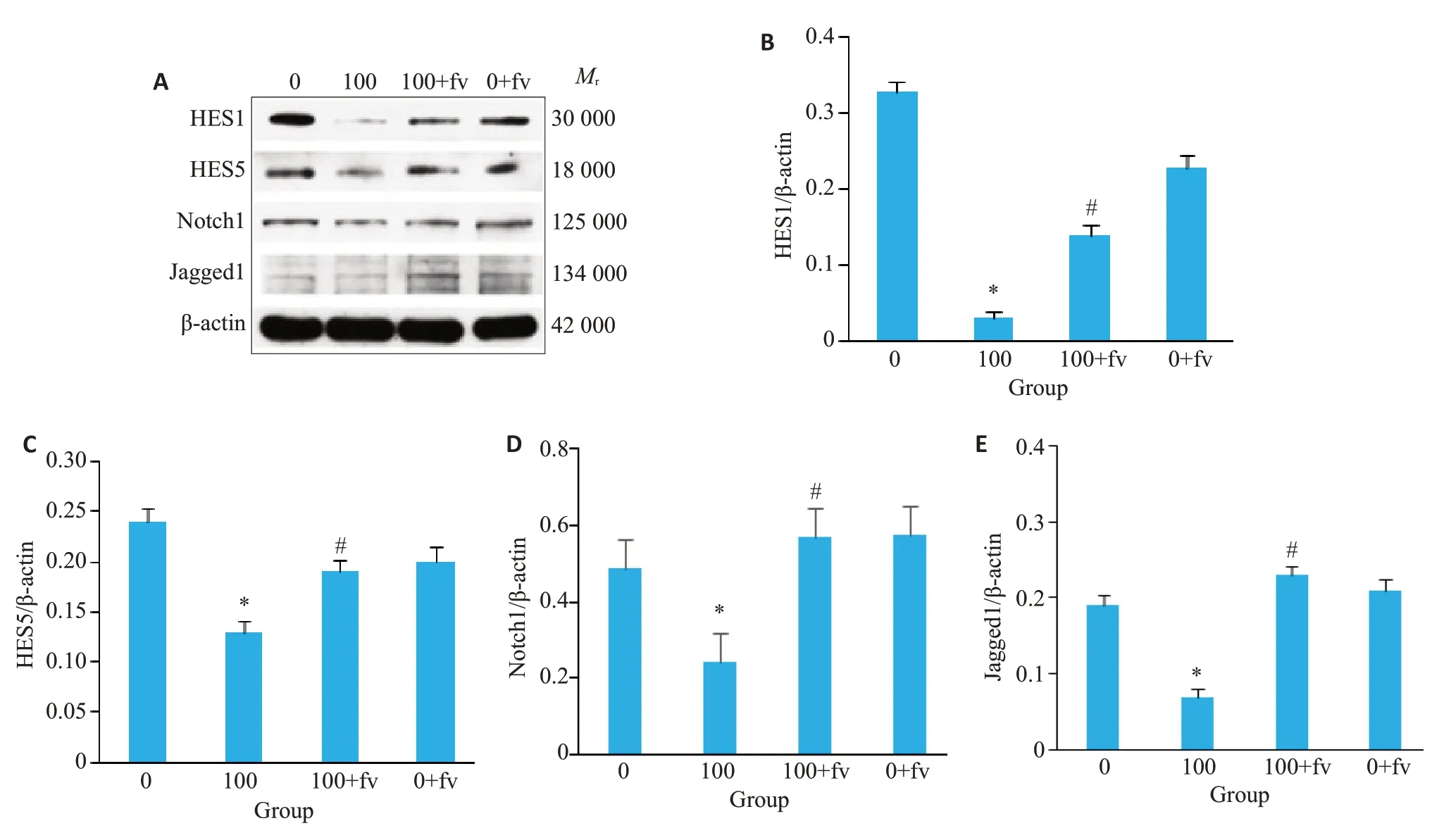
图5 HES1、HES5、Notch1和Jagged1 western blot结果Fig.5 Western blotting of HES1,HES5,Notch1 and Jagged1 proteins in different groups.A:Western blots of the proteins.BE: Histograms of relative expressions of HES1,HES5,Notch1 and Jagged1,respectively.*P<0.05 vs 0 group;#P<0.05 vs 100 group;n=3.
2.5 Real-time PCR 检测结果
从P62、LC3、Beclin1的mRNA扩增结果可见(图6),Hcy 100 μmol/L 组LC3、Beclin1 的mRNA 明显高于0组和0+fv组,P62明显低于100+fv组(P<0.05),LC3和Beclin1的mRNA在高同型半胱氨酸组与100+fv组之间无显著性差异(图6D)。
HT22细胞Real-time PCR 检测结果显示,在培养48 h,高同型半胱氨酸组Hes1和Hes5 mRNA明显减少(图7),与0组、100+fv组和0+fv组比较,差异均有显著性意义(图7E,P<0.05);高同型半胱氨酸组Jagged1无明显变化,100+fv组Hes1 mRNA明显高于高同型半胱氨酸组(图7E,P<0.05)。
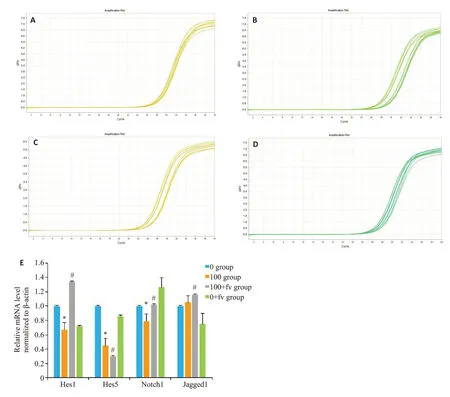
图7 Hes1、Hes5、Notch1和及Jagged1 Real-time PCR检测结果Fig.7 Real-time PCR of Hes1,Hes5,Notch1 and Jagged1 in different groups.A: Hes1 mRNA amplification curve;B: Hes5 mRNA amplification curve;C: Notch1 mRNA amplification curve;D:Jagged1 amplification curve;E: Histogram of mRNA amplification;*P<0.05 vs 0 group;#P<0.05 vs 100 group.
2.6 Hcy对过表达和干扰Hes1后的影响
Western blot 检测可见,加入Hes1 干扰和过表达后,目标蛋白均有一定的变化(图8A)。Hcy组、Hes1 siRNA组和Hcy+Hes1siRNA组Hes1表达量明显低于对照组,且Hcy+Hes1siRNA 组又明显低于Hcy 组和Hes1 siRNA组(图8B);而Notch1表达量无显著性差异;Jagged1表达量在Hcy组和Hcy+Hes1siRNA组明显降低,而Hes1 siRNA组高于Hcy组和Hcy+Hes1siRNA组(图8B)。
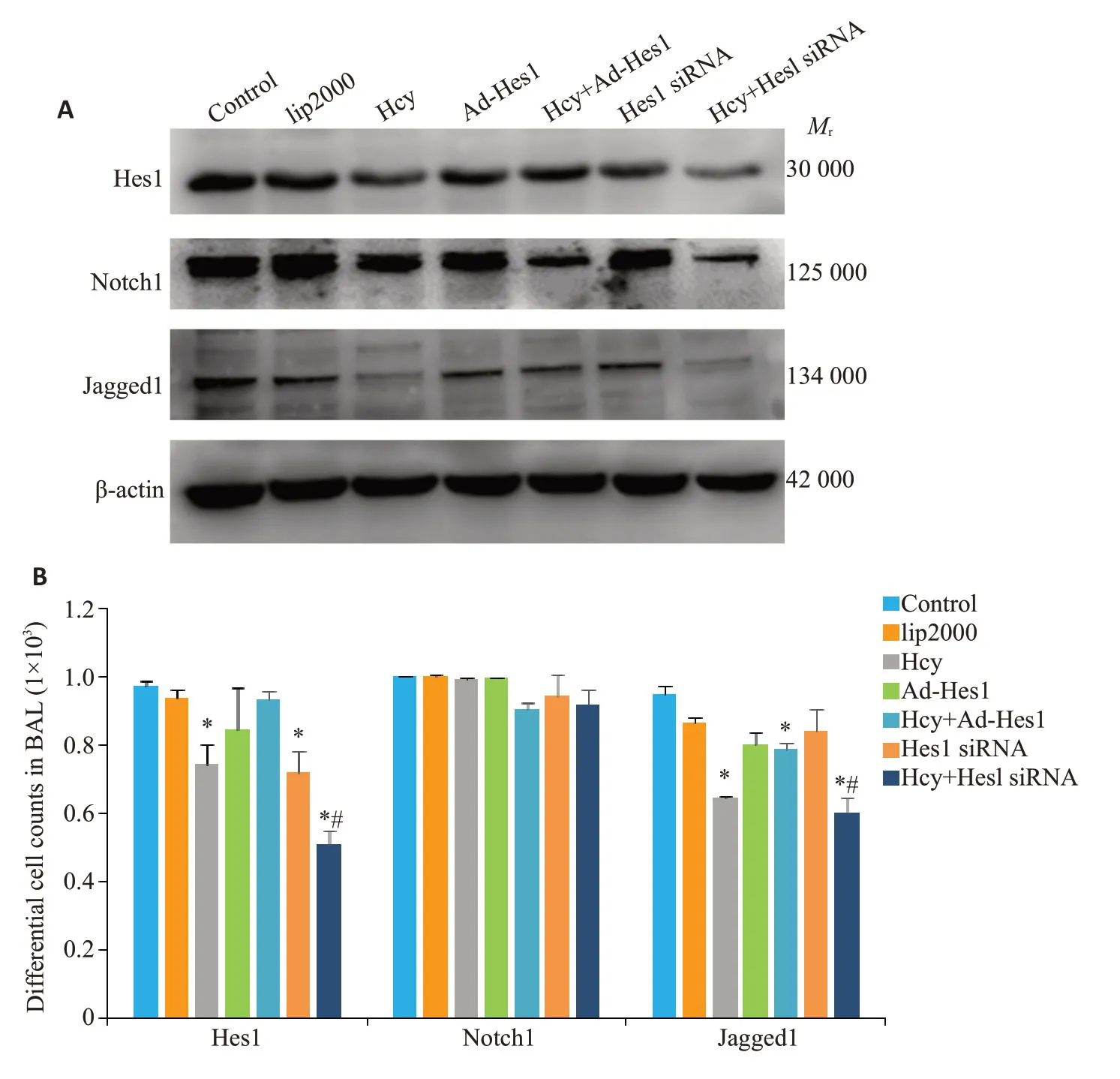
图8 Hcy对过表达和干扰Hes1后的影响Fig.8 Effect of Hcy on Hes1,Notch1 and Jagged1 expressions in HT22 cells with Hes1 overexpression and knockdown.A:Western blots of the proteins.B:Histogram of relative expression levels of the proteins.*P<0.05 vs con and si-NC groups,respectively;#P<0.05 vs Hcy group;n=3.
3 讨论
高同型半胱氨酸血症(HHcy)与神经和精神健康的改变有关,如认知障碍、抑郁症、中风和神经退行性疾病[3,19,24]。实验研究提示,HHcy能够导致脑组织损伤和神经细胞凋亡[18,22]、神经细胞自噬[22,23]。本研究显示,在HT22细胞,同型半胱氨酸100 μmol/L培养48h后,凋亡细胞的比例明显升高,细胞水肿、线粒体肿胀空泡化、自噬体增加;采用叶酸和维生素B12干预后细胞凋亡比例和细胞自噬明显降低。结果提示,高同型半胱氨酸能够诱导HT22细胞超微结构损伤、自噬上调及细胞凋亡。该结果与前期ApoE-/-高同型半胱氨酸小鼠体内研究基本一致[18,22,25]。
研究表明,HHcy在体内外均能诱导细胞凋亡[12,22]。然而,其中的作用机制尚不清楚。在本研究中,通过Western blot和real-time PCR 检测可见,同型半胱氨酸100 μmol/L培养48 h后,Bax基因表达明显增加,而Bcl-2基因表达则明显抑制。结果提示高同型半胱氨酸可通过bax/bcl-2途径引起细胞凋亡。实验研究发现,HHcy诱导小鼠神经细胞凋亡[22,25]。在衰老和神经退行性变过程中,可见神经元凋亡和自噬增加[23,26]。细胞凋亡增加、储备细胞减少可能是许多疾病共同的致病基础[1,22,27]。
HHcy能够诱导小鼠神经元自噬和细胞凋亡,从而加重神经元损伤[23,28]。作为自噬促进剂,HHcy可诱导大鼠脑缺血再灌注后LC3b/Beclin-1表达上调,自噬体积累,加重神经元损伤[22,28]。本研究结果显示,在同型半胱氨酸100 μmol/L 组,P62 相对值明显低于对照组,LC3II/LC3I比值明显高于对照组和干预组,这些变化与线粒体肿胀、空泡化、自噬体增加相一致。P62蛋白与蛋白质的运输和降解有关,表达下调时,自噬被激活[23,28]。关于HHcy引起神经细胞自噬增加的途径和机制尚不清楚[15,16]。HHcy 可抑制S-腺苷甲硫氨酸的生物合成,导致DNA低甲基化,抑制细胞生长[1,15,28]。
由HHcy引起的多种毒性作用可能与神经元再生耗竭有关[13,25,31]。本研究显示,同型半胱氨酸100 μmol/L处理的HT22细胞,HES1、HES5、Notch1和Jagged1蛋白表达降低。提示高同型半胱氨酸可下调Hes1、Hes5、Notch1和Jagged1的表达。动物实验研究结果提示,在HHcy 所致神经元损伤和认知障碍中,存在HES1 和HES5表达降低[18,22,25]。
在HHcy状态下,对于Notch/Hes/Rbpj信号通路以及Hes1、Hes5、Notch1和Jagged1神经元表达下调的意义和机制知之甚少,将需要更多的研究进行证明。Hes1andHes5基因是Hes基因家族的主要成员,作为转录激活因子参与神经元分化[20,21]。研究提示[27,29,30],Wnt/β-catenin和Notch信号通路与神经元干细胞动力学的调节密切相关;在神经干细胞中,Wnt和Notch信号通路参与了hNPCs 的调节[21,27]。在Notch/Rbpj 信号传导通路中起主导作用的Hes1和Hes5,在HHcy 小鼠的额叶皮层神经元和大脑中表达下调,可能抑制了Notch/Hes/Rbpj信号通路的作用[22,25,32]。