低强度脉冲超声抑制脓毒症大鼠脾脏淋巴细胞的凋亡
唐文韬,邓 娟,贺思程,李君粉,周艺情,王 嫣
1重庆医科大学生物医学工程学院、超声医学工程国家重点实验室,重庆 400016;2重庆市生物医学工程学重点实验室,重庆400016
脓毒症被定义为因宿主对感染的反应失调而引起的危及生命的严重器官功能障碍[1]。其发病机制复杂,主要包括炎症反应失衡、免疫功能障碍等病理生理过程[2]。在不断的研究中,免疫系统在脓毒症发生和发展,治疗和预后中所起的作用受到越来越多的重视。脾脏作为哺乳动物最重要的免疫器官之一,在机体内发挥防御作用,脾脏的损伤将造成机体免疫系统的功能紊乱甚至抑制[3],进而导致疾病的发生或加重病情的进程[4]。在脓毒症发生期间,会造成脾脏大量淋巴细胞凋亡[5,6],且凋亡数量与炎症的严重程度及患者预后密切相关[7]。如何抑制脓毒症所致脾脏淋巴细胞凋亡已成为研究的热点。当前已有研究表明,脓毒症患者经重组人IL-7治疗后可有效逆转淋巴细胞的减少,但有少数患者出现了2~3级皮疹的不良反应[8];另一项研究指出,新型双胍类药物IM156作用于脓毒症小鼠后显著减少了脾脏淋巴细胞凋亡,从而对脓毒症发挥保护作用,但该治疗操作繁琐,效果并不显著[9],因此亟需一种保护脓毒症期间脾脏淋巴细胞高效无创的新方法。
低强度脉冲超声(LIPUS)已被证实抗细胞凋亡[10]等特性,如Chiang等[11]认为LIPUS在急性肾损伤的治疗中可抑制细胞凋亡相关的分子信号。我们课题组前期研究发现,LIPUS直接辐照早发性卵巢功能不全模型的卵巢组织后,其组织中相关促凋亡因子的表达显著降低[12,13]。而目前LIPUS针对脓毒症的抗凋亡治疗未见报道。结合已有的工作基础,我们认为LIPUS直接辐照脾脏有望减轻脓毒症的脾脏淋巴细胞凋亡,保护脾脏的免疫功能,进而对脓毒症的缓解起到积极的作用。因此,本研究通过盲肠结扎穿刺术(CLP)建立脓毒症斯泼累格·多雷(SD)大鼠模型,拟用LIPUS辐照脓毒症SD大鼠脾脏区域,探究LIPUS对其存活率的影响,初步观察LIPUS抑制脾脏淋巴细胞凋亡的结果并阐明其相关机制,以期为临床脓毒症治疗探索一种无创、绿色的方法。
1 材料和方法
1.1 实验动物及分组
78 只SPF 级6~8 周龄雌性SD 大鼠,体质量200±20 g(重庆医科大学实验动物中心),许可证号:SCXK(渝)2018-0003。将SD大鼠分笼标准饲料喂养于重庆医科大学SPF 级动物实验室(温度:22±0.5 ℃,湿度:45%±5%,自然采光,自由饮食与进水)。适应性喂养1~2 d后,开始相应处理。将SD大鼠随机分成3组:假手术组(Sham,n=26)、盲肠结扎穿刺组(CLP,n=26)和超声组(LIPUS,n=26)。本实验过程所有操作通过重庆医科大学实验动物伦理委员会批准(伦理编号:20180625)。
1.2 实验仪器及试剂
低强度脉冲超声设备仪(重庆融海超声医学工程研究中心有限公司),光学显微镜(Olympus),荧光显微镜(Olympus),大鼠脾脏淋巴细胞分离试剂盒(Solarbio),胶原酶(Solarbio),CytoFLEX 流式细胞仪(Beckman Counter),WIX-EP600通用电泳仪(韦克斯科技有限公司),多功能酶标仪(TECAN),实时荧光定量PCR 仪(Agilent),可吸收性外科缝线(上海浦东金环医疗用品股份有限公司),即用型免疫组化Elivision™super试剂盒(福州迈新生物技术开发有限公司),DAB显色试剂盒(北京中衫金桥生物技术有限公司),一步法TUNEL细胞凋亡检测试剂盒(上海碧云天生物技术有限公司),B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl2-associated X protein,Bax)与半胱氨酸蛋白酶3(Caspase 3)一抗(Affinity),RNA快速提取试剂盒(南京Vazyme 生物有限公司),PrimeScript™RT reagent Kit(宝日医生物技术有限公司),荧光染料SYBR(南京Vazyme生物有限公司),引物(上海生工生物工程有限公司)。
1.3 脓毒症SD大鼠模型建立及干预
CLP组与LIPUS组均采用经典的盲肠结扎穿刺法建立脓毒症模型[14],适应性喂养结束后禁食12 h,术前进行异氟烷麻醉,腹部脱毛备皮,碘伏擦拭腹部后仰卧固定,无菌操作下于腹中线行2 cm开口以找到盲肠。在距离盲肠末端1~1.5 cm处结扎,并用21号针十字贯穿结扎处,挤出肠内内容物后,归回盲肠。最后依次缝合肌肉层与皮肤层。术后SD大鼠均出现寒颤、竖毛、腹泻、虚弱、饮食及活动频率减少,24 h后打开腹腔发现出现感染性腹水、粘连等症状,提示脓毒症模型建立成功。Sham组除不进行盲肠结扎穿刺外,其余手术操作均与CLP组、LIPUS组一致。3组大鼠均皮下注射0.9%生理盐水(20 mL/kg)进行液体复苏。LIPUS组采用低强度脉冲超声设备仪于术后立即进行1次超声辐照,辐照靶区确定为SD 大鼠肩关节至髋关节连线中点向上2 cm处脾脏区域。本研究中采用的超声参数如下:声强200 mW/cm2,时间20 min,频率0.37 MHz,重复频率1 kHz,占空比20%。CLP组与Sham组接受假治疗(探头无能量输出)。
1.4 研究方法
1.4.1 存活率研究 各组随机选取16只用于生存分析,余下10只用于术后24 h组织样本收集。建立脓毒症SD大鼠模型后,于术后4、8、16、24、36、48、72 h观察SD大鼠的存活情况并记录。观察结束后,对存活的SD大鼠实施安乐死。
1.4.2 HE染色法观察脾脏淋巴细胞数量变化 建模处理24 h后,对各组大鼠进行安乐死,取脾脏组织固定于4%多聚甲醛中。经脱水、包埋、切片、染色后,在光学显微镜下每张切片随机选择5个视野观察各组大鼠脾脏白髓区淋巴细胞的数量变化。
1.4.3 脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)检测脾脏淋巴细胞凋亡 建模处理24 h后,取各组SD大鼠脾脏组织石蜡切片,经过脱蜡、脱水后,滴加不含DNase的蛋白酶K,20~37 ℃作用15~30 min。PBS 清洗,接着按一步法TUNEL 细胞凋亡检测试剂盒说明书配置TUNEL 反应混合液,37 ℃避光孵育60 min。去掉反应液后,PBS清洗,DAPI复染,滴加抗荧光淬灭封片液封片。在荧光显微镜下观察拍照。
1.4.4 流式细胞术检测脾脏淋巴细胞的凋亡情况 将各组术后24 h存活的SD大鼠麻醉后处死,将其浸泡于75%的酒精中消毒杀菌,无菌条件下取其脾脏,撕掉被膜,装入预冷的PBS中,进行后续实验。上述各组脾脏组织移至无菌操作台后,迅速用预冷的PBS清洗3次,RPMI~1640清洗1次,以清除血液并保证无菌。每个样本取200 mg脾脏组织迅速用眼科剪剪成碎块,并加入胶原酶常温消化15~30 min,得到各组单细胞悬液。根据制造商的方案,使用淋巴细胞分离试剂盒分离脾脏淋巴细胞。上述各组脾脏淋巴细胞上机通过AnnexinV/PI双染流式细胞术检测淋巴细胞凋亡比例。
1.4.5 免疫组化检测大鼠脾脏组织中Bcl-2、Bax 与Caspase 3的表达 将术后24 h各组存活SD大鼠脾脏组织并制作石蜡切片,经过脱蜡、脱水、抗原修复后,使用内源性过氧化物酶阻断剂活性淬灭。接着将切片于Bcl-2、Bax与Caspase 3一抗在37 ℃下孵育1 h,再与生物素化的二抗孵育进行免疫组化染色。最后,用DAB显色试剂盒进行染色。在光学显微镜下每张切片随机选择五个视野进行检查,并用ImageJ(NIH,Bethesda,MD)进行定量分析。
1.4.6 Western blot检测脾脏组织相关凋亡蛋白的表达收集术后24 h各组SD大鼠脾脏组织,取20 mg组织加入裂解液于冰上裂解。BCA法测定蛋白浓度后确定蛋白上样量。根据目的蛋白相对分子质量的大小,配置合适的SDS-PAGE 凝胶后开始电泳,转至PVDF 膜后,37 ℃封闭60 min,再分别加入稀释后的兔抗大鼠Bcl-2、Bax、Caspase 3与β-actin一抗,4 ℃孵育过夜。TBST洗膜后加入稀释后的羊抗兔IgG 二抗,室温孵育2 h,TBST洗膜后采用ECL显影液显色。用ImageJ分析蛋白条带的灰度值。将目标蛋白与β-actin的比值用于比较蛋白表达水平。
1.4.7 实时荧光定量PCR检测脾脏组织相关mRNA的表达 收集术后24 h各组SD大鼠脾脏组织,通过快速提取RNA试剂盒提取SD大鼠脾脏组织的总RNA并检测RNA浓度。按照逆转录试剂盒合成cDNA,然后以其为模板参照荧光定量试剂盒制备20µL反应体系进行PCR 扩增。按照以下条件:95 ℃预热5 min,95 ℃5 s,60 ℃30 s,72 ℃30 s,以上为1个循环,重复40个循环进行qRT-PCR反应。TBP作为内参,采用2-△△ct法计算Bcl-2、Bax与Caspase 3 mRNA的相对表达量。引物序列见表1。

表1 引物序列Tab.1 Primer sequence used in this study
1.5 统计学分析
采用GraphPad Prism 8软件对实验数据进行统计学分析,计量数据以均数±标准差的方式表示。多组数据间比较采用单因素方差分析比较分析差异,进一步两两比较使用Turkey多重检验。使用Kaplan-Meier生存曲线分析各组大鼠存活率,然后使用对数秩检验分析存活率的统计学差异,P<0.05对认为差异具有统计学意义。
2 结果
2.1 LIPUS对各组SD大鼠72 h内存活率的影响
LIPUS组SD大鼠72 h存活8只,存活率为50%,存活时间为56.25±17.91 h;CLP组SD大鼠72 h内全部死亡,存活时间为32.50±16.90 h。与CLP组相比,LIPUS组显著提升其存活率及存活时间,差异具有统计学意义(P<0.05,图1)。

图1 LIPUS对脓毒症大鼠72 h存活率(A)与存活时间(B)的影响Fig.1 Effects of LIPUS on 72-h survival rate(A)and survival time(B)of the septic rats.*P<0.05.
2.2 LIPUS对各组SD大鼠脾脏淋巴细胞数量的影响
光学显微镜下观察各组SD大鼠脾脏淋巴细胞,淋巴细胞主要位于白髓区。CLP组脾脏组织白髓与红髓界限模糊,淋巴细胞数量较少且分布稀疏。LIPUS组白髓与红髓界限分布较为明显,淋巴细胞数量及分布较均匀。Sham组脾脏组织结构清晰,界限清楚,淋巴细胞数量及分布均正常。LIPUS组相较于CLP组脾脏组织结构较为完整,淋巴细胞数量明显增多(图2)。

图2 CLP组、LIPUS组与Sham组脾脏淋巴细胞的HE染色Fig.2 HE staining of splenic lymphocytes in CLP,LIPUS,and Sham groups.A-C: Black box indicates white pulp area of the spleen(Original magnification:×100).D-F:Enlarged view of the black box,and the green arrows indicate lymphocytes(×400).
2.3 LIPUS对各组SD大鼠脾脏淋巴细胞凋亡的影响
TUNEL结果显示,LIPUS能抑制脾脏淋巴细胞凋亡。与Sham组相比,CLP组脾脏淋巴细胞凋亡数目明显增加;与CLP组相比,LIPUS组脾脏淋巴细胞凋亡数目明显减少(图3A)。进一步通过流式细胞术对各组脾脏淋巴细胞的凋亡情况进行量化分析。其结果显示,LIPUS 组凋亡率为(35.10±2.67)%,CLP 组凋亡率为(41.53±2.66)%,Sham组凋亡率为(26.28±0.31)%。与Sham 组相比,CLP 组脾脏淋巴细胞凋亡率显著升高(P<0.05,图3B、C);与CLP组相比,LIPUS组脾脏淋巴细胞凋亡率显著降低(P<0.05,图3B、C)。
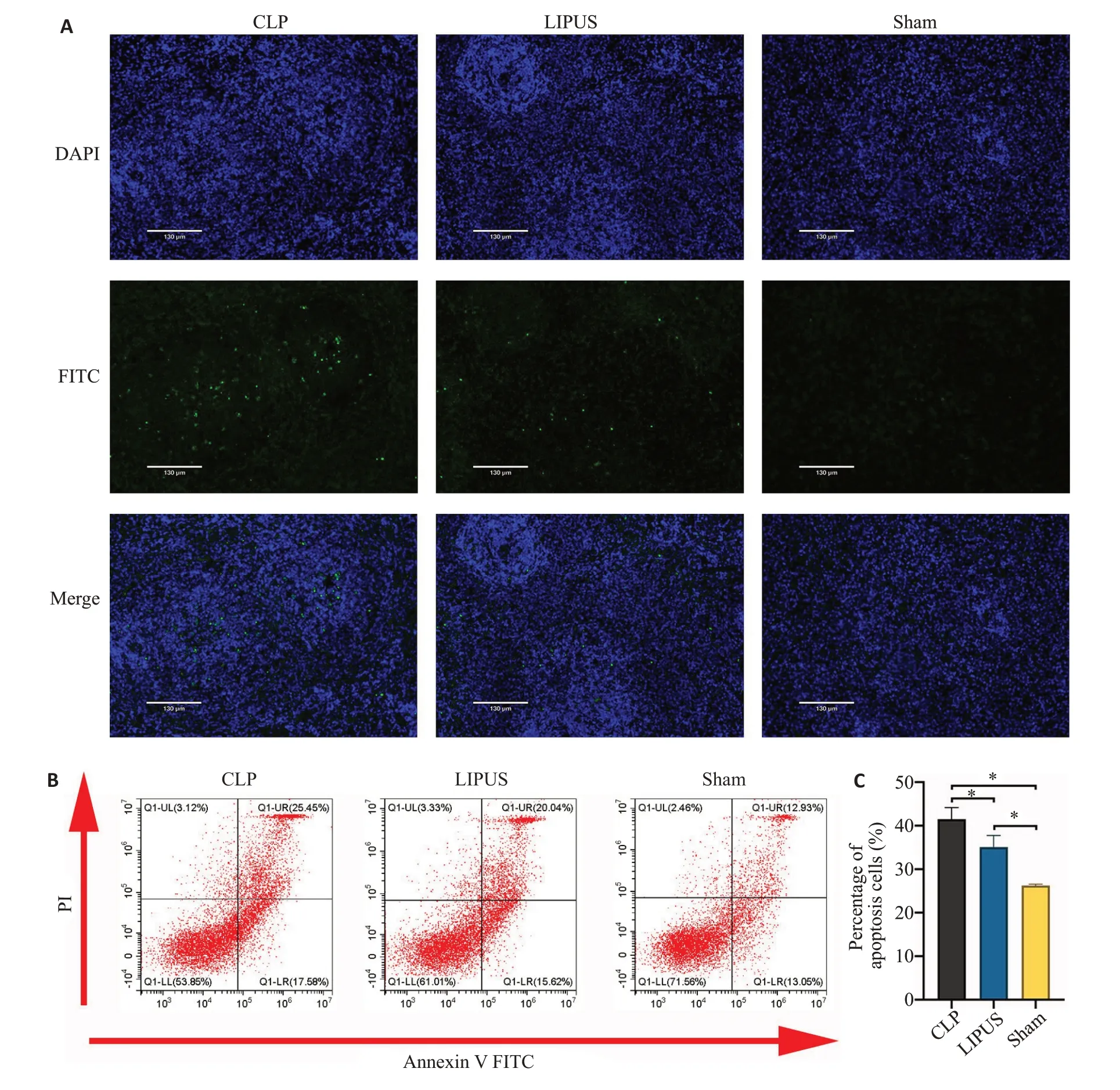
图3 CLP组、LIPUS组与Sham组脾脏淋巴细胞凋亡情况Fig.3 Apoptosis of splenic lymphocytes in CLP group,LIPUS group and Sham group.A: TUNEL staining of apoptotic splenic lymphocytes(×100).B,C:Flow cytometric analysis of apoptosis of the splenic lymphocytes.*P<0.05.
2.4 LIPUS 对各组SD 大鼠脾脏组织中Bcl-2、Bax 与Caspase 3蛋白表达水平的影响
通过免疫组化和Western blot检测各组SD大鼠脾脏组织中相关凋亡蛋白的表达情况。免疫组化结果显示,与Sham组相比,CLP组脾脏组织中Bax、Caspase 3蛋白表达水平显著升高(P<0.05),Bcl-2蛋白表达水平显著降低(P<0.05);与CLP组相比,LIPUS组脾脏组织中Bax、Caspase 3 蛋白表达水平显著降低(P<0.05),Bcl-2 蛋白表达水平显著升高(P<0.05,图4A)。Western blot结果进一步表明,与CLP组相比,经LIPUS治疗后,LIPUS组脾脏组织中Bax、Caspase 3蛋白表达水平显著降低(P<0.05),Bcl-2蛋白表达水平显著升高(P<0.05,图4B)。提示LIPUS 通过上调Bcl-2、下调Bax、Caspase 3蛋白的表达从而提升脓毒症SD大鼠的存活率。

图4 CLP组、LIPUS组与Sham组脾脏组织凋亡蛋白表达情况Fig.4 Expressions of apoptotic proteins in CLP group,LIPUS group and Sham group.A:Immunohistochemical staining (×400) and quantitative analysis of Bcl-2,Bax and Caspase 3 expressions.B: Western blotting for quantitative analysis of Bcl-2,Bax and caspase 3 expressions.*P<0.05.
2.5 LIPUS 对各组SD 大鼠脾脏组织中Bcl-2、Bax 与Caspase 3 mRNA表达水平的影响
实时荧光定量PCR 结果表明,与Sham 组相比,CLP组脾脏组织中Bax、Caspase 3 mRNA表达水平显著升高(P<0.05),Bcl-2 mRNA 表达水平显著降低(P<0.05);与CLP 组相比,LIPUS 组脾脏组织中Bax、Caspase 3 mRNA 表达水平显著降低(P<0.05),Bcl-2 mRNA表达水平显著升高(P<0.05,图5)。
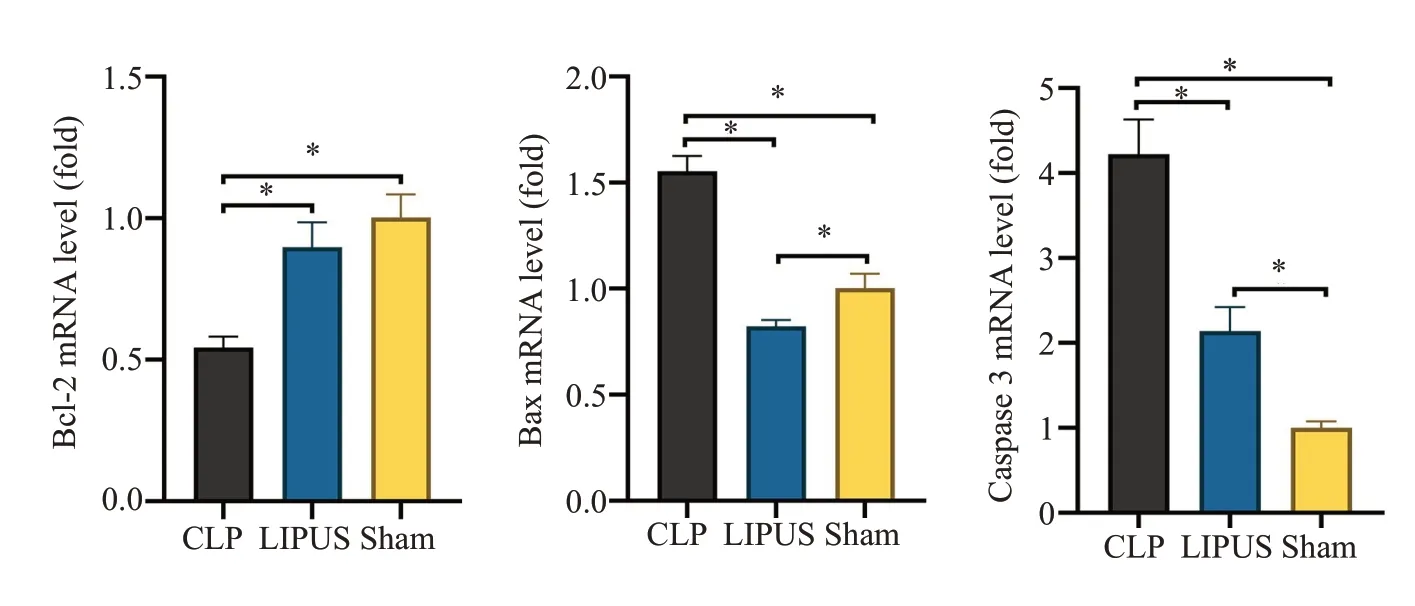
图5 CLP组、LIPUS组与Sham组脾脏组织中Bcl-2、Bax 与Caspase 3 相关mRNA相对表达情况Fig.5 Relative expressions of Bcl-2,Bax and Caspase 3 mRNA in the spleen of CLP,LIPUS and Sham groups.*P<0.05.
3 讨论
脓毒症早期以“细胞因子风暴”为特征,释放的炎性细胞因子将持续诱导下游细胞因子的产生与释放,从而导致器官损伤[15]。在此阶段,免疫细胞大量参与及耗竭造成了后期免疫功能受到抑制,加重脓毒症的发展。脾脏作为机体最大的免疫器官,其细胞凋亡的数目直接决定了脾脏功能的好坏[16]。因此,采取一定的措施抑制脾脏淋巴细胞凋亡有利于脓毒症患者的生存情况。
本研究首先观察了脓毒症SD大鼠经LIPUS治疗后72 h 内的存活情况。研究发现,LIPUS 治疗后,LIPUS组72 h内存活率及存活时间明显改善。Wang等[6]研究指出,自然衰老脓毒症大鼠经间充质干细胞静脉注射治疗后,治疗组血清中相关促炎因子(IL-1β、IL-6、IL-17A)表达降低,抗炎因子(IL-10)表达升高,脾脏淋巴细胞凋亡减少,其72 h存活率可达66.67%。Zhang等[17]研究表明,姜黄素作为临床上常见的抗炎、抗氧化药物,应用于脓毒症大鼠后,可通过调控TLR-4/NF-κB信号通路抑制血清炎症反应,将72 h存活率由20%提升至40%。本研究中LIPUS作为一种物理治疗技术,对脓毒症SD大鼠存活率的提升处于上述两种治疗方式之间,且LIPUS已从多方面、多层次研究证实其非侵入性与安全性[12],提示LIPUS能作为脓毒症的一种潜在治疗方式。但LIPUS提升脓毒症SD大鼠存活率是否通过抑制脾脏淋巴细胞的凋亡,从而增强免疫功能,还需要进一步研究。
细胞凋亡作为生命体的基本现象,是维持体内细胞数量动态平衡的基本措施。我们对LIPUS辐照后脓毒症SD大鼠脾脏淋巴细胞的凋亡情况进行了检测。首先通过观察各组脓毒症SD大鼠组织病理学改变,发现脓毒症发生时脾脏淋巴细胞数量减少,这可能是加重脓毒症进程的主要原因。而LIPUS治疗后,脾脏组织结构及淋巴细胞数量恢复,说明LIPUS可能通过保护脾脏免疫功能改善脓毒症进程。结合各组脓毒症SD大鼠脾脏组织TUNEL结果,我们同样发现脓毒症过程中存在脾脏淋巴细胞减少的情况,而LIPUS能明显抑制因盲肠结扎穿刺引起的脾脏淋巴细胞凋亡。流式细胞术的脾脏淋巴细胞凋亡变化情况也验证了这一点,脓毒症引起的CLP组的脾脏淋巴细胞凋亡显著高于Sham组,但是经LIPUS治疗之后,LIPUS组脾脏淋巴细胞的凋亡明显好转。有研究报道称[18],阻断程序性死亡受体-1配体可降低脓毒症小鼠组织Caspase 3表达,且促炎因子表达降低(TNF-α、IL-6),抗炎因子表达升高(IL-10),进而改善淋巴细胞凋亡率。Lou等[19]研究报道,电针刺激脓毒症大鼠两侧足三里后,Bcl-2表达升高,肠组织淋巴细胞凋亡减少,免疫功能恢复,这可能与电针调控Bcl-2家族蛋白有关。此外,已有研究[20]证明电针刺激足三里可通过上调Bcl-2蛋白表达从而抑制脾脏等免疫器官淋巴细胞的凋亡。我们将继续深入研究LIPUS抑制脾脏淋巴细胞凋亡是否通过Bcl-2家族蛋白调控机制发生。
脾脏淋巴细胞的大量凋亡是脓毒症患者发生免疫抑制的重要原因[21],而脓毒症发生时其脾脏淋巴细胞凋亡的机制十分复杂。为了进一步明确引起脾脏淋巴细胞凋亡的具体原因,本研究继续对凋亡蛋白及相关mRNA的表达水平进行了检测。线粒体凋亡作为经典的凋亡通路,在脓毒症的发展过程中扮演极其关键的角色[22]。Bcl-2家族蛋白主要分为抗凋亡蛋白Bcl-2与促凋亡蛋白Bax[23]。当前普遍认为,Bcl-2家族蛋白负责调控细胞凋亡的关键步骤,即线粒体外膜透化[24],随后释放细胞色素C激活下游Caspase 3表达,从而诱导细胞程序性死亡[25],而Caspase 3的高表达水平将导致不可逆的细胞凋亡[26]。Chen等[27]研究显示,在脂多糖诱导脓毒症模型中,Toll样受体4敲除的大鼠Bax与Caspase 3的表达被抑制,Bcl-2的表达得到改善,从而抑制了脂多糖导致的细胞凋亡。我们的实验数据表明,LIPUS显著上调Bcl-2的蛋白和mRNA的表达水平,显著下调Bax与Caspase 3的蛋白和mRNA的表达水平,提示LIPUS可能调控线粒体凋亡通路,抑制脾脏淋巴细胞的凋亡。
综上所述,LIPUS可提高脓毒症SD大鼠的72 h内存活率,延长存活时间,减少脾脏淋巴细胞的凋亡,这种保护作用可能是通过线粒体通路下调Bax及Caspase 3的表达,上调Bcl-2的表达实现的。本结果将为后续深入研究LIPUS调控脓毒症大鼠的免疫功能打下基础。
- 南方医科大学学报的其它文章
- 高表达分泌颗粒蛋白II增加结直肠癌细胞对奥沙利铂的耐药性
- Neutrophil-lymphocyte and platelet-lymphocyte ratios for assessing disease activity in patients with rheumatoid arthritis receiving tofacitinib treatment
- 淫羊藿素通过调控铁死亡增加鼻咽癌细胞的放射敏感性
- 靶向结直肠癌的小白菊内酯脂质体纳米颗粒诱导程序性坏死并改善T细胞耗竭
- 二甲双胍减轻阿霉素诱导的心脏毒性:基于AMPK通路
- 甲基转移酶样3抑制剂STM2457通过调节线粒体功能改善代谢相关脂肪性肝病