丙泊酚对不同发育时期斑马鱼鞘磷脂蛋白表达的影响
郭志华,王志鹏,曾琳玲,纪雪霞
南方医科大学附属广东省人民医院(广东省医学科学院)麻醉科,广东 广州510080
静脉麻醉药物丙泊酚对发育期大脑的神经毒性作用一直是麻醉学和神经发育学领域的研究热点。已有研究证实,丙泊酚在突触发育的关键时期可诱导啮齿类动物神经元的凋亡及干扰突触的形成,引起发育中大脑的神经病变,导致随后认知功能改变[1-4]。但胚胎期暴露于丙泊酚是否产生神经功能损害的研究较少。有研究显示,斑马鱼胚胎暴露于丙泊酚不仅引起胚胎孵化率降低,幼鱼畸形率增加,还导致3 d幼鱼鞘磷脂蛋白(MBP)生产减少[5];有研究进一步证实MBP减少可能与OL凋亡增多及转录因子olig1、olig2 和sox10 受到抑制相关[6]。而丙泊酚对MBP抑制效应是否具有持续性及相关分子机制尚待探索。本研究旨在探讨胚胎期丙泊酚暴露对斑马鱼发育不同时期MBP表达的影响及相关分子机制,现报道如下。
1 材料和方法
1.1 材料
丙泊酚原液(sigma),兔抗斑马鱼MBP多克隆抗体(genetex),兔抗GAPDH 多克隆抗体(genetex),兔抗GFP抗体(abcam),TUNEL试剂盒(Roche),qPCR引物由上海生工股份有限公司合成、逆转录试剂盒量(TaKaRa),RNA提取试剂盒(TaKaRa),RT-PCR试剂盒(TaKaRa),PCR仪(LightCycle480,Roche),荧光电动显微镜(Olympus corporation)。
1.2 方法
1.2.1 实验分组 采用wild-type AB strain斑马鱼和转基因品系Tg(mbp:EGFP),鱼龄6~9月。采集受精后30 min 内产下的受精卵,置于加入亚甲基蓝溶液(0.2‰)的新鲜养鱼水中,于恒温孵箱中28.5 ℃孵育。将孵育至6 hpf的斑马鱼胚胎转移至6孔板中,30个卵/孔。吸净孔中的孵化水后迅速加入含30µg/mL丙泊酚(丙泊酚组)、二甲基亚砜(DMSO组)和空白孵化水(对照组),8 mL/孔。受精24 h时,各组受试液更换一半相同浓度的液体,48 h时全部更换为新鲜的孵化水。及时取出死亡的胚胎,以卵凝结和心脏停止跳动作为死亡的终点。
1.2.2 qRT-PCR检测mbp、caspase-8、caspase-9和caspase-3mRNA转录水平 收集发育不同时期斑马鱼幼鱼,60条/组,采用Trizol法提取脑组织总RNA,行逆转录得到cDNA。按照TaKaRa操作说明书加样扩增反应体系,反应条件为:预变性95 ℃30 s;循环反应95 ℃5 s,60 ℃30 s,40个循环;冷却至50 ℃。PCR引物序列如下:mbp上游引物5'-AATCAGCAGGTTCTTCGGA GGAGA-3',下游引物5'-AAGAAATGCACGACAGG GTTGACG-3';caspase-8上游引物:5'-ATGCTGGAGA AACATGCCATGCAG-3',下游引物:5'-AGGGTGTTT ACTTGGGCCTGA-3';caspase-9上游引物:5'-GTGA CCATGCCAGCATTTC-3',下游引物:5'-TGGTTCTC CACTTTTTTC ACCTT-3';内参efla上游引物5'-TAC TTCTCAGGCTGACTGTG-3',下游引物5'-ATCTTCT TGATGTATGCGCT-3'。结果采用2-ΔΔCt评价目的基因的相对表达量。
1.2.3 Western blot测定MBP、caspase蛋白表达 提取3 d幼鱼总蛋白,60条/组,BCA法测定蛋白浓度。采用15%SDS-PAGE分离胶,每孔上样量50 μg,恒压电泳后转移至PVDF膜。转膜后,5%脱脂奶粉封闭1 h,分别加入兔抗斑马鱼一抗MBP多克隆抗体(1∶1000稀释)、兔抗GAPDH 多克隆抗体(1∶1000稀释),4℃孵育过夜。次日洗膜后加入二抗羊抗兔HRP抗体(1∶10 000稀释)室温孵育。浸泡于ECL发光液,用凝胶成像系统采集图像,所采集图像用ImageJ软件分析目标条带的灰度值。Caspase 家族蛋白一抗分别为:兔抗斑马鱼caspase-3一抗稀释液(1∶1000),caspase-8一抗稀释液(1∶1000),caspase-9一抗稀释液(1∶1000)。
1.2.4 TUNEL染色 收集3 d Tg(mbp:GFP)转基因幼鱼,6条/组,经过4%多聚甲醛固定后20%、30%蔗糖脱水,制备冰冻切片。然后进行枸橼酸抗原热修复,加入2%山羊血清封闭、通透后,再加入兔抗-GFP 抗体(1∶200),4℃过夜;最后加入二抗山羊抗兔(1∶500),室温避光1 h。按操作说明书配置TUNEL混合液,于37℃避光孵育1 h。DAPI核染后加入抗荧光淬灭剂封片,于荧光显微镜下拍照。
1.3 统计学分析
采用SPSS21.0软件进行统计学分析,计量资料以均数±标准差表示,组间比较行单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 丙泊酚对发育不同时期幼鱼mbp mRNA 转录的影响
与对照组相比,在受精后3、4、5、6、7 d,丙泊酚组幼鱼mbp mRNA 转录水平降低,差异有统计学意义(P<0.05,图1)。DMSO组与对照组的差异无统计学意义(P>0.05)。出生后10d,3组差异无统计学意义(P>0.05)。
2.2 丙泊酚对发育不同时期幼鱼MBP合成的影响
与对照组相比,在受精后3 d和7 d,丙泊酚组幼鱼MBP合成水平降低,差异有统计学意义(P<0.05,图2)。DMSO组与对照组的差异无统计学意义(P>0.05)。出生后10 d,3组间差异无统计学意义(P>0.05)。
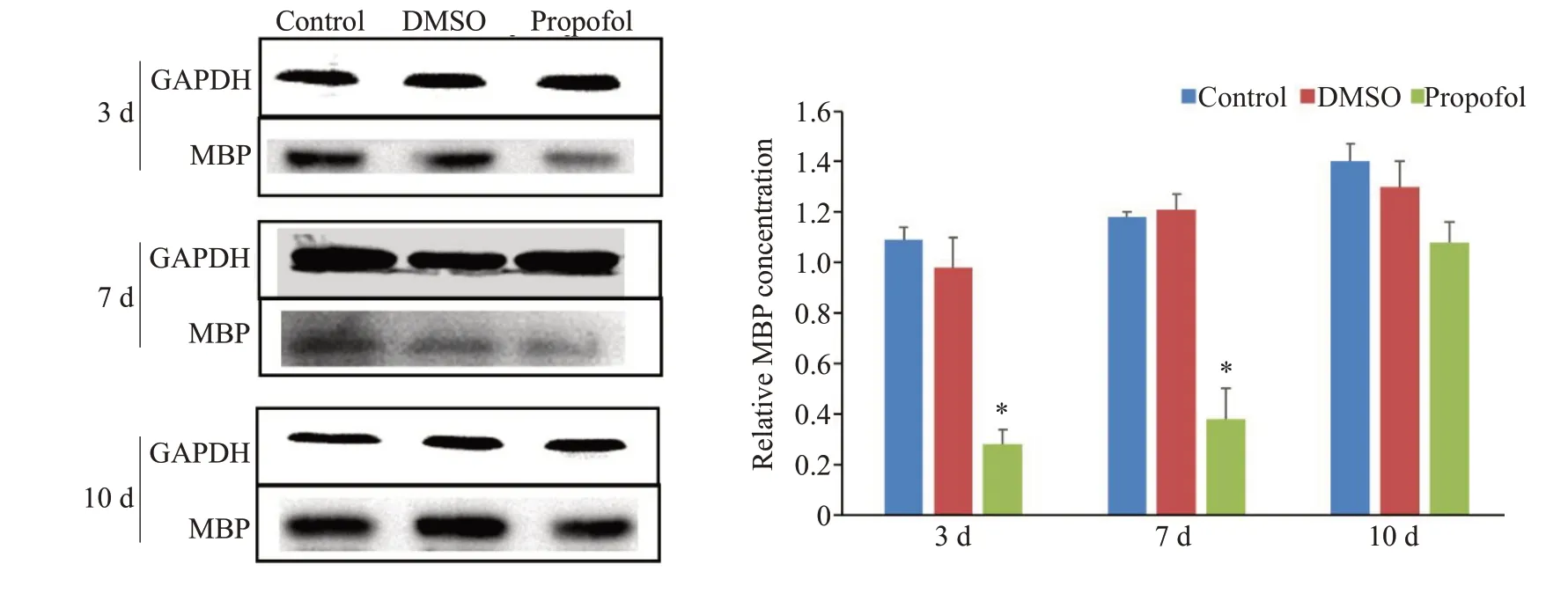
图2 丙泊酚对发育不同时期幼鱼MBP蛋白的影响Fig.2 Effect of propofol on expression of MBP in zebrafish at different developmental stages.*P<0.05 vs control group.
2.3 丙泊酚对3 d幼鱼细胞凋亡的影响
与对照组相比,3 d幼鱼OL细胞凋亡数量增多,差异有统计学意义(P<0.05,图3)。DMSO组与对照组的差异无统计学意义(P>0.05)。
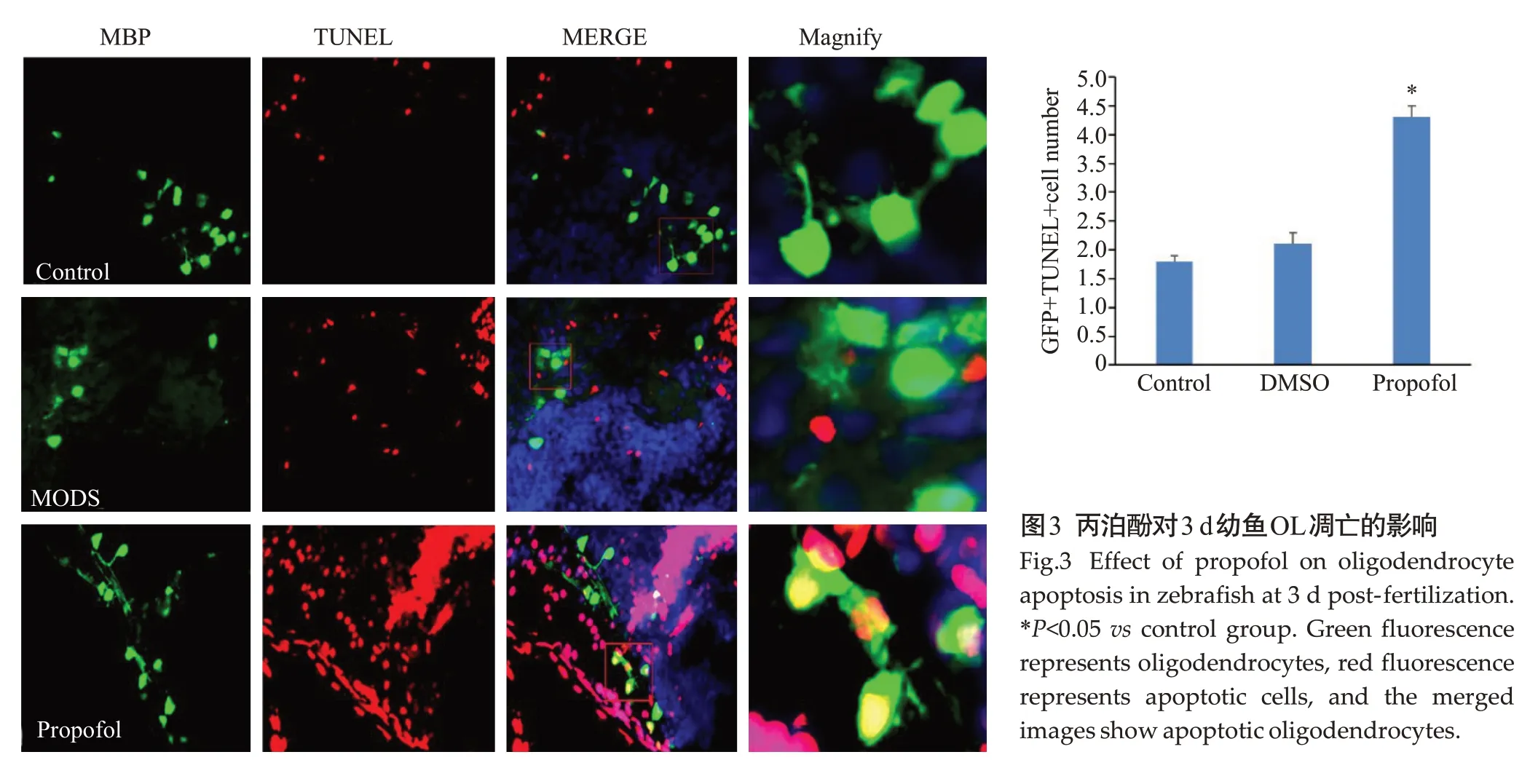
图3 丙泊酚对3 d幼鱼OL凋亡的影响Fig.3 Effect of propofol on oligodendrocyte apoptosis in zebrafish at 3 d post-fertilization.*P<0.05 vs control group.Green fluorescence represents oligodendrocytes,red fluorescence represents apoptotic cells,and the merged images show apoptotic oligodendrocytes.
2.4 丙泊酚对凋亡相关因子转录水平的影响
与对照组相比,丙泊酚组3 d 幼鱼caspase-3、caspase-8和caspase-9 mRNA转录水平升高,差异有统计学意义(P<0.05,图4)。DMSO组与对照组的差异无统计学意义(P>0.05)。

图4 丙泊酚对3 d 幼鱼caspase-3、caspase-8 和caspase-9 mRNA的影响Fig.4 Effect of propofol on expressions of caspase-3,caspase-8 and caspase-9 mRNA in zebrafish at 3 d post-fertilization.*P<0.05 vs control group.
2.5 丙泊酚对凋亡相关因子蛋白合成的影响
与对照组相比,丙泊酚组3 d 幼鱼caspase-3、caspase-8和caspase-9 蛋白合成水平升高,差异有统计学意义(P<0.05,图5)。DMSO组与对照组的差异无统计学意义(P>0.05)。
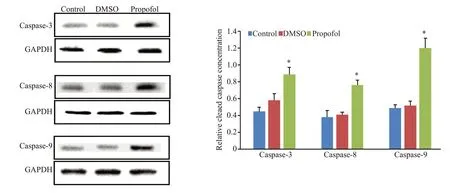
图5 丙泊酚对3 d幼鱼caspase-3、caspase-8和caspase-9蛋白合成的影响Fig.5 Effect of propofol on the expression of caspase-3,caspase-8 and caspase-9 protein in zebrafish at 3 d post-fertilization.*P<0.05 vs control group.
3 讨论
丙泊酚对发育中大脑的毒性作用是近年来临床工作者和患儿家属高度关注的问题。临床研究表明,在4岁前或2岁前经历过多次麻醉史的患儿随后出现学习、记忆能力下降的风险增加[7-9]。啮齿类动物实验也证实,丙泊酚可影响神经系统的发育,出现学习、记忆等功能障碍[10,11],其机制可能和促进细胞凋亡和抑制细胞增殖有关。研究还发现,与啮齿类动物结果一致,斑马鱼胚胎暴露于丙泊酚不仅引起胚胎孵化率降低,幼鱼畸形率增加,还抑制MBP表达[5]。MBP是成熟少突胶质细胞OL特异性表达蛋白[12],其包绕神经元的轴突形成髓鞘,是保证神经信号快速、准确传导的重要结构[13]。OL的发育异常、MBP合成减少均会引起髓鞘结构异常甚至缺失,导致相关的神经系统疾病[14]。胚胎期丙泊酚暴露对MBP的抑制作用是否具有持续性及相关分子机制值得探讨。本研究分析了胚胎期丙泊酚暴露后对斑马鱼发育不同时期MBP表达的影响及相关分子机制,结果显示,胚胎期丙泊酚暴露可引起发育后3~7 d幼鱼MBP mRNA和蛋白水平降低,而10 d幼鱼无明显变化,这提示丙泊酚对MBP的抑制作用具有短期持续性;本研究进一步检测了3 d幼鱼OL凋亡及凋亡相关因子变化情况,发现3 d幼鱼OL凋亡数量增加,并伴随caspase家族caspase-3、caspase-8、caspase-9 mRNA 和蛋白水平升高,提示OL凋亡可能是MBP表达下降的机制之一。
受精后3 d是斑马鱼发育过程中重要时期,不仅是胚胎蜕膜孵化成幼鱼的关键时期,也是少突胶质细胞表达MBP形成髓鞘结构的初始时期[15]。已有研究证实[5],胚胎期丙泊酚暴露可抑制mbp mRNA转录水平和蛋白合成水平。本实验也得出一致结论,丙泊酚引起3 d幼鱼MBP mRNA转录水平和蛋白合成下降;而这种抑制作用是否持续,尚无相关报道。本研究进一步检测幼鱼发育不同时期发现,经丙泊酚暴露后,4、5、6、7 d幼鱼MBP mRNA转录和蛋白合成均受到抑制,差异有统计学意义;而受精后10 d幼鱼的MBP mRNA转录水平和蛋白合成水平与对照组的差异无统计学意义,这表明胚胎期丙泊酚暴露对MBP的抑制作用具有短期持续性,可引起发育3~7 d幼鱼MBP 表达下降。在发育第10天,此抑制现象消失,MBP表达恢复正常。在幼儿的生长发育过程中,髓鞘化过程是必不可少的重要环节。MBP的表达异常可影响髓鞘形成过程,导致髓鞘异常、甚至缺失,从而引起神经信号传导异常[16],可表现为认知功能障碍、语言、视力减弱、震颤、肌痉挛等[17]。探讨丙泊酚抑制MBP表达的分子机制将为丙泊酚对发育中大脑的毒性作用研究提供重要的理论数据,意义重大。
细胞凋亡是内外环境的变化或在死亡信号的触发下,在基因调控下所发生的一系列细胞主动死亡的过程。异常因素引起神经细胞凋亡程序紊乱,会导致胎儿大脑发育异常。目前认为触发细胞凋亡的信号传导通路主要包括内源性途径(线粒体凋亡途径)和外源性途径(细胞膜受体凋亡途径)。细胞色素C、caspase-3、caspase-8、caspase-9是在此两条通路中发挥重要作用的关键要素[18]。已有研究证实,丙泊酚引起的学习、记忆能力下降与神经元凋亡增多相关[19,20];丙泊酚可明显上调细胞色素C、caspase-3、caspase-8、caspase-9,提示丙泊酚通过激活细胞膜受体介导和线粒体介导的信号传导通路诱导胚胎期神经干细胞的凋亡[21]。那么,丙泊酚是否通过激活此信号传导通路诱导OL细胞凋亡增多,值得探索。
MBP蛋白表达于OL细胞及髓鞘浆膜面,转基因斑马鱼Tg(mbp∶GFP)是将mbp基因的启动子与GFP基因重组,因此GFP阳性细胞即为MBP蛋白表达阳性的成熟OL。本研究采用转基因斑马鱼Tg(mbp:EGFP)与免疫荧光技术,检测了3 d幼鱼OL凋亡,结果显示丙泊酚组幼鱼OL凋亡数量增多,这提示OL凋亡增多,导致成熟OL数量减少,可能是MBP表达下降的机制之一,这与既往研究[22]结论一致,该研究也发现当孕期猕猴单次或持续接受丙泊酚腹腔注射后,丙泊酚不仅可诱导胎儿及新生猕猴脑部神经元凋亡,在MBP表达初期,诱导OL的凋亡。本研究还检测了启动细胞内和细胞外凋亡程序的caspase-3、caspase-8、caspase-9,结果与凋亡数量增加一致。丙泊酚暴露组caspase-8、caspase-9 和caspase-3 mRNA转录水平和蛋白合成水平均升高,这提示内源性和外源性细胞凋亡信号通路的激活介导了丙泊酚所致的OL凋亡,是丙泊酚诱导细胞凋亡的机制之一。
综上所述,本实验证实胚胎期丙泊酚暴露可引起发育3~7 d幼鱼MBP表达下降,其机制可能与OL凋亡相关。然而,3~7 d幼鱼MBP表达下降是否引起髓鞘结构的异常,从而导致神经信号传导异常,引起神经系统功能障碍,还需在后续研究中进一步探索。