黑木耳生产中重金属转移规律*
董照锋,李 俊,赵 宇,陆 康,乔怡木
(商洛市农产品质量安全中心,陕西 商洛 726000)
黑木耳(Auricularia auricula) 是我国历史上栽培时间最早、食用历史较悠久的食用菌之一,是珍贵的药食同源真菌,有 “素中之荤” 之美誉,广受消费者的青睐[1]。近年来,黑木耳的生产规模、产量、出口量和消费量逐年增加,我国已成为其生产、消费和出口大国。2021 年,黑木耳栽培140 多亿袋,鲜品产量703.44 万吨,成为我国食用菌产量第二的品种[2]。但环境的污染和栽培方式的改变,重金属对黑木耳质量安全的影响日趋严重,已对产业和消费安全构成了严重威胁,成为国际贸易技术壁垒的主要障碍[3-4]。因此,探明黑木耳生产过程中重金属的转移转化规律,解决重金属污染是当前的迫切需要。
国内关于黑木耳重金属的研究主要集中在风险评价和富集规律方面。夏珍珍等[5]研究了黑木耳菌丝对Pb、Cr、Cd 的富集规律,考察了不同金属浓度对菌丝生长的影响。李萍等[6]研究表明合肥市区大型超市和农贸市场中黑木耳产品质量较优,重金属污染指数较低。孙向东等[7]研究表明富硒黑木耳伴生重金属Cr 现象较普遍,富硒木耳中Se和Cr、Pb 具有伴生关系。杨樟贵等[8]研究表明黑木耳对菌棒的Pb、Cd 的浓度敏感,菌棒中增加一个浓度梯度,黑木耳中Pb、Cd 的富集量均明显提高。汪禄祥等[9]研究表明云南省黑木耳中Pb 的安全指数大于Cd,Pb 的风险大于Cd,黑木耳的消费量在很大程度上影响着重金属Pb、Cd 对消费者的整体危害程度(IFS)。李丹蕾等[10]研究表明,木段法栽培的黑木耳重金属含量低于野生黑木耳及菌袋法栽培的黑木耳。董照锋等[11]研究表明商洛市食用菌栽培基质与灌溉水中存在As 污染,虽然食用菌中Pb、Cd、Hg、As 含量低于相关标准,但As 含量对儿童的摄入风险较高。巫仁高[12]研究表明黑木耳子实体对Cd、Hg 有强富集作用,对Pb 富集作用较弱,自然状态下子实体中Pb、Cd、Hg、As 含量很低。高陈玲[13]研究表明,Pb2+对黑木耳生长有抑制作用,Hg2+对其菌丝生长有抑制作用,当Cd2+浓度由0.1 mg·kg-1增加至20 mg·kg-1时,菌丝生长速度先加快后减慢。柴红梅等[14]研究表明,2 株野生黑木耳菌株对Cd 的耐受力强于栽培菌株,低浓度Cd (<2 mg·L-1) 对黑木耳菌株的生长有促进作用。但目前国内关于黑木耳生产过程重金属转移转化规律的研究尚未见详细报道。因此,试验通过在黑木耳栽培基质中添加不同浓度的Pb、Cd、Hg、As,测定木耳生产过程中各环节的重金属含量,考察黑木耳生产过程中重金属的转移转化规律,以期为黑木耳重金属控制提供科学依据。
1 材料与方法
1.1 供试材料
供试木耳品种为当地主栽品种 “黑威15”,栽培种自繁;Pb、Cd、Hg、As 供试标准品生产厂家为国家有色金属及电子材料分析测试中心;试验地点为商州区杨斜镇食用菌生产基地;设施类型为钢架结构塑料大棚;栽培基质由生产基地提供。
1.2 试验设计
1.2.1 试验处理
以Pb、Cd、Hg、As 元素为研究对象,以标准《绿色食品 食用菌》(NY/T 749-2018)[15]为依据,4 种元素在木耳干品中的限量值分别为2.0、1.0、0.2 和1.0 mg·kg-1。以各限量值的0.5、1.0、2.0、4.0、8.0倍5 个梯度浓度在栽培基质中加标培养,Pb 元素的加标浓度分别为1.0、2.0、4.0、8.0、16.0 mg·kg-1;Hg 元素的加标浓度分别为0.1、0.2、0.4、0.8、1.6 mg·kg-1;Cd 元素和As 元素加标浓度分别为0.5、1.0、2.0、4.0、8.0 mg·kg-1。设1 个空白对照(CK)、5 个混标处理,分别为A1 (0.5 倍)、A2(1.0 倍)、A3 (2.0 倍)、A4 (4.0 倍)、A5 (8.0 倍),每个处理110 袋,生产管理方式与当地一致。
1.2.2 栽培基质配方与生产工艺流程
按照常规生产的比例配制栽培配方:混合木屑81%、麸皮12%、豆粕5%、石膏1%、石灰1%,混匀。采用机械拌料装袋,菌包干质量为0.52 kg、鲜质量为1.3 kg。具体工艺流程[16]:拌料制袋→灭菌(121 ℃灭菌4 h) →接种(液体接种量25 mL) →培养→刺孔→摆袋→出耳采收(按照 “采大留小” 原则采摘,一般采集4~5 茬,每次采摘后养菌2~3 d再浇水进行出耳管理)。
1.2.3 时间安排
2021 年12 月下旬拌料装袋、灭菌、接种,2022年3 月中下旬菌包进棚,养菌约7 d 进行菌包刺孔,约10 d 摆袋,出耳管理后于5 月中旬至7 月初采摘完毕。
1.2.4 采样环节
在拌料装袋、接种、摆袋3 个环节中,每个处理随机采集3 个菌包,出耳阶段采摘每茬黑木耳,自然晾晒干制。每个采样环节采集的样品,干制后于4 ℃冷藏保存。
1.3 检验方法
采用电感耦合等离子体质谱仪(ICP-MS),依据《食品安全国家标准 食品中多元素的测定》(GB 5009.268-2016)[17]第一法,测定试样中铅(Pb)、镉(Cd)、总砷(As)、总汞(Hg) 4 种元素含量。
1.4 数据处理
为确保测定数据的准确性,开展精密度试验、重复性试验和准确度试验。所测数据为3 个样品平均值。黑木耳各重金属元素的平均含量(mg·kg-1)计算公式为:
式中:Hn为n 批次木耳元素平均测定值(mg·kg-1);Gn为n 批次木耳质量(kg)。
黑木耳元素富集系数(Z) 计算公式为:
式中:Hn为n 批次木耳元素平均测定值(mg·kg-1);Gn为n 批次木耳质量(kg);C 为栽培基质中元素含量(mg·kg-1)。
数据处理、统计分析采用Excel 2003 和SPSS 22.0 软件。
2 结果与分析
2.1 方法学试验
标准工作曲线各元素线性相关系数数值为0.998~1.000,线性关系良好,各元素的检出限为0.005 474~0.162 100 μg·L-1,该方法满足分析要求。精密度试验和重复性试验结果表明,连续6 次测的Pb、Cd、As、Hg 质量浓度的RSD (n=6) 为2.52%~2.95%,说明试验精密度和重复性良好。准确度试验结果表明,试验选取标准物质GBW (E) 100359 大米粉的各元素检测值均符合要求。
2.2 黑木耳栽培基质本底值
按栽培基质配方比例将木屑、麸皮、豆粕、石膏、石灰及水等原料混匀,测定其As、Cd、Hg、Pb的元素含量。结果表明,黑木耳栽培基质中As、Cd、Hg、Pb 元素的本底值分别为(0.029 ± 0.001)mg·kg-1、(0.008 ± 0) mg·kg-1、(0.002 ± 0) mg·kg-1和(0.075 ± 0.001) mg·kg-1,生产用水中4 种重金属元素均未检出。
2.3 黑木耳中各重金属元素的转移转化规律
2.3.1 As 试验结果及数学模型
黑木耳中重金属As 元素的富集情况见表1。

表1 黑木耳子实体中As 含量Tab.1 The content of As in the fruit bodies of Auricularia auricula
如表1 所示,A1 组配方黑木耳As 含量为0.221~0.399 mg·kg-1,平均为0.241 mg·kg-1,均未超出限量值1.0 mg·kg-1。A2 组配方黑木耳As 含量为0.244~1.637 mg·kg-1,平均为0.517 mg·kg-1。A3 组试验配方黑木耳As 含量为0.547~2.592 mg·kg-1,平均为0.634 mg·kg-1。A2 和A3 组配方第5 茬黑木耳As含量均最高且超出限量值。A4 和A5 组配方所有采样黑木耳As 含量均超出限量值。5 个处理第5 茬黑木耳As 元素含量均显著高于1~4 茬,且1~4 茬间差异不显著。由此可知,黑木耳中As 含量随栽培基质含量的增加而升高。
菌包中重金属As 在黑木耳栽培过程中的含量变化见表2。

表2 As 转移试验结果Tab.2 Results of As transformation experiment
如表2 所示,拌料制袋、灭菌、接种至菌包摆袋环节基质中As 元素含量无明显变化。黑木耳的As 富集系数随栽培基质中As 含量的增加逐渐减小。
以栽培基质中As 平均含量(x) 和黑木耳中As平均含量(y) 之间的关系建立数学模型,该模型表达式为y=0.046+0.389x-0.022x2,该二次曲线模型R2=0.984,P=0.016,说明该模型能较好的体现黑木耳对栽培基质中As 元素的富集情况。以干木耳中As 限量值1.0 mg·kg-1为依据,利用回归方程预测黑木耳栽培基质中As 含量的污染限值为2.942 mg·kg-1。
2.3.2 Cd 试验结果及数学模型
黑木耳中重金属Cd 元素的富集情况见表3。

表3 黑木耳子实体中Cd 元素含量Tab.3 The content of Cd in the fruit bodies of Auricularia auricul
如表3 所示,A1 组配方黑木耳Cd 含量为0.189~0.459 mg·kg-1,平均值为0.269 mg·kg-1,A2组配方黑木耳Cd 含量为0.219~0.849 mg·kg-1,平均值为0.358 mg·kg-1,均未超出限量值1.0 mg·kg-1。A3组配方黑木耳Cd 含量为0.455~1.669 mg·kg-1,平均值为0.551 mg·kg-1;第5 茬黑木耳Cd 含量最高且超出限量值。A4 组配方有2 茬黑木耳Cd 含量接近临界值但其余均超出限量值。A5 组配方所有黑木耳Cd 含量均超出限量值。5 个处理中第5 茬黑木耳的Cd 含量显著高于1~4 茬,随着栽培基质中Cd 含量的增加而升高。
菌包中重金属Cd 在黑木耳栽培过程中的含量变化见表4。
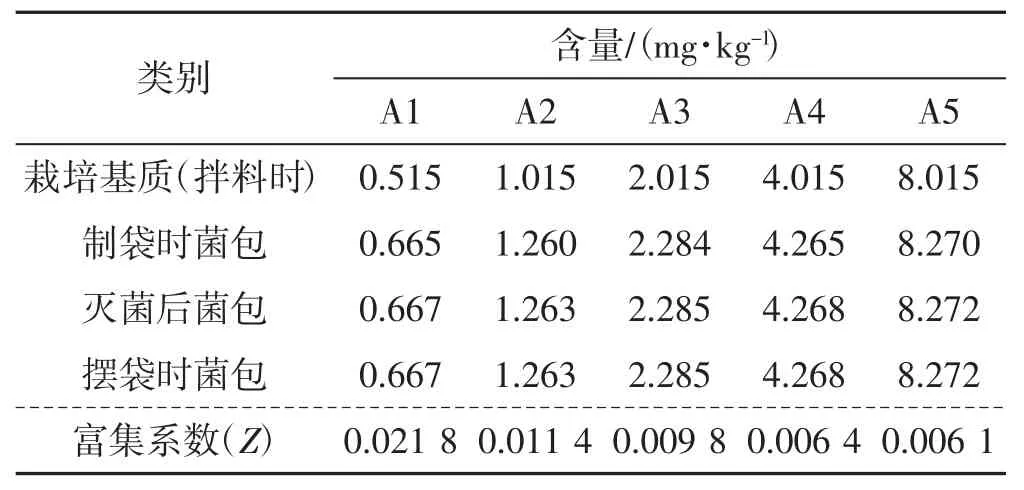
表4 Cd 转移试验结果Tab.4 Results of Cd transformation experiment
如表4 所示,拌料制袋菌包Cd 含量较栽培基质增加0.150~0.269 mg·kg-1,增幅3.18%~29.13%,各处理的增加量无显著差异,制袋后菌包中Cd 含量无明显变化。黑木耳对Cd 的富集系数随栽培基质Cd含量的增加逐渐减小。
以栽培基质中Cd 平均含量(x) 和黑木耳中Cd 平均含量(y) 之间的关系建立数学模型,该模型表达式为y=0.199+0.124x+0.034x2-0.004x3,该三次曲线模型R2=1.000,P=0.021,说明该模型能较好的体现黑木耳对栽培基质中Cd 的富集情况。以干木耳中Cd 限量值1.0 mg·kg-1为依据,利用回归方程预测栽培基质中Cd 元素含量的污染限值为4.084 mg·kg-1。
2.3.3 Hg 试验结果及数学模型
黑木耳中重金属Hg 元素的富集情况见表5。

表5 黑木耳子实体中Hg 含量Tab.5 The content of Hg in the fruit bodies of Auricularia auricula
如表5 所示,A1 组配方黑木耳Hg 含量为0.006~0.032 mg·kg-1,平均值为0.009 mg·kg-1;A2组配方黑木耳Hg 含量为0.010~0.125 mg·kg-1,平均值为0.027 mg·kg-1;A3 组配方黑木耳Hg 含量为0.042~0.103 mg·kg-1,平均值为0.051 mg·kg-1;A4 组配方黑木耳Hg 含量为0.155~0.186 mg·kg-1,平均值为0.168 mg·kg-1。4 组黑木耳Hg 含量和平均值均未超出限量值0.2 mg·kg-1,但部分近临界值。A5 组配方黑木耳Hg 含量为0.263~0.281 mg·kg-1,平均值为0.267 mg·kg-1,均超出限量值。5 个处理中第5 茬黑木耳Hg 含量最高,随着栽培基质中Hg 含量增加而升高。菌包中重金属Hg 在黑木耳栽培过程中的含量变化见表6。

表6 Hg 转移试验结果Tab.6 Results of Hg transformation experiment
如表6 所示,各处理制袋环节菌包中Hg 含量与栽培基质中的含量无显著差异,灭菌后菌包Hg 含量较栽培基质显著降低,分别下降87.5%、90.20%、88.12%、85.20%、87.16%。灭菌后各环节Hg 含量无显著变化。黑木耳对Hg 的富集系数随栽培基质中Hg 含量增加逐渐增大。
以栽培基质中Hg 平均含量(x) 和黑木耳中Hg平均含量(y) 之间的关系建立数学模型,该模型表达式为y=-0.027+0.267x-0.051x2,该二次曲线模型R2=0.985,P=0.015,说明该模型能较好地体现黑木耳对栽培基质中Hg 元素的富集情况。以干木耳中Hg 限量值0.2 mg·kg-1为依据,利用回归方程预测栽培基质中Hg 含量的污染限值为1.068 mg·kg-1。菌包在灭菌过程中Hg 损失量较大,灭菌后菌包中含量与栽培基质中含量差异显著,以灭菌后菌包中Hg 元素含量(x) 和黑木耳中Hg 元素含量(y) 之间的关系建立数学模型,该模型表达式为y=-0.012+1.596x-1.152x2,该二次曲线模型R2=0.996,P=0.004,说明该模型能较好地反映黑木耳Hg 含量与灭菌后菌包中Hg 含量的关系。以干木耳中Hg 限量值0.2 mg·kg-1为依据,利用回归方程预测灭菌后菌包中Hg 含量的污染限值为0.149 mg·kg-1。
2.3.4 Pb 试验结果及数学模型
黑木耳中重金属Pb 的富集情况见表7。
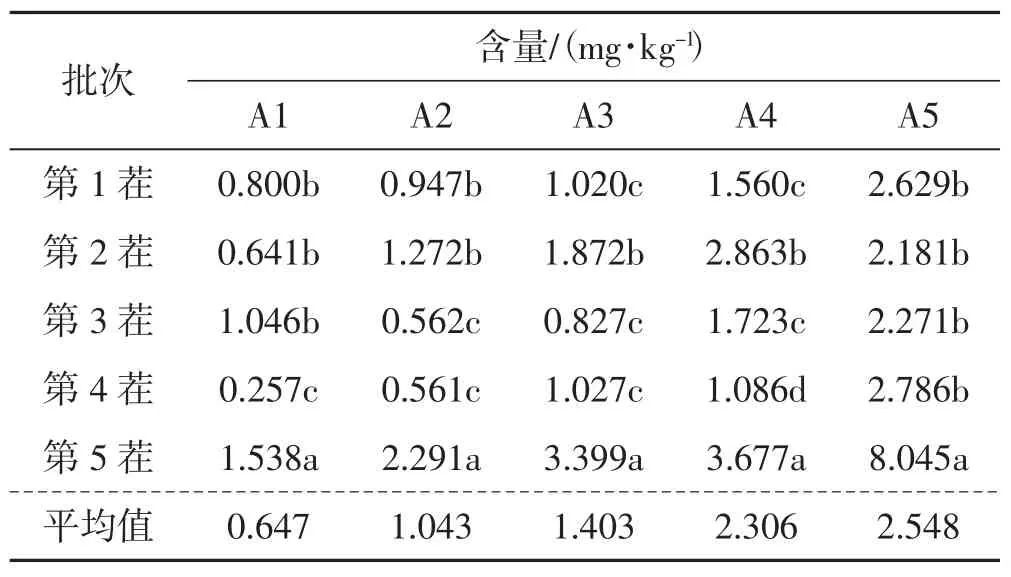
表7 黑木耳子实体中Pb 含量Tab.7 The content of Pb in the fruit bodies of Auricularia auricula
如表7 所示,A1 组配方黑木耳Pb 的含量为0.257~1.538 mg·kg-1,平均值为0.647 mg·kg-1,5 茬黑木耳Pb 含量均未超出限量值2.0 mg·kg-1。A2 组配方黑木耳Pb 的含量为0.561~2.291 mg·kg-1,平均值为1.043 mg·kg-1。A3 组配方中黑木耳Pb 的含量为0.827~3.399 mg·kg-1,平均值为1.403 mg·kg-1。A2、A3 组配方第5 茬黑木耳Pb 含量较高,均超出了限量值。A4 组配方黑木耳Pb 含量为1.086~3.677 mg·kg-1,平均值为2.306 mg·kg-1,有2 茬黑木耳Pb 含量超出限量值。A5 组配方的Pb 含量为2.181~8.045 mg·kg-1,平均值为2.548 mg·kg-1,5 茬黑木耳Pb 含量均超出限量值。5 组配方第5 茬黑木耳的Pb 含量显著高于其他批次,其含量随栽培基质中的含量增加而升高。
菌包中重金属Pb 元素在黑木耳栽培过程中的含量变化见表8。
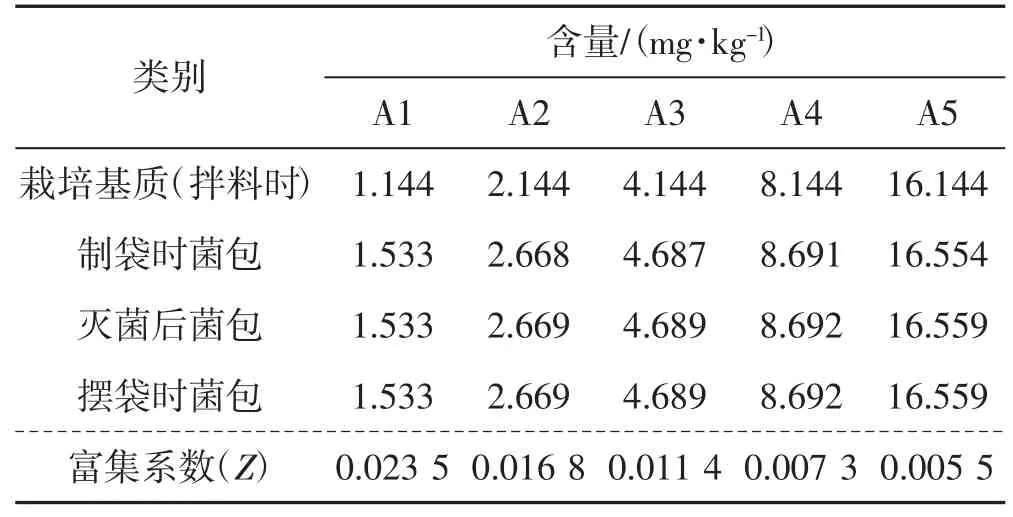
表8 Pb 转移试验结果Tab.8 Results of Pb transformation experiment
如表8 所示,拌料制袋后5 个处理的菌包Pb 元素含量较栽培基质增加0.389~0.547 mg·kg-1,增幅2.54%~34.00%,各处理间增加量无显著差异,灭菌后各处理Pb 含量无显著变化。黑木耳对Pb 元素的富集系数随着栽培基质中Pb 含量的增加逐渐减小。
以栽培基质中Pb 平均含量(x) 和黑木耳中Pb平均含量(y) 之间的关系建立数学模型,该模型表达式为y=0.282+0.347x-0.013x2,该二次曲线模型R2=0.993,P=0.007,说明该模型能较好地体现黑木耳对栽培基质中Pb 的富集情况。以干木耳中Pb 限量值2.0 mg·kg-1为依据,利用回归方程预测栽培基质中Pb 含量的污染限值为6.566 mg·kg-1。
3 讨论与结论
黑木耳栽培基质中As、Cd、Hg、Pb 元素本底值较低,子实体中的重金属含量随栽培基质中含量的增加而增加,末茬采收的黑木耳重金属含量最高。当栽培基质中元素含量处于低浓度时,黑木耳子实体对4 种重金属元素的富集作用排序为Pb>Cd>As>Hg。黑木耳对As、Cd、Pb 的富集系数随栽培基质中的含量增加而减小,对Hg 元素的富集系数随栽培基质中的含量增加而升高。拌料制袋、灭菌、接种至菌包摆袋环节与栽培基质比较,As 含量无明显变化;拌料制袋后菌包Pb、Cd 元素含量较栽培基质有所增加,灭菌后含量无显著变化。制袋环节Hg 元素含量与栽培基质含量无显著差异,灭菌后菌包的含量较栽培基质含量显著降低。以《绿色食品 食用菌》(NY/T 749-2018)[15]限量规定,预测黑木耳生产栽培基质中As、Cd、Hg、Pb 含量的污染限值分别为2.942、4.084、1.068、6.566 mg·kg-1。因此,在黑木耳生产中除了确保良好的生产环境,还应严格控制栽培基质中的重金属元素含量,才能确保黑木耳产品的质量安全。
试验中黑木耳各元素的富集系数采用子实体中元素总含量与栽培基质中元素总含量的比值进行计算,巫仁高等[12]的计算方法为子实体的元素测定值与培养料测定值的比值。试验根据黑木耳生产实际开展,测定了所有茬次黑木耳元素含量,同时考虑黑木耳采摘为“采大留小”,各茬次采收时子实体大小判断界限不清晰,每茬子实体中元素含量有所差异且末茬含量较高,因此认为本研究中元素富集系数的计算方法合理。
试验中黑木耳重金属元素的平均含量采用各茬次子实体中元素总含量与总质量的比值进行计算,同时将各处理5 个茬次采收的黑木耳混匀后测定其元素的平均含量,2 种方式获得的元素平均含量无显著差异。
黑木耳栽培基质中Hg 含量在灭菌阶段显著降低,与灭菌前相比下降85.20%~90.20%,说明121 ℃持续4 h 的高温灭菌,能够使Hg 大量挥发,减少黑木耳的富集。以灭菌后菌包中元素含量与黑木耳中元素含量建立数学模型,预测灭菌后菌包中Hg 元素含量的污染限值为0.149 mg·kg-1。生产中应在菌包灭菌后对其中Hg 含量进行测定评估污染风险,若测定值接近或高于污染限制,可采取回炉灭菌的方式处理。黑木耳菌包生产过程中,Pb、Cd 含量较栽培基质有所增加,说明机械拌料、制袋过程有增加Pb、Cd 的风险,生产中应予以重视。
As、Cd、Hg、Pb 四种元素的5 个混标处理A1、A2、A3、A4、A5 中,每袋平均产量(鲜质量) 分别为0.147、0.154、0.148、0.144、0.147 kg,CK 每袋平均黑木耳产量(鲜质量) 为0.146 kg,与对照无显著差异,各元素不同浓度处理中的产量无显著差异。在后续的工作中可重点围绕黑木耳生产过程中重金属元素的控制技术开展研究,以期为产业安全和消费安全提供技术支持。

