食(药)用菌内参基因筛选研究进展*
张晓华,孙达锋,,刘绍雄,,李建英,李雪松,岳万松,高章会,华 蓉**
(1.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650221;2.云南省食用菌产业发展研究院,云南 昆明 650221)
研究基因表达差异对于了解基因功能和调控机制具有重要作用[1]。随着组学技术的快速发展和日益完善,可通过研究同种食(药) 用菌不同菌株、同一菌株不同发育阶段或不同培养条件下的基因表达差异,筛选与生物学性状及表型差异相关的功能基因,最终帮助我们了解食(药) 用菌生长发育过程中相关基因的调控机制,以便为食(药) 用菌遗传育种工作的开展提供指导。目前基因表达量测定的方法有Northern 印迹法、微阵列法、基因表达连续分析法(SAGE)、实时荧光定量PCR (RT-qPCR)等[2]。其中RT-qPCR 由于具有操作简单、灵敏度高、特异性强、重复性好、分析结果准确等优势,已普遍用于基因表达分析[1]。
RT-qPCR 的结果易受RNA 质量、逆转录效率、引物特异性、转录物标准化等多种技术因素的影响。为消除这些因素带来的试验误差,通常需要引入合适的内参基因,以便对目的基因的表达量进行校正。QIAN 等[3]的研究结果显示,在用RT-qPCR 分析目标基因表达差异时,如果选用了不合适的内参基因,可能会得到不可靠甚至错误的结论。因此,合适的内参基因对定量分析结果的准确性尤其重要。内参基因通常是维持细胞基本功能的组成型表达基因,理论上,其表达水平在所有样品中应该是恒定的[4];但事实上并没有适用于所有物种的内参基因,同一物种在不同的发育阶段、不同菌株之间以及同一菌株在不同试验条件下,最适内参基因也不相同。例如关于草菇(Volvariella volvacea) 的研究表明,在寒冷和高温胁迫下,MSF1 基因表达较稳定;在Na-Cl 和CuSO4胁迫下,UBQ 基因表达最为稳定;而在酸胁迫中MAPK 基因的稳定性最好[3]。关于灵芝(Ganoderma lucidum) 的试验结果也显示,在短时间的茉莉酸甲酯、水杨酸和过氧化氢处理下,Actin 和UCE2 基因的稳定性较好;但在长时间的茉莉酸甲酯、水杨酸和过氧化氢处理下,这2 个基因的稳定性却最差[5]。因此,同一菌株使用相同的培养基,在不同的试验条件下最适内参基因也各不相同。此外,在黑木耳(Auricularia heimuer) 中进行了最适内参基因的研究,结果显示18S rRNA、β-TUB、EF1-α和28S rRNA 在不同菌株间表现出较好的稳定性,而APRTase、18S rRNA 和28S rRNA 适合作为研究不同发育阶段基因表达差异的内参基因[6]。以上研究表明,在使用RT-qPCR 开展食(药) 用菌基因表达分析前,根据不同的试验条件和物种选择合适的内参基因十分必要。
近年来,随着食(药) 用菌基因组和转录组数据在各大数据库的相继公布,越来越多的候选功能基因亟需进行基因表达差异分析,这使得RT-qPCR技术广受欢迎,各食(药) 用菌中能稳定表达的内参基因的筛选也受到了许多研究者的关注。食(药)用菌研究中常见的内参基因详见表1。
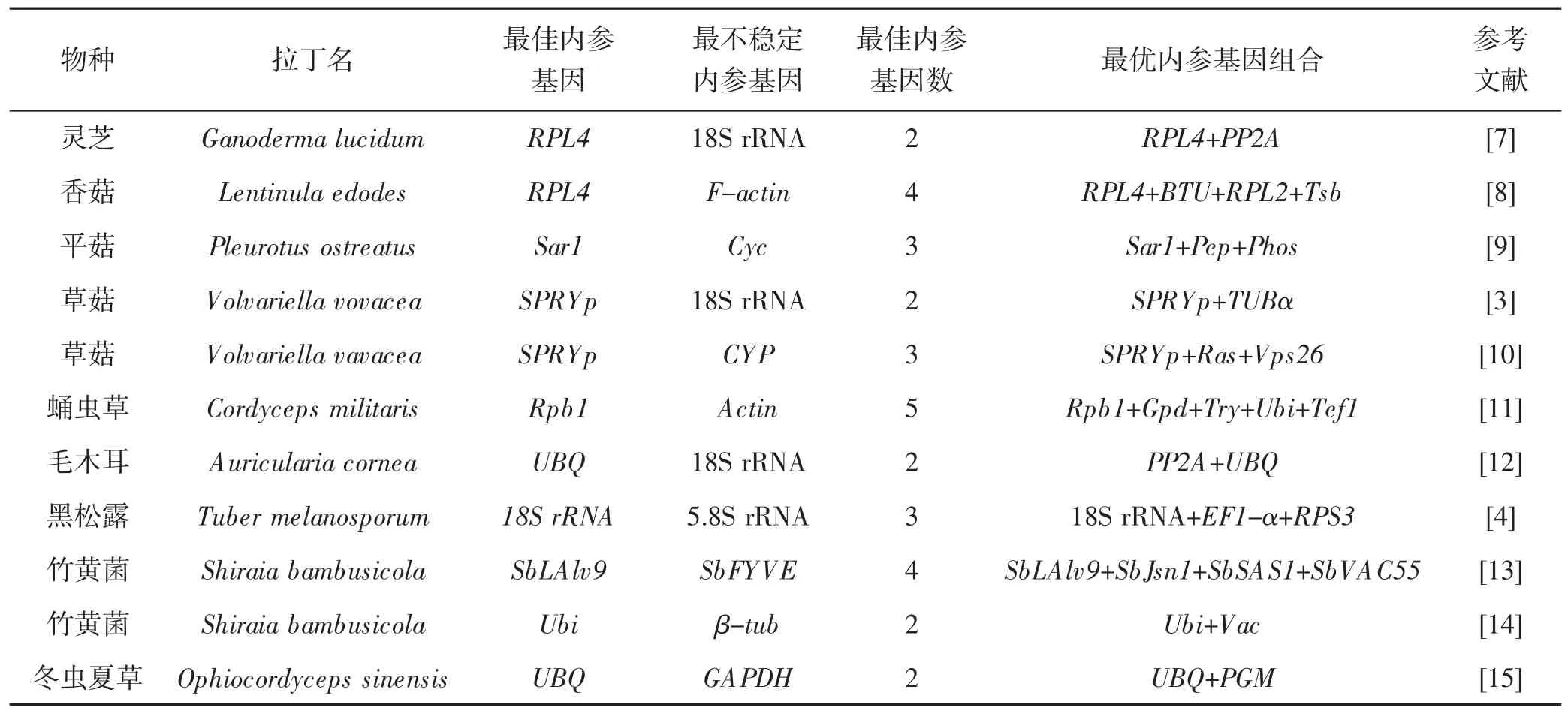
表1 食(药) 用菌中常见的内参基因Tab.1 The internal reference gene in common edible and medicinal fungi
如表1 所示,在这些研究中所用的内参基因大部分是从植物或动物中借鉴,大量证据表明在动植物中稳定表达的18S rRNA、Actin、GAPDH 等传统内参基因在食(药) 用菌中并不稳定[10]。比如在草菇[3]、灵芝[7,16]、毛木耳[12]等食(药) 用菌中18S rRNA 是最不稳定的内参基因,但在许多食(药) 用菌的内参基因筛选中还是将这些基因作为研究对象。
随着大部分食(药) 用菌转录组测序工作的逐步完成,许多稳定性较好的新内参基因被筛选,详见表2。

表2 基于转录组数据筛选的候选内参基因Tab.2 Screening candidate reference gene sets based on transcriptome data
如表2 所示,相比于从动植物研究中借鉴的传统内参基因,从转录组数据中筛选得到的候选内参基因的稳定性更高,更适合用于RT-qPCR 数据的校正和标准化。
目前食(药) 用菌内参基因筛选的试验方案与动植物的研究类似,首先是根据基因表达分析的试验设计收集样品,对样品进行RNA 提取和cDNA 的合成;其次是候选内参基因的选择及引物设计,然后进行RT-qPCR 试验;再使用geNorm、NormFinder、BestKeeper、RefFinder 等软件对试验结果进行评价,最终筛选出最合适的内参基因。
1 候选内参基因集的选择
植物内参基因的筛选已经有大量的报道,食(药) 用菌中相关的工作也在逐步开展[20-21]。随着灵芝[5]、平菇[17]、草菇[3]、蛹虫草[11]等的研究,表明在食(药) 用菌中通用的内参基因并不存在,都需要在基因表达分析前先进行内参基因的筛选。SONG 等[13]在竹黄菌内参基因筛选的研究中,选择了11 个在其他物种中常用的内参基因作为候选基因集,结果表明UBI、VAC 和TFC 3 个内参基因的稳定性较好。ZHANG 等[14]根据竹黄菌的转录组数据,以SONG 等确定的3 个稳定性好的内参基因(UBI、VAC 和TFC) 和9 个新基因组成候选内参基因集,对12 个候选内参基因开展了筛选工作,结果显示稳定性排名前7 的均是基于转录组数据筛选出的候选内参基因,而UBI、VAC 和TFC 的排名则相对靠后。竹黄菌内参基因的筛选结果说明,用于筛选的候选内参基因集不同,筛选到的最佳内参基因也不相同。这就提示我们,合适的候选内参基因集是内参基因筛选的重要前提,若候选内参基因集不合适,可能导致筛选到的内参基因并非最优,甚至需要额外使用更多的内参基因进行基因表达分析。以往在食(药)用菌最适内参基因的筛选研究中,候选内参基因集通常是选择在动物、植物中具有一定代表性的内参基因,遗憾的是这些内参基因在食(药) 用菌中的稳定性并不一致。对目前食(药) 用菌内参筛选工作中常见内参基因的研究次数和研究结果进行了梳理,统计结果详见图1、图2。

图1 研究次数较多的常见内参基因Fig.1 Common internal reference genes that have been studied more frequently

图2 使用频率较高的理想内参基因Fig.2 Ideal reference gene with higher frequency of use
如图1、图2 所示,ACT1、β-TUB、GAPDH、18S rRNA、UBQ、TUB-1a、EF1-α 在食(药) 用菌内参基因筛选中作为候选内参基因次数最多,同时也是被选择作为理想内参基因频率最高的常见内参基因。
目前,在草菇、平菇、羊肚菌等研究中已经成功将转录组数据运用到候选内参基因集的选择中[3,17-18]。在这些研究中,候选内参基因集通常由数个依据转录组数据得到的稳定性较高的新内参基因和几个传统的内参基因组成。在羊肚菌的研究中发现,虽然候选内参基因集中包含转录组数据筛选到的新内参基因,但传统内参基因Actin 表现出较好的稳定性[18]。ELENA 等[22]在平菇内参基因筛选时,选择了RAUL 等[17,23]在另外2 项研究中认为较为稳定的内参基因作为候选内参基因。这说明在选择候选内参基因时,若研究的物种已经开展过相关研究,可以将前人筛选出的稳定性较好的内参基因加入候选基因集中进行筛选验证。同时,若研究物种缺乏相关的转录组数据,也可以选择目前在食(药) 用菌中研究次数较多且稳定性相对较好的传统内参基因作为候选基因。综上所述,候选内参基因的选择最好是基于转录组数据进行分析及挖掘,同时可以根据研究物种和特定的试验条件引入部分传统的内参基因。
2 常用分析软件
目前常用的分析软件有geNorm、NormFinder 和BestKeeper。
geNorm 是在实时荧光定量PCR 中,用于内参基因筛选和最佳内参基因数目分析的软件。该软件对候选内参基因的数目和试验条件无任何限制,最终从候选内参基因集中挑选出至少2 个最优内参基因用于数据的校准,可使相对定量的结果更为准确[24]。RTqPCR 试验中得到的原始Ct 值要转换为相对定量数据才能输入到geNorm 软件中进行分析。首先找到每一个候选内参基因在所有样品中的最小Ct 值,然后用其他样品的Ct 值减去最低Ct 值,此时得到的值就是△Ct 值(该值≥0)。最后计算每个样品的2-△Ct值,将该值输入geNorm 软件,通过计算每个候选内参基因在不同样品中的平均变异值M (average pairwise variation),最终呈现出候选内参基因集稳定性排名的折线图和最佳内参基因数目,从而筛选出稳定性较好的内参基因组合[24]。判定标准为M 值小于1.5 即可作为内参基因,且M 值越低代表内参基因的稳定性越好;反之,则表明其稳定性较差[15]。有报道认为当M 值≤0.2 时,代表该候选内参基因具有较高的稳定性[9]。
NormFinder 也是用于候选内参基因稳定性筛选的软件,数据处理及判定标准和geNorm 相同。表达稳定值越小的内参基因稳定性越高,最终根据表达稳定值的大小单独显示出最稳定的内参基因。NormFinder 程序既可以比较候选内参基因的表达差异,同时也能计算样品组间的变异,但该程序最终只呈现一个最佳的内参基因[24]。
BestKeeper 是一款基于Excel 分析内参基因和靶基因表达量的分析工具。与geNorm 和NormFinder所不同的是,BestKeeper 是直接使用不同样本RTqPCR 试验中得到的原始Ct 值进行分析,根据Ct 值得到标准差(SD) 和变异系数(CV)。SD 值和CV值越小,则该内参基因的稳定性越好;若SD>1 则表明该内参基因不稳定,最好不用于基因表达量分析,据此对每个候选内参基因的表达稳定性进行评估[25]。
RefFinder 是一款集成了geNorm、NormFinde 和BestKeeper 3 个主要内参基因筛选软件的综合分析工具,根据每个软件对内参基因的排名,给每个候选内参基因的稳定性赋予一个适当的权重,并计算出权重的几何平均值,最终给出候选内参基因集的总排名[15]。以geNorm 软件进行分析,发现在黑木耳不同菌株间28S rRNA 表达最稳定,但以BestKeeper 和NormFinder 软件进行分析的结果却显示该基因表现一般,这种情况在香菇[8]、灵芝[7]等食(药) 用菌的研究中均存在。而在草菇[3]和竹黄菌[13]中的研究表明,使用geNorm 和NormFinder 分析内参基因稳定性时往往能得出相同的结论,但BestKeeper 软件的分析结果则与这2 个软件有一定的出入,在植物内参基因筛选研究中也出现过类似的现象[26-27]。这可能是因为BestKeeper 依赖于候选参考基因的标准差来评估其稳定性,而geNorm 和NormFinder 则根据基因的累积标准差和成对稳定性来评估内参基因。由于每种软件的算法不同,使用不同的软件进行分析时内参基因的稳定性排名会有细微差异,因此有必要先使用多种分析软件对RT-qPCR 结果进行分析,再通过RefFinder 软件对分析结果进行综合排名,最终筛选出最佳的内参基因[3,14]。
3 最佳内参基因的确定
在确定内参基因时,首先需要使用geNorm 软件,根据平均成对变异值(V) 的比值确定最佳内参基因的数量,当Vn/Vn+1值<0.15 时,表明最佳内参基因的数量是n 个,当Vn/Vn+1值>0.15 时,则表明最佳内参基因的数量是n+1 个[24]。在草菇的研究中指出Vn/Vn+1的比值不应该是严格的0.15,经geNorm软件分析显示最佳内参基因的数量是2,研究者分别选择了SPRYp+UBQ (稳定性排名前二)、SPRYp+UBQ+TUBα (稳定性排名前三) 和SPRYp+UBQ+TUBα+28S rRNA (稳定性排名前三的基因加最不稳定的28S rRNA 基因) 作为内参基因,对G6PDH 基因的表达量进行了分析,结果表明只要按照geNorm软件分析出的最佳内参基因数量选择内参基因,即使额外的内参基因的稳定性较差也不会影响目标基因表达量的分析结果[3]。在其他研究中也提出使用2个最优的内参基因组合对RT-qPCR 的结果进行校正和标准化是可靠的,但使用geNorm 软件可能会给出1 个较为客观的最佳内参基因数量,使基因表达分析的结果更加精确。此外,许多食(药) 用菌的研究结果表明,仅使用1 个内参基因对靶基因的表达量进行分析是不够的,需要根据候选内参基因的排名情况,结合软件推荐的最佳内参基因数量,选择2 个及以上的内参基因对RT-qPCR 结果进行校正,以保证分析结果的可靠性。
4 内参基因的验证
挑选出特定试验条件下某物种中稳定表达的内参基因,可以对靶基因的RT-qPCR 试验数据进行校正。在毛木耳内参基因筛选的试验中,为了进一步验证筛选结果,研究人员分别以软件分析得出的最佳基因组合(PP2A+UBQ) 和稳定性最差的基因18S rRNA 为内参基因,对靶基因LAC 的相对表达量进行了分析验证,结果显示使用稳定性不同的内参基因对靶基因进行差异分析时,其结果差异显著[12]。在香菇[8]、草菇[3]、平菇[9]、灵芝[5]、杏鲍菇(Pleurotus eryngii)[28]、金针菇(Flammulina velutipes)[29]等研究中也出现了类似的现象。通过对不同的归一化策略进行测试,证明使用未验证的内参基因对RTqPCR 数据进行归一化,可能会得到不准确的结论,从而对基因表达背后的生物现象造成误解。因此,在特定的试验条件下,筛选出稳定的内参基因是获得可信的基因表达数据的前提。
5 建议
由于RT-qPCR 技术在基因表达分析中的诸多优点,目前已成为许多研究者开展食(药) 用菌基因表达分析的主要技术。其中,根据试验目的筛选出在特定条件下稳定表达的内参基因尤为重要。通过对食(药) 用菌内参基因筛选研究进展进行整理,总结出以下几点建议。
1) 建议根据所研究物种的转录组或表达谱数据来选择候选内参基因,以便能粗略估计候选内参基因的表达量和稳定性。
2) 若所研究的物种已经有筛选内参基因的相关报道,可将报道中稳定性较好的内参基因作为候选基因,但不建议直接作为内参基因用于RT-qPCR数据分析,仍然需要根据即将开展的试验对候选基因进行筛选和验证。
3) 若缺乏转录组数据,也可选择目前在食(药) 用菌中研究次数较多且稳定性相对较好的传统内参基因作为开展内参筛选研究的候选基因。
4) 建议选择多种算法对候选基因进行分析排名。真正稳定性好的基因在所有算法中均趋于稳定,而稳定性较差的基因在不同软件中的排名会有很大波动。
5) 使用geNorm 软件分析可以确定最佳内参基因的数量,进而使用多个合适的内参基因对RTqPCR 的数据进行归一化,从而保证靶基因表达分析的结果更加可靠。
6) 在即将开展的试验条件下,对候选内参基因进行验证分析,才能获得准确的试验结果,最终揭示基因差异表达背后所代表的生物学意义。

