钙离子协同溶氧提高重组β-CGT 酶的可溶性表达量
周媛媛, 李兆丰,2, 顾正彪,2, 班宵逢,2, 洪 雁,2, 程 力,2, 李才明*,2
(1. 江南大学食品学院, 江苏无锡 214122;2. 江南大学食品科学与资源挖掘全国重点实验室, 江苏无锡 214122)
环糊精葡萄糖基转移酶(Cyclodextrin glycosyltransferase, 简称CGT 酶,EC 2.4.1.19) 是从细菌细胞中得到的一类胞外酶,它是α-淀粉酶大家族的关键成员[1-3]。 CGT 酶共有A~E 5 个结构域,能够催化4 种不同类型的反应,分别为水解、歧化、环化和偶合反应,具有极大的应用价值[4-5],近年来,随着环糊精在食品、医药、化工、农业以及化妆品等领域的广泛应用,CGT 酶成为研究的热点[6]。 目前已经发现多种能够天然生产CGT 酶的菌种, 大多数为细菌, 包括Paenibacillus macerans[7]、Bacillus stearothermophilus[8]、B. megaterium[9]等。
大部分来源的CGT 酶的热稳定性相对较低,而来源于B. xiaoxiensisSTB08 的CGT 酶的热稳定性较高(60 ℃下的半衰期为12.5 min)。 工业上生产环糊精所使用的CGT 酶主要来自天然芽孢杆菌,少量为基因工程菌[10-11],相比野生菌在培养过程中容易感染杂菌、发生回复突变、发酵上清液中酶活单位低等特点,重组菌培养方式简便,上清液中酶活单位高,目的蛋白质所占比较大,都使得在发酵过程中制备CGT 酶的成本进一步降低。 但CGT 酶在发酵过程中, 经常会遇到外源蛋白质形成包涵体、胞外表达量难以提高等问题,限制了CGT 酶的大规模生产以及在工业中的应用[12]。 因此,有必要提高CGT 酶的胞外表达量。
在合适的宿主中外源表达cgt基因被认为是目前提高CGT 酶产量的主要且有效的手段。大肠杆菌是实验室研究和工业生产首选的表达系统,因此使用大肠杆菌系统来表达重组蛋白质成为一种快速简单的方法。 如Li 等利用大肠杆菌系统表达P.macerans的CGT 酶, 诱导90 h 时CGT 酶活力可达22.5 U/mL[13]。 但目前胞外表达量还是较低,且对发酵条件(如溶氧、钙离子)影响大肠杆菌产酶的机理研究较少,同时有关溶氧以及钙离子对大肠杆菌产酶的协同作用未见报道。 因此,有必要系统研究溶氧及钙离子对大肠杆菌发酵产酶的影响。
作者将来源于B. xiaoxiensisSTB08 的β-CGT基因插入质粒pET-20b(+)中,在宿主菌E. coliBL21 中进行分泌表达, 对能够显著影响β-CGT 酶发酵生产的发酵条件(溶氧、钙离子)的影响机理进行了分析。
1 材料与方法
1.1 材料与试剂
菌种与质粒:小溪芽孢杆菌B.xiaoxiensisSTB08、质粒pET-20b(+)、表达宿主E. coliBL21(DE3)均由作者所在实验室传代并保藏。
1.2 主要仪器
Applied Biosystems Pro Flex PCR 仪: 美国Thermo Fisher Scientific 公司产品;Mini Protein3 蛋白质电泳系统:美国Bio-Rad 公司产品;T-6V 可见分光光度计: 南京菲勒仪器有限公司产品;FACS Aria II 流式细胞分选仪:美国碧迪公司产品。
1.3 培养基
LB 液体培养基组分(g/L):酵母粉5,胰蛋白胨10,NaCl 10;LB 固体培养基为在LB 液体培养基中再添加1.5 g/dL 的琼脂粉。
发酵培养基(组分g/L):玉米浆膏24,大豆蛋白胨6, 葡萄糖2, 麦芽糖4,KH2PO42.32,K2HPO4·3H2O 16.43。
1.4 实验方法
1.4.1 重组β-CGT 酶的生产种子培养:将保存在超低温冰箱中的甘油管菌株解冻,混合均匀后使用移液枪吸取100 μL 至LB 液体培养基中, 然后在37 ℃发酵摇床中培养10~12 h。发酵培养:将得到的种子液使用移液枪吸取2 mL 至发酵培养基中,然后在30 ℃发酵摇床中培养96 h 得到重组β-CGT酶液。
1.4.2 β-CGT 酶环化活力的测定β-CGT 酶环化活力的测定参照李才明的方法[14]。
1.4.3 菌体浓度的测定通过光密度(Optical density)的大小来反映菌体数量,用OD600nm表示。
1.4.4 重组CGT 酶的亚细胞定位重组CGT 酶的定位参照李兆丰的方法[15]。 胞外CGT 酶:发酵结束后发酵液于4 ℃、10 000 r/min 离心20 min,上清液即为胞外β-CGT 酶;不溶性包涵体:在分离出周质空间与胞内CGT 酶的细胞碎片中加入1 g/dL SDSPAGE 上样缓冲液,并在沸水浴中煮沸10 min,离心后的上清液即为不溶性包涵体。
1.4.5 细胞透性分析重组大肠杆菌细胞透性的测定参照李兆丰的方法[15]。 即发酵结束后的发酵液于4 ℃、10 000 r/min 离心20 min, 收集菌体,用PBS 洗涤2 遍, 稀释至一定浓度后加入10 mmol/L NPN,用荧光分光光度计测定荧光值,测定参数为:缝宽1 nm、激发波长350 nm、发射波长420 nm。
富水软弱地层中交叉、重叠隧道盾构区间施工关键技术……………………………………………………… 杨义(10-213)
1.4.6 流式细胞仪(FCM)分析对于FCM 分析,参照文献[16]使用碘化丙啶(PI)以及羧基二乙酰荧光素(cFDA)双染的方法对细菌细胞进行染色,略有改动。 首先将不同条件下的细胞于42 ℃水浴中用cFDA 避光染色30 min,接着用PI 进行染色,染色的细菌需在1 h 内进行FCM 分析。
1.4.7 数据处理使用Prism graphpad 8.0 软件作图,使用SPSS 26.0 中的单因素方差分析(ANOVA)对数据进行显著性分析(P<0.05),流式细胞数据使用Flowjo 10 软件分析作图。
2 结果与分析
2.1 重组大肠杆菌BL21/ pET20b(+)-cgt 的构建与表达
将来源于B. xiaoxiensisSTB08 的cgt基因插入质粒pET-20b(+)中,在宿主菌E. coliBL21 中成功分泌表达, 得到基因工程菌E. coliBL21(DE3)/pET20b(+)-cgt,进行摇瓶发酵培养得到粗酶液。
2.2 重组β-CGT 酶的摇瓶发酵条件优化
在TB 培养基的基础上, 经过对温度、 发酵时间、pH、碳源、氮源等进行优化后,最终以玉米浆膏24 g/L、大豆蛋白胨6 g/L、葡萄糖2 g/L、麦芽糖4 g/L,KH2PO42.32 g/L、K2HPO4·3H2O 16.43 g/L 作为最优发酵培养基,在30 ℃,pH 7.0 条件下发酵96 h 后胞外酶活达到34.66 U/mL, 接着对能够显著影响β-CGT 酶发酵生产的发酵条件(溶氧、钙离子)进一步优化,并对其影响机理进行分析。
2.2.1 溶氧对重组β-CGT 酶摇瓶发酵的影响在摇瓶发酵阶段,溶氧的改变主要是通过控制摇瓶中的装液量变化。 基于摇瓶发酵培养基优化结果,选取不同的装液量 (30、50、70、100、120、150 mL),接种体积分数为4%, 每隔12 h 取样测定菌体浓度OD600以及重组大肠杆菌的胞外酶活力,并对发酵结束后的胞外β-CGT 酶以及不溶性包涵体进行SDSPAGE 分析,探究不同的溶氧对重组β-CGT 酶摇瓶发酵的影响。
如图1 所示,当装液量较少(30、50 mL)即发酵液中的溶氧含量较高时, 由于其传氧系数较高,重组大肠杆菌迅速生长,菌体浓度增长很快,其OD600最高,但在此条件下重组大肠杆菌的产酶水平却是最低的,推测可能是由于重组大肠杆菌的生长速度过快导致其形成了较多的不溶性包涵体,同时菌体生长速度过快也会导致代谢物的大量积累,影响发酵体系的pH 以及酶的稳定性等从而抑制菌体产酶,并且由于装液量较少,在发酵过程中也会增加发酵液的挥发,发酵过程中发酵液体积减少过多不利于菌体进行产物合成;装液量过多(150 mL)会使发酵液中的溶氧含量过低,无法满足菌体正常生长及代谢的需要,在此条件下菌体浓度过低,同时重组大肠杆菌的产酶水平也较低; 而当装液量为70、100、120 mL 时,重组大肠杆菌的菌体浓度OD600处于较为适宜的水平,对应的产酶水平也较高,因此在能够维持重组大肠杆菌正常生长的情况下,尽可能避免其菌体快速生长是提高产酶水平的关键。 同样,邹纯等发现在短小芽孢杆菌发酵中,尽可能避免其快速生长是提高产酶的关键[17]。 综合考虑重组大肠杆菌的生长繁殖以及产酶情况,选取菌体浓度适当且产酶水平较高的装液量100 mL 作为最优装液量,发酵96 h 后其胞外酶活达到66.86 U/mL。

图1 溶氧对重组大肠杆菌生长和产β-CGT 酶的影响Fig. 1 Effects of dissolved oxygen on the growth and β-CGTase production of recombinant E. coli
对重组大肠杆菌的包涵体以及发酵结束的粗酶液进行SDS-PAGE 分析,如图2 所示,分泌至胞外的酶量较多, 这可能是由于在不同的溶氧条件下,细胞外膜透性较大。 随着发酵液中的溶氧增大,重组大肠杆菌形成的不溶性包涵体越多。 这是由于在较高的溶氧条件下,发酵前期重组大肠杆菌菌体浓度迅速增加,合成了较多的目标蛋白质,同时,转录、翻译以及折叠蛋白质的速度过快,导致大量目标蛋白质无法正确折叠而形成包涵体[18],而包涵体的大量存在会严重堵塞内膜转运通道,因此选择适宜的装液量(100 mL)对其生长及产酶至关重要。 同时可以看出, 在最优装液量条件下胞外酶条带最粗,说明在此条件下重组大肠杆菌分泌到胞外的酶量最多,这与酶活测定结果一致。
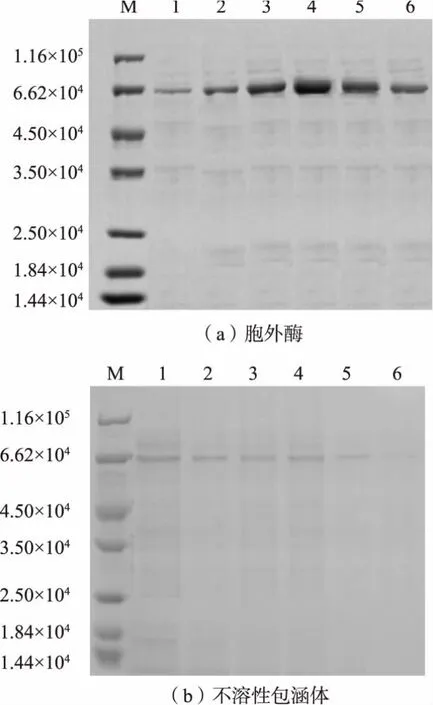
图2 不同溶氧下胞外酶和不溶性包涵体的SDS-PAGE 分析Fig. 2 SDS-PAGE analysis of extracellular enzyme and insoluble inclusion bodies under different dissolved oxygen levels
由上述结果可知,溶氧对于重组大肠杆菌的细胞影响较显著, 故进一步利用流式细胞术(Flow cytometry,FCM)对在不同溶氧条件下发酵结束的重组大肠杆菌菌体进行分析。 cFDA(羧基二乙酸荧光素)是二乙酸荧光素的一种衍生物,当细胞膜完整时,其水解的荧光素就会逐渐在细胞内积累,常被用作细胞活性的标签,而PI(碘化丙啶)无法透过完好的细胞膜进入细胞, 只有当细胞死亡或凋亡后,它才能够进入细胞[19],作者采用cFDA-PI 双重荧光染色法来表征溶氧对重组大肠杆菌细胞的影响。 如图3 所示,左上区域(Q1)表示PI 标记的死细胞,Q2区为PI 与cFDA 同时标记的已受损但仍然存活的细胞,Q3 区为cFDA 标记的活体细胞,Q4 区为细胞碎片。
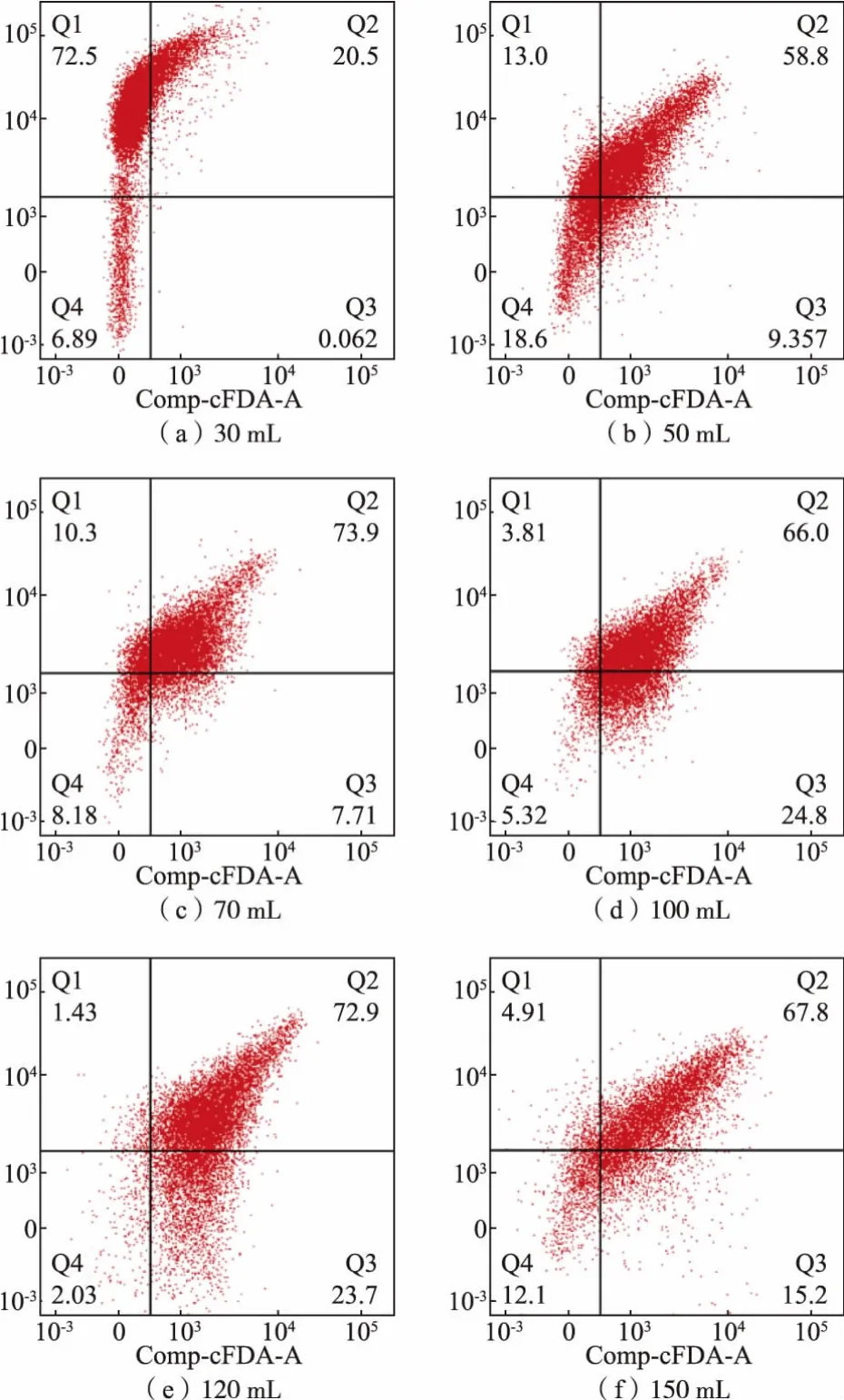
图3 不同溶氧下重组大肠杆菌的FCM 分析Fig. 3 FCM analysis of recombinant E. coli under different dissolved oxygen levels
当发酵液中的溶氧量过高时(装液量30 mL),虽然菌体浓度高,即菌体数量较多,但Q1 区的细胞数目为72.5%,说明过高的溶氧会导致细胞严重受损,使细胞失去维持细胞稳态和代谢物的功能,导致大部分细菌机械性坏死;当发酵液中的溶氧量有所降低时 (50~120 mL),Q3 区即活细胞数目显著增加,同时Q2 区的细胞数目也显著增加, 这说明适当降低溶氧能够使得细胞活性增大。 在最优溶氧条件下(即装液量为100 mL),Q3 区的活细胞数目最多,即能够用来分泌产酶的活细胞数目最多,故而其产酶情况最好;而当溶氧过低(装液量为150 mL)时,不足以满足细菌正常生长的需求,故选取最适宜的溶氧对于细胞活性以及生长产酶的影响至关重要。
2.2.2 金属离子对重组β-CGT 酶摇瓶发酵的影响发酵过程中的金属离子主要由各种无机盐提供,无机盐类所提供的金属离子对于细胞生长以及产物合成有着重要的影响,能够影响细胞物质的组成以及能量代谢,同时,金属离子作为酶的辅基,还可以作为一些关键酶的辅助因子。 作者在发酵培养基(50 mL) 中分别添加终浓度为5 mmol/L 的Ca2+、Ba2+、Fe3+、Mg2+、K+、Cu2+,以不添加金属离子的培养基作为对照,探究各种金属离子对重组大肠杆菌产酶的影响。如图4 所示,添加Ca2+以及Mg2+对于重组大肠杆菌产酶有促进作用,同样,李才明等发现添加Ca2+能明显激活酶的活力[20],与本研究结果一致。 随着发酵时间的延长,发酵液的pH 随之增大,不利于重组大肠杆菌生长及产酶,而Ca2+能沉淀磷酸盐,并且可以与磷酸盐和蛋白质相互作用提供相对较低的pH 环境, 因此有利于其产酶,Ca2+的添加还具有其他的作用, 如Ca2+的渗透调节作用使得一些营养物质易于进入细胞内部[21],同时推测其能够增大细胞膜的通透性。 由于添加Ca2+对于促进重组大肠杆菌胞外产酶作用最为显著,故最终在发酵培养基中添加一定终浓度的Ca2+以提高酶活, 进一步对其浓度进行优化, 发现在发酵培养基中添加终浓度为25 mmol/L 的Ca2+,胞外酶活达到最高。
为了探究钙离子是否能够增大重组大肠杆菌细胞的通透性,对添加钙离子以及对照组的细胞外膜的透性测定分析,并对发酵结束后的包涵体进行SDS-PAGE 分析。 如图5 所示,荧光值的大小(荧光相对强度) 可以用来评价E. coli细胞外膜透性大小,添加一定浓度的钙离子后,重组大肠杆菌的细胞外膜透性显著增大,说明添加一定浓度的钙离子可以增大其细胞外膜的透性,故重组β-CGT 酶更容易穿过细胞外膜分泌到胞外。 如图6 所示,添加钙离子相比于不添加钙离子,重组大肠杆菌形成的不溶性包涵体较少,说明钙离子有利于重组大肠杆菌减少包涵体的形成。 综上,其分泌到胞外的可溶性酶较多。

图6 不添加钙离子及添加钙离子时的不溶性包涵体的SDS-PAGE 分析Fig. 6 SDS-PAGE analysis of insoluble inclusion bodies without and with Ca2+addition
2.2.3 钙离子协同溶氧对重组β-CGT 酶摇瓶发酵的影响摇瓶优化发酵结果说明溶氧以及Ca2+的添加均对重组大肠杆菌胞外产酶均具有显著影响,故进一步优化添加Ca2+条件下的溶氧水平, 分别于30、50、70、100、120、150 mL 发酵液中添加终浓度为25 mmol/L 的Ca2+,如图7 所示,在装液量为30 mL时,添加终浓度为25 mmol/L 的Ca2+酶活最高,发酵96 h 后酶活为105.69 U/mL。 观察其生长曲线可知,在30 mL 发酵液中添加Ca2+其菌体浓度远高于其他组,而其对应的胞外产酶量也是最高的。 这是因为在保证菌体生长浓度较高的同时,Ca2+增加细胞的通透性同时保护细胞,并促使细胞及时将CGT 酶分泌至胞外,故推测Ca2+以及溶氧对于重组β-CGT 酶的摇瓶发酵具有协同促进作用。
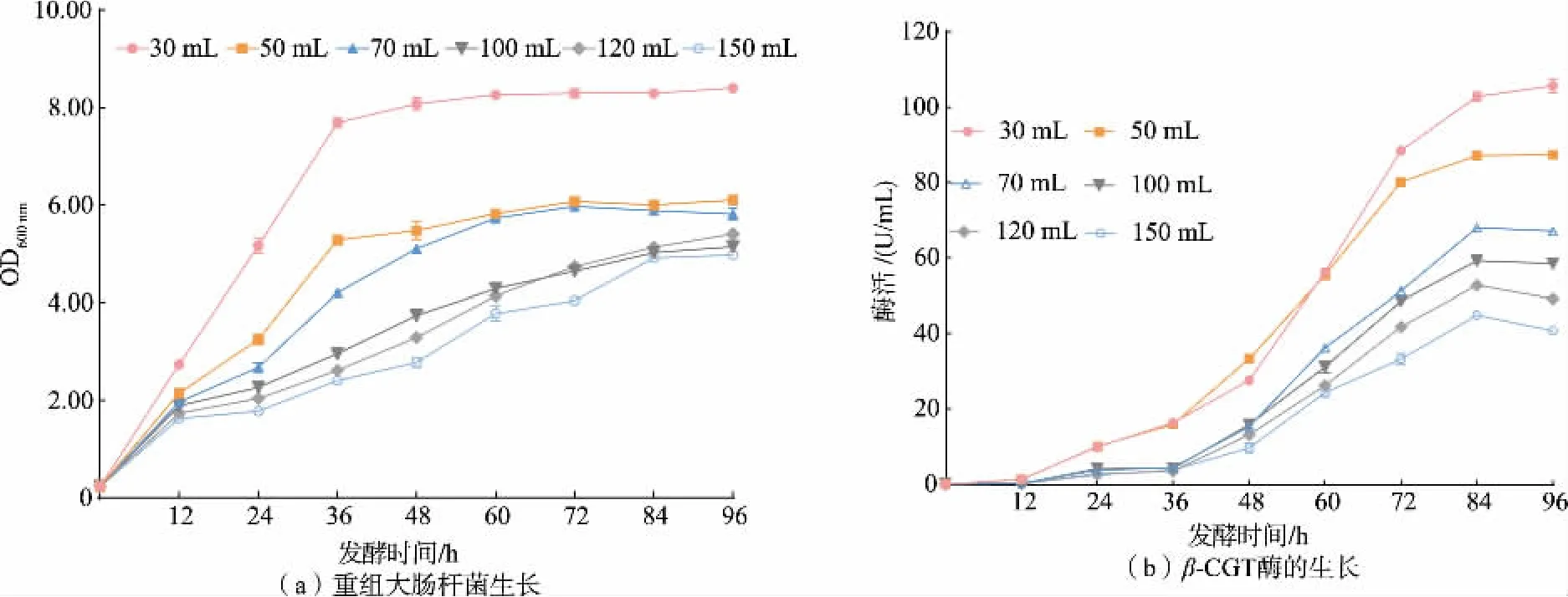
图7 钙离子协同溶氧对重组大肠杆菌生长和产β-CGT 酶的影响Fig. 7 Effects of Ca2+coordinated dissolved oxygen on the growth and β-CGTase production of recombinant E. coli
有文献报道钙离子对于细菌细胞有强大的保护作用[22],为了验证Ca2+对于重组大肠杆菌细胞是否具有保护作用,作者采用流式细胞术并用cFDAPI 双重荧光染色法来探究Ca2+对重组大肠杆菌细胞的影响。 如图8 所示,在溶氧较高(30 mL)发酵液中添加Ca2+后可以看出活细胞数目显著增加。 当发酵液中的溶氧较高时, 细菌生长较快且OD600较高,但同时菌体生长过快,代谢物积累就会过多,导致其细胞损伤较大,坏死细胞较多,而添加Ca2+后,发现Q1 区的机械性坏死细胞数目显著较少,同时Q3区的活细胞数目显著增多, 故可以确定Ca2+对于细胞有一定的保护作用。
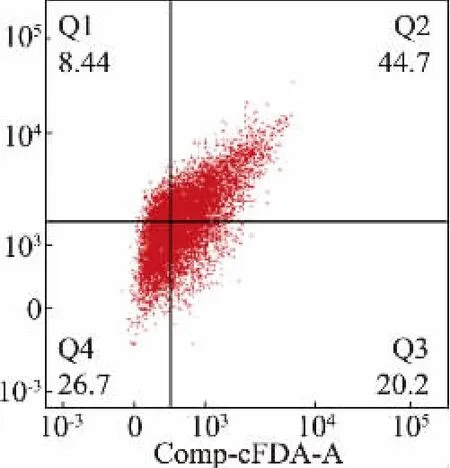
图8 钙离子协同溶氧对重组大肠杆菌影响的FCM 分析Fig. 8 FCM analysis of the effect of Ca2+coordinated dissolved oxygen on recombinant E. coli
3 结 语
实现了来源于B. xiaoxiensisSTB08 的β-CGT基因在大肠杆菌中的克隆与表达, 发现溶氧以及Ca2+对于重组大肠杆菌发酵产酶具有协同作用,即在较高的溶氧条件下添加Ca2+, 重组大肠杆菌的胞外酶活水平达到最高。 机理分析表明,较高的溶氧能够保证菌体较高的生长浓度,但在此条件下机械性坏死的细胞过多, 而Ca2+的添加很好地保护了细胞,使得活细胞数目增加,同时Ca2+的添加减少了包涵体的形成,并使得细胞的通透性增大,促使细胞及时将CGT 酶分泌至胞外。可为相关酶的发酵优化提供新的参考。

