蒺藜皂苷对小鼠急性酒精性肝损伤的保护作用研究
王琢文,黄 婷,吴宇陪,王洁琼,杨洪飞,葛婷婷,要 辉,2,张雨晨,2,闵 清,3*,白育庭
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.湖北科技学院医学部临床医学院;3.鄂南特色中药湖北省工程研究中心)
近些年来,人们的生活水平日益提高,酒精的摄入愈发增多,导致罹患酒精性肝病的患者数量逐年递增[1]。酒精性肝病(alcoholic liver disease,ALD)是长期大量饮酒引发的一种肝脏疾病,造成每年超过330万人死亡,占全球疾病负担的5.1%[2]。目前评价酒精性肝病的基础生化指标只有在肝脏损伤达到一定程度时才会出现变化,并不能反映肝损伤早期症状[3]。因此,找到准确、简便的新的评价方法对于防治酒精性肝病尤为重要。有研究表明[4-5],ALD患者及动物模型的脂质、氨基酸等代谢物水平会发生变化,而利用代谢组学方法,通过监测生物体内代谢物的改变,可研究代谢物在机体疾病加重或环境变化等因素刺激下所产生的变化及其规律。同时,代谢组学可用于评价疾病的发展程度及药物的治疗效果,特别适合于探究药物对于机体的保护作用[6]。
蒺藜(TribulusterrestrisL.)为蒺藜科蒺藜属植物的干燥果实[7],主要含有皂苷、黄酮、生物碱等化合物[8],其中蒺藜皂苷(gross saponin tribulus terrestris,GSTT)是最主要的生物活性成分。相关研究表明[9-10],GSTT具有改善肝功能、保护血管、增强运动功能、延缓衰老、降低血脂等药理活性。
本研究采用代谢组学技术,探究GSTT对小鼠肝脏保护作用的可能机制及物质基础,为GSTT的应用开发和更合理、安全的应用于临床提供理论支持。
1 材料与方法
1.1 动物
雄性封闭群Institute of Cancer Research(ICR)小鼠60只,体重(20±2)g,由湖南斯莱克景达实验动物有限公司提供(合格证号SCXK湘2019-0004),在温度(25±2)℃,湿度(50±5)%,12h光照和避光交替循环条件下饲养,自由摄食摄水。
1.2 药物与试剂
GSTT(西安拓丰生物科技有限公司,批号:TF-20220119);56度牛栏山二锅头(北京顺鑫农业股份有限公司牛栏山酒厂);分析级重水(D2O);核磁内标TSP(Sodium Trimethylsilylpropionate)(青岛腾龙微波有限公司,批号:I-17273);谷草转氨酶、谷丙转氨酶、谷胱甘肽过氧化物酶、丙二醛、超氧化物歧化酶试剂盒(均购置于武汉伊莱瑞特生物科技股份有限公司,批号分别为E-BC-K236-M、E-BC-K235-M、E-BC-K800-M、E-BC-K025-M、E-BC-K700-M)。
1.3 仪器
Bruker AVANCE Ⅲ 500MHz核磁共振仪(Bruker Biospin,Germany),TGL-20M高速冷冻离心机(湖南湘仪有限公司),SPARK酶标仪(TECAN公司),纯水机(武汉品冠仪器设备有限公司)。
1.4 方法
1.4.1 动物分组及给药
小鼠适应性饲养7d后,随机将ICR小鼠分为5组,每组12只,空白对照组(Control组)、模型组(Model组)、阳性药物组(Glu组,还原型谷胱甘肽55mg/kg)、蒺藜皂苷低剂量组(Tribuli Low,200mg/kg)、蒺藜皂苷高剂量组(Tribuli High,400mg/kg),各组根据体重灌服相应剂量药物7d。
1.4.2 模型制备及取材
末次给药0.5h后,灌胃12mL/kg的56度牛栏山二锅头,建立急性酒精性肝损伤模型,12h后取材,血清样品处理后暂存于-80℃超低温冰箱。通过肝脏湿重(g)/小鼠体重(g)×100%,来计算肝脏系数。每组随机选择4只小鼠肝脏固定于多聚甲醛中,其余小鼠肝脏保存在-80℃超低温冰箱中待测。
1.4.3 组织病理学切片
取小鼠肝组织,用4%缓冲多聚甲醛固定24h,经脱水、透明后进行石蜡包埋、制成4μm连续切片,固定于载玻片上,行常规HE染色,光学显微镜下观察各组小鼠肝组织结构的病理变化。
1.4.4 生化指标检测
通过试剂盒测定血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、丙二醛(MDA)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)含量。
1.4.51H-NMR测试
使用Bruker AVANCE Ⅲ 500MHz核磁共振仪获取肝脏组织样品的1H-NMR光谱数据。将对应于0.5Hz线宽的指数加权函数乘以FID后,对频谱进行“傅立叶变换”。
在Bruker TopSpin software 3.0(Bruker Co.,Ltd.,Karlsruhe,Germany)上对所有得到的1H-NMR数据的基线和相位进行调整,将处理好的1H-NMR数据导出为ASCII文件,然后将其导入到“R”软件中进行后续多元数据分析,除去残余水峰及其影响邻近区域的信号(4.83~5.30ppm),按照0.015ppm的分段积分间距对数据进行处理。肝脏在0.00~0.48ppm和5.30~9.70ppm范围内的分段光谱以平均值为中心,每个光谱的积分值采用Par(Mean-centered and Paretoscaling)标准化方法和PQN(Probability Quotient Normaliza-tion)归一法方法抵消样品的浓度差,对归一化处理后的NMR数据进行进一步分析,采用主成分分析法(PCA)、偏最小二乘分析法(PLS-DA)以及正交偏最小二乘判别分析法(OPLS-DA)进行分析,分析结果通过得分图进行展示。
1.5 统计学方法
2 结 果
2.1 GSTT对小鼠体重和肝脏系数的影响
小鼠体重的变化结果如表1所示,每组小鼠的平均体重都有增加的趋势。各组小鼠被毛光泽程度、行为方式、活动情况等没有显著差别。与Con组相比较,Model组肝脏系数显著性升高(P<0.001),提示肝脏充血水肿。与Model组相比,Tribuli Low组、Tribuli High组中肝脏系数明显降低(P<0.05),提示充血水肿程度减轻。
表1 给药周期内小鼠体质量与肝脏系数变化
2.2 GSTT对急性酒精性肝损伤小鼠肝脏组织形态的影响
如图1所示,Con组小鼠的肝脏均匀且清楚分布着放射线状排列肝索,组织结构完整,明显可见结构清晰的肝小叶,细胞核可见,细胞质均匀分布。从图中可以看出,急性酒精性肝损伤以肝细胞变性为主,Model组小鼠肝脏中可见结构不清的肝小叶、伴随着膨大的肝细胞,并且出现各种参差不齐的脂肪空泡,肝细胞相互之间界限模糊。给药组小鼠肝脏中部分肝小叶结构得到恢复,中性粒细胞等炎性细胞浸润程度减轻,肝细胞水样变数目低于Model组。结果表明,相较于Model组小鼠,末次急性大剂量酒精摄入12h后,给药组小鼠肝细胞受损伤程度更低,GSTT可有效保护肝脏,降低因大剂量酒精摄入导致的肝脏损伤程度,但并不能完全缓解肝脏损伤。
2.3 GSTT对急性酒精性肝损伤小鼠血清中AST、ALT、SOD、MDA与GSH的影响
对小鼠血清中肝功能特异性指标AST、ALT与氧化应激相关指标MDA、SOD、GSH进行试剂盒检测,其结果如表2所示,与Con组相比,Model组小鼠血清中AST、ALT、MDA的含量显著提高(P<0.01),SOD、GSH含量显著降低(P<0.01),表明模型成功构建;与Model组相比,阳性药物组和蒺藜皂苷低、高剂量组中ASL、ALT、MDA含量显著降低(P<0.01),SOD、GSH含量显著提高(P<0.01),提示GSTT对急性酒精性小鼠肝损伤有较好的保护作用。
表2 GSTT对急性酒精性肝损伤小鼠血清中AST、ALT、SOD、MDA、GSH的影响
2.4 GSTT对小鼠肝脏代谢物的影响
对小鼠肝脏中所含有的物质进行核磁扫描后,所得到的谱图数据如图2所示。通过人类代谢组学数据库(HMDB:http://www.hmdb.ca/)对谱图峰所代表的物质进行指认,共鉴定出32种主要标志代谢物,见表3。

图2 ICR小鼠的肝脏提取物1H-NMR特征图谱
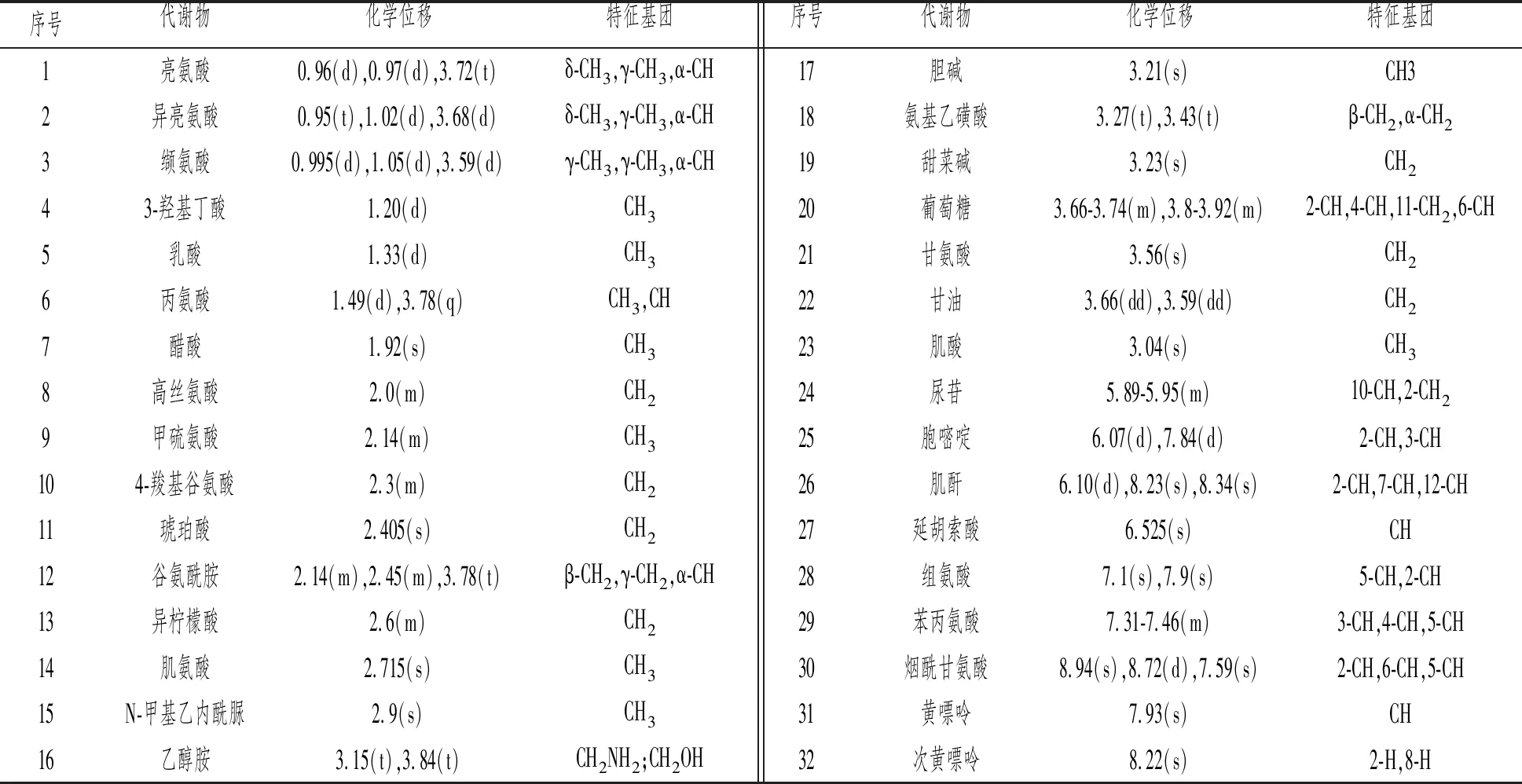
表3 小鼠肝脏1H-NMR谱图所含主要标志代谢物
2.5 多元统计分析
使用PCA方法,对所有样本的数据进行分析,结果如图3A所示,Con组、Model组能明显分离,且组内样本能较好的聚集,说明小鼠酒精性肝损伤模型建立成功。进一步选用有监督的OSC-PLS-DA方法,在肝脏组织代谢样本中,可直观地看出各组间有明显的分离,如图4B中Con组,Model组和Glu组分离明显,在图4C和图4D中各组分离程度明显,在图4E中Glu组与Model组未见明显分离。
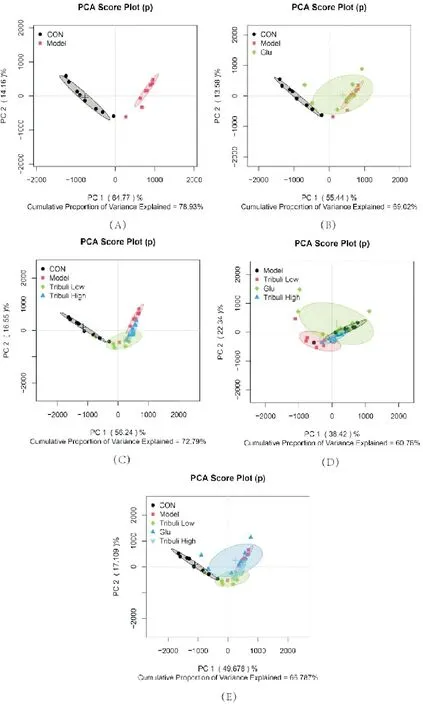
图3 小鼠肝脏提取物PCA得分图

图4 小鼠肝脏提取物OSC-PLS-DA得分图及分析
本研究共发现28种差异代谢物在各组中的表达量发生显著变化。使用S-plots对代谢物行进一步分析。由S-plots结果(图4)可得,与Con组相比,Model组中亮氨酸、异亮氨酸、缬氨酸、3-羟基丁酸、醋酸、高丝氨酸、甲硫氨酸、4-羧基谷氨酸、肌酸、N-甲基乙内酰脲、乙醇胺、胆碱、氨基乙磺酸、甘氨酸、尿苷、胞嘧啶、肌酐、琥珀酸、延胡索酸、丙氨酸、胆碱、次黄嘌呤、乳酸含量显著降低,葡萄糖、黄嘌呤、甘油含量显著升高。
与Model组相比,蒺藜皂苷低剂量组中高丝氨酸、甲硫氨酸、4-羧基谷氨酸、乙醇胺、组氨酸、乳酸、延胡索酸、胆碱、烟酰甘氨酸含量显著升高,甘油、肌酸、黄嘌呤含量显著降低。
与Model组相比,蒺藜皂苷高剂量组中肌酸、尿苷、胞嘧啶、组氨酸、苯丙氨酸、醋酸,含量显著降低,高丝氨酸、氨基乙磺酸含量显著升高。
3 讨 论
酒精性肝病是常见的慢性肝病,被列为人类三大致死原因之一[11]。目前临床治疗ALD的药物效果有限,因此,寻找天然、高效、稳定的药物治疗ALD具有广阔前景[12-13]。GSTT可能通过降低氧化应激、改善能量代谢、氨基酸代谢、脂质代谢、嘌呤代谢等方面发挥对急性酒精肝损伤的保护作用。
3.1 氧化应激
AST和ALT可以一定程度反映肝组织损伤程度[14]。与Con组相比,Model组的AST和ALT活性显著升高,而给药组其活性显著下降,说明GSTT可能通过改善肝组织损伤,发挥保肝护肝作用。MDA可以了解膜过氧化的程度,而SOD可以抑制自由基引起的反应。本实验结果表明,给药组的MDA水平显著下降,而SOD显著上升,说明GSTT能够降低氧化应激程度,具有抗氧化作用。
3.2 能量代谢
葡萄糖进入三羧酸循环产生能量是机体主要的供能途径[15]。在实验中,Model组中三羧酸循环的中间产物琥珀酸和延胡索酸的含量显著降低,说明有氧呼吸活动受到抑制。而给药组中延胡索酸含量显著提高,证明GSTT能够改善有氧呼吸水平。机体有氧呼吸活动受影响时,会通过无氧呼吸释放少量能量并产生乳酸径[16]。在Model组中,乳酸含量显著降低,提示小鼠体内无氧呼吸水平同时被抑制,而给药组中乳酸含量显著上升,提示GSTT能有效改善小鼠体内无氧呼吸水平。丙氨酸可以通过丙氨酸-葡萄糖循环为器官提供能量,而Model组肝脏中丙氨酸浓度显著降低,给药组中无明显变化,说明肝脏能量代谢异常,而GSTT能改善能量代谢。肌酸参与肌酸/磷酸肌酸循环,Model组中肌酸含量显著降低,提示小鼠能量代谢受到影响。GSTT能通过改善有氧呼吸、无氧呼吸、丙氨酸-葡萄糖循环和肌酸/磷酸肌酸循环来维持肝脏能量代谢的正常运作。
3.3 氨基酸代谢
甲硫氨酸作为同型半胱氨酸的甲基供体[17],甲硫氨酸和同型半胱氨酸循环受到抑制,给药组中GSTT可以改善该循环。甘氨酸可以通过蛋白质的甲基化来调控其活性与表达[18],其含量下降提示氨基酸代谢紊乱。亮氨酸与异亮氨酸等支链氨基酸含量下降表明三羧酸循环受到阻碍[19],给药组中GSTT可以改善该过程。肌酸可以通过肌酸/磷酸肌酸系统增强细胞能量,增加ATP水平[20]。肌酸含量下降表明GSTT可以抑制肌酸分泌,改善肝内能量代谢情况。这些变化表明GSTT可以调节氨基酸代谢,从而对急性酒精性肝损伤起到保护作用。
3.4 脂质代谢
3-羟基丁酸含量下降提示肝脏中的β-氧化过程受到阻碍[21],小鼠肝细胞线粒体功能障碍。胆碱含量下降提示肝脏中磷脂与胆碱代谢紊乱,GSTT能够改善脂质代谢,从而对急性酒精性肝损伤起到保护作用。
3.5 嘌呤代谢
给药组中次黄嘌呤的堆积是因为ATP降解,而堆积的次黄嘌呤将被进一步氧化,导致氧自由基增多,这表明肝脏正在经历氧化应激[22]。在Model组,ATP大量降解或线粒体DNA损伤导致肝脏中黄嘌呤含量升高,次黄嘌呤含量降低。而在给药组中,黄嘌呤含量显著降低,次黄嘌呤含量无明显变化。这一结果表明GSTT具有抗氧化作用,能增强嘌呤代谢途径。
综上所述,本实验使用代谢组学方法初步探索GSTT对小鼠急性酒精性肝损伤的保护作用。根据结果及讨论,GSTT具有较好的抗氧化作用,且能通过调节能量代谢、氨基酸代谢、脂质代谢、嘌呤代谢等代谢通路,保护急性酒精性肝损伤。

