苯并嘧啶衍生物的合成和抗糖尿病活性评价
徐远涛,王军栋,关 丽,赵 宁,李伟泽
(1陕西盘龙药业集团股份有限公司,柞水 714000;2山东省烟台市食品药品检验检测中心,烟台 264000;3西安医学院药学院,西安 710021)
糖尿病已经成为影响我国居民健康的重大公共卫生问题。截至2019 年,全球有4.63 亿成年人(占全球总人数1/11)患有糖尿病。到2030年,糖尿病患者预计达到5.78亿。糖尿病的特征主要包括高血糖,功能性胰岛β 细胞数量的丢失,降糖激素胰岛素的缺乏以及α 细胞持续分泌升糖激素胰高血糖素[1]。糖尿病的发生与氧化应激密切相关。有研究指出,小鼠胰腺中抗氧化酶的含量明显低于其他组织,胰岛β 细胞中抗氧化酶的表达较低,因此对氧化应激更为敏感[2]。糖尿病患者中,胰岛氧化还原稳态失衡,大量活性氧簇(ROS)的堆积爆发氧化应激,这种状态与硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein, TXNIP)的过表达密切相关[3]。
TXNIP是一种内源性的细胞氧化还原调节剂,含有391 个氨基酸,编码在人类1 号染色体和小鼠3 号染色体上[4]。1999 年,Nishiyama 等[5]发现TXNIP 在体内可以通过与硫氧还蛋白(thioredoxin,TRX)结合而抑制其功能和表达。与TXNIP 发生结合作用的TRX 是一种在体内广泛存在的氧化还原蛋白,具有抗氧化作用,TXNIP 通过与TRX 中的两个半胱氨酸残基结合抑制TRX 的抗氧化活性,调节细胞氧化还原状态并诱导氧化应激[6]。
糖尿病小鼠的高血糖会促使TXNIP 表达上升,引发功能性TRX 含量下降,最终爆发氧化应激[7]。2002 年,Shalev 等[8]发现,在6 000 多个人胰岛基因中,TXNIP是葡萄糖诱导的反应基因中上调表达最高的,上调约11 倍。TXNIP 经葡萄糖诱导而表达上升并导致胰岛β细胞凋亡,TXNIP 缺乏可以保护胰岛β细胞对抗葡萄糖毒性[9]。
这些研究证据提示抑制TXNIP 的表达可能是2 型糖尿病治疗的一种具有吸引力的新方法,但目前尚无TXNIP 抑制剂可用。文献调研发现,目前仅报道了一种小分子TXNIP 抑制剂——苯并嘧啶磺酰胺类化合物SRI-37330,该分子是研究人员通过高通量筛选从30万个小分子化合物中筛选出的一种可口服的抗糖尿病的小分子[10]。如路线1 所示,SRI-37330 分子中除了苯并嘧啶结构还有含氮杂环,提示苯并嘧啶骨架拼合含氮杂环结构可能是TXNIP的有效抑制剂。
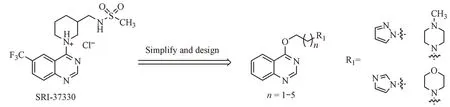
Scheme 1 Design of target compounds
因此,本研究以4-羟基苯并嘧啶为原料,通过不同长度的碳链,引入吡唑、甲基哌嗪、咪唑、吗啡啉4 种含氮杂环,设计合成了20 种苯并嘧啶骨架拼合含氮杂环的衍生物。药理活性测试方法为通过棕榈酸(palmitate acid, PA)刺激小鼠胰岛β 细胞造成细胞损伤模型[11];再测试所合成的苯并嘧啶衍生物对PA 刺激的小鼠胰岛β 细胞损伤的保护作用,通过比较给药组相对模型组的细胞活力大小判断化合物是否具有胰岛细胞保护作用。
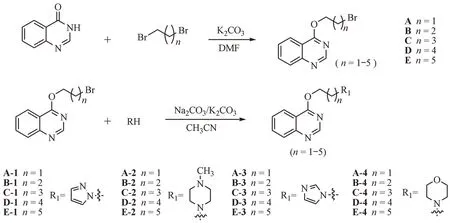
1 合成路线
苯并嘧啶衍生物的制备如路线2所示。首先将4-羟基苯并嘧啶与不同长度的二溴烷烃反应得到中间体A-E,再与不同的含氮杂环反应获得20 个苯并嘧啶骨架拼合含氮杂环的衍生物A-1 ~ E-4。
2 实验部分
2.1 仪器与试剂
NMR Avance-300MHz 核磁共振仪(德国布鲁克公司 );ESI-MS 质谱仪(美国安捷伦公司);TR6000 全自动酶标仪(深圳雷杜公司);LC-2010 高效液相色谱仪(日本岛津公司),YMC-Pack ODS-A柱(日本维美希公司)。小鼠胰岛β 细胞Min6(上海青旗生物技术发展有限公司);DMEM 培养基(大连美仑生物技术有限公司),硅胶GF254薄层预制板(青岛海洋化工厂);柱色谱硅胶(上海谱振生物科技有限公司);DMSO(国药集团化学试剂有限公司);其他试剂均属于市售化学或分析纯类。
2.2 化学合成
2.2.1 中间体4-(2-溴乙氧基)苯并嘧啶(A) 先量取1,2-二溴乙烷2.10 mL(24.63 mmol)和缚酸剂K2CO34.17 g(30.17 mmol)于茄形瓶中,加入DMF约30 mL,置于磁力搅拌器中搅拌。再将4-羟基苯并嘧啶3.00 g(20.12 mmol)溶解于DMF 10 mL,在室温下缓慢滴加。待4-羟基苯并嘧啶的DMF 溶液滴加完成后约0.5 h,反应完全。反应体系中加入乙酸乙酯50 mL,有机层用水萃取(50 mL×3)后,用无水Na2SO4干燥,减压浓缩;柱色谱分离(石油醚-丙酮,7∶1)得到白色晶体A 2.00 g,收率38.5%。mp:99 ~ 100 ℃;1H NMR (400 MHz, CDCl3)δ:8.31(1H, dd,J= 1.2 Hz, 8.0 Hz, H-8), 8.10(1H, s, H-2),7.79(1H, td,J= 1.4 Hz, 7.5 Hz, H-6), 7.74 (1H, d,J= 7.2 Hz, H-5), 7.53(1H, dt,J= 1.2 Hz, 7.5 Hz ,H-7), 4.39 (2H, t,J =5.8 Hz, OCH2-), 3.78(2H, t,J =5.8 Hz, CH2Br); ESI-MSm/z: 252.9[M+H]+。
2.2.2 中间体4-(3-溴丙氧基)苯并嘧啶(B) 量取1,3-二溴丙烷3.41 mL(32.85 mmol)、K2CO35.67 g(41.05 mmol)于茄形瓶中,加入DMF约30 mL,置于磁力搅拌器中搅拌;再将4-羟基苯并嘧啶4.00 g(26.82 mmol)溶解于DMF 10 mL,在室温下缓慢滴加。待4-羟基苯并嘧啶的DMF 溶液滴加完成后约0.5 h,反应完全。后处理方法同化合物A,得白色晶体B 1.56 g,收率21.4%。mp:115 ~ 116 ℃;1H NMR (400 MHz, CDCl3)δ:8.31(1H, dd,J= 1.0 Hz, 8.0 Hz, H-8), 8.11(1H, s, H-2), 7.78(1H, td,J =1.5 Hz, 7.5Hz, H-6), 7.72(1H, dd,J= 0.8 Hz, 8.1Hz, H-5), 7.52(1H, td,J= 2.1 Hz,7.5 Hz, H-7),4.19(2H, t,J= 6.7 Hz, OCH2-), 3.45(2H, t,J =6.1Hz, CH2Br), 2.46 ~ 2.36(2H, m, -CH2-); ESI-MSm/z:266.9[M+H]+。
2.2.3 中间体4-(4-溴丁氧基)苯并嘧啶(C) 量取1,4-二溴丁烷1.66 mL(13.41 mmol)、K2CO3(2.78 g,20.11 mmol)于茄形瓶中,加入DMF 约30 mL,置于磁力搅拌器中搅拌;再将4-羟基苯并嘧啶2.00 g(13.41 mmol)溶解于DMF 10 mL,在室温下缓慢滴加。待4-羟基苯并嘧啶的DMF 溶液滴加完成后约0.5 h,反应完全。后处理方法同化合物A,得白色晶体C 1.31 g,收率35.5%。mp:75 ~ 77 ℃;1H NMR (400 MHz, CDCl3)δ:8.32(1H, dd,J =1.2Hz, 8.0 Hz, H-8), 8.04(1H, s, H-2), 7.77(1H, td,J =1.4 Hz, 7.5 Hz, H-6), 7.72(1H, d,J= 7.3 Hz, H-5),7.52(1H, td,J= 1.3 Hz, 7.6 Hz, H-7), 4.05(2H, t,J =6.8 Hz, OCH2-), 3.45(2H, t,J =6.3 Hz, CH2Br),1.97(4H, t,J= 3.6 Hz, -CH2CH2-); ESI-MSm/z:281.0[M+H]+。
2.2.4 中间体4-((5-溴戊基)氧基)苯并嘧啶(D)量取1, 5- 二溴戊烷2.24 mL(16.09 mmol)、K2CO32.78 g (20.11 mmol)于茄形瓶中,加入DMF约30 mL,置于磁力搅拌器中搅拌;再将4-羟基苯并嘧啶2.00 g(13.41 mmol)溶解于DMF 10 mL,在室温下缓慢滴加。待4-羟基苯并嘧啶的DMF 溶液滴加完成后约0.5 h,反应完全。后处理方法同化合物A,得白色晶体D 2.06 g,收率52.0%。mp:55 ~ 56 ℃;1H NMR (400 MHz, CDCl3)δ:8.31(1H,dd,J= 1.1 Hz, 8.0 Hz, H-8), 8.04(1H, s, H-2), 7.77(1H, td,J =1.4 Hz, 7.5 Hz, H-6), 7.71(1H, d,J =7.3 Hz, H-5), 7.52(1H, td,J= 1.2 Hz, 7.5 Hz, H-7), 4.05(2H, t,J =6.8 Hz, OCH2-), 3.45(2H, t,J =6.3 Hz, CH2Br), 1.96 ~ 1.80(6H, m, -CH2CH2CH2-);ESI-MSm/z: 294.9[M+H]+。
2.2.5 中间体4-((6-溴己基)氧基)苯并嘧啶(E)量取1, 6- 二溴己烷5.21 mL(13.41 mmol)、K2CO32.78 g (40.96 mmol)于茄形瓶中,加入DMF约30 mL,置于磁力搅拌器中搅拌;再将4-羟基苯并嘧啶4.00 g (26.82 mmol)溶解于DMF 10 mL,在室温下缓慢滴加。待4-羟基苯并嘧啶的DMF 溶液滴加完成后约0.5 h,反应完全。后处理方法同化合物A,得白色晶体E 4.13 g,收率48.8%。mp:67 ~ 68 ℃;1H NMR (400 MHz, CDCl3)δ:8.32(1H,dd,J= 1.0 Hz, 8.0 Hz, H-8), 8.03(1H, s, H-2), 7.76(1H, td,J =1.5 Hz, 7.5 Hz, H-6), 7.71(1H, dd,J=0.8 Hz, 8.0 Hz, H-5), 7.52(1H, td,J= 1.3 Hz, 7.4Hz, H-7), 4.01(2H, t,J= 7.3 Hz, OCH2-), 3.40(2H,t,J =6.9 Hz, CH2Br), 1.90 ~ 1.79(4H, m,-CH2CH2-),1.53 ~ 1.40(4H, m,-CH2CH2-); ESI-MSm/z: 309.1[M+H]+。
2.2.6 4-(2-(1H-吡唑-1-基)乙氧基)苯并嘧啶(A-1) 取中间体A 250 mg(0.99 mmol)和吡唑80 mg(1.16 mmol)溶解于乙腈10 mL,加入K2CO3410 mg(2.97 mmol),于80 ℃反应。约40 h后,反应物反应完全。溶液浓缩后加入水30 mL,用乙酸乙酯进行萃取(30 mL × 3),将有机层用无水Na2SO4干燥,减压浓缩;得白色晶体A-1 200 mg,收率84.3%。mp:117 ~ 119 ℃;1H NMR(400 MHz, CDCl3)δ:8.15(1H, d,J= 7.6 Hz, H-8), 8.08(1H, s, H-2), 7.70(1H,t,J =7.6 Hz, H-6), 7.60(1H, s, H-5), 7.58(1H, d,J =5.2 Hz, pyrazole), 7.42(1H, t,J= 7.6 Hz, H-7), 6.32(1H, s, pyrazol), 4.14(2H, t,J= 4.7 Hz, OCH2-), 3.40(2H, t,J= 4.7Hz, CH2N-); ESI-MSm/z: 242.1[M+H]+;采用HPLC 检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.8%,tR= 3.69 min。
Scheme 2 Synthetic route of benzopyrimidine derivatives
2.2.7 4-(2-(4-甲基哌嗪-1-基)乙氧基)苯并嘧啶(A-2) 取中间体A 250 mg(0.99 mmol)、1-甲基哌嗪134.0 µL(1.18 mmol)溶解于乙腈10 mL,加入Na2CO3310 mg(2.92 mmol)。于80 ℃反应约8 h 反应完全。后处理方式同化合物A-1,得到黄色油状液体A-2 220 mg,收率81.8%。1H NMR(400 MHz,CDCl3)δ:8.31(1H, dd,J= 1.0 Hz, 8.0 Hz, H-8),8.07(1H, s, H-2), 7.76(1H, td,J= 1.4 Hz, 7.5 Hz,H-6), 7.71(1H, d,J= 7.3 Hz, H-5), 7.50(1H, td,J=1.3 Hz, 7.4 Hz, H-7), 4.09(2H, t,J= 5.9 Hz,OCH2-), 2.72(2H,t,J= 6.0 Hz, CH2N-), 2.56(4H, s,NCH2CH2N), 2.44(4H, s, NCH2CH2N), 2.27(3H, s,-CH3); ESI-MSm/z: 273.1[M+H]+;采用HPLC 检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.9%,tR= 3.45 min。
2.2.8 4-(2-(1H-咪唑-1-基)乙氧基)苯并嘧啶(A-3) 取中间体A 230 mg(0.91 mmol)、咪唑80 mg(1.16 mmol)溶解于乙腈10 mL,加入Na2CO3310 mg(2.92 mmol)。80 ℃反应约40 h 反应完全。后处理方式同化合物A-1,得白色晶体A-3 110 mg,收率50.4%。mp:140 ~ 141 ℃;1H NMR(400 MHz,CDCl3)δ:8.32(1H, dd,J =1.3 Hz, 8.0 Hz, H-8),7.79(1H, td,J =1.4 Hz, 7.6 Hz, H-6), 7.69(1H, d,J=8.1 Hz, H-5), 7.55(1H, t,J =8.0 Hz, H-7), 7.46(1H,s, H-8), 7.39(1H, s, imidazol), 7.09(1H, s, imidazol),6.87(1H, s, imidazol) 4.42(2H, t,J= 5.5 Hz, OCH2-),4.3(2H,t,J= 5.4 Hz, CH2N-); ESI-MSm/z: 241.1[M+H]+;采用HPLC 检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.8%,tR= 3.14 min。
2.2.9 4-(2-(苯并嘧啶-4-基氧基)乙基)吗啉(A-4)取中间体A 250 mg(0.99 mmol)、吗啡啉105.4 µL(1.18 mmol)溶解于乙腈10 mL,加入Na2CO3310 mg(2.92 mmol)。80 ℃反应约40 h 反应完全。后处理方式同化合物A-1,浓缩得到白色晶体A-4 220 mg,收率85.8%。mp:74 ~ 76 ℃;1H NMR(400 MHz,CDCl3)δ:8.31(1H, dd,J =1.3 Hz, 8.0 Hz, H-8),8.07(1H, s, H-2), 7.77(1H, td,J= 1.4 Hz, 7.5 Hz,H-6), 7.71(1H, d,J= 7.8 Hz, H-5), 7.51(1H, td,J=1.2 Hz, 7.4 Hz, H-7), 4.10(2H, t,J= 5.9 Hz,OCH2-), 3.68(4H, t,J= 4.5 Hz, NCH2CH2O) 2.72(2H, t,J= 6.0 Hz, CH2N-), 2.52(4H, d,J =4.5 Hz,NCH2CH2O); ESI-MSm/z: 260.1[M+H]+;采用HPLC检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.6%,tR= 2.87 min。
2.2.10 4-(3-(1H-吡唑-1-基)丙氧基)苯并嘧啶(B-1) 取中间体B 220 mg(0.82 mmol)、吡唑80 mg(1.16 mmol)溶解于乙腈10 mL,加入K2CO3390 mg(2.82 mmol)。80 ℃反应约35 h 反应完全。后处理方式同化合物A-1,得到黄色油状液体B-1 190 mg,收率91.1%。1H NMR(400 MHz, CDCl3)δ:8.31(1H, td,J= 1.1 Hz, 6.9 Hz, H-8), 8.10(1H, d,J=8.1 Hz, H-2), 7.78(1H, m, H-6), 7.72(1H, t,J =5.3Hz, H-5), 7.63(1H, d,J =1.9 Hz, pyrazole), 7.52(1H, td,J= 1.3Hz, 7.4 Hz, H-7), 6.27(1H, t,J= 2.0 Hz, pyrazol), 2.44 ~ 2.38(2H, m, OCH2-), 2.05 ~1.99 (2H, m, CH2N-); ESI-MSm/z: 255.1[M+H]+;采用HPLC检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.5%,tR= 3.71 min。
2.2.11 4-(3-(4-甲基哌嗪-1-基)丙氧基)苯并嘧啶(B-2) 取中间体B 250 mg(0.93 mmol)、1-甲基哌嗪127.0 µL(1.12 mmol)溶解于乙腈10 mL,加入Na2CO3300 mg(2.83 mmol)。80 ℃反应约8 h 反应完全。后处理方式同化合物A-1,得黄色油状液体B-2 170 mg,收率81.8%。1H NMR(400 MHz,CDCl3)δ:8.31(1H, dd,J= 1.0 Hz, 8.0 Hz, H-8),8.14(1H, s, H-2), 7.76(1H, td,J= 1.5 Hz, 7.6 Hz,H-6), 7.71(1H, dd,J= 0.8 Hz, 8.1 Hz, H-5), 7.51(1H, td,J= 1.3 Hz, 7.5 Hz, H-7), 4.09(2H, t,J=6.6 Hz, OCH2-), 2.44(4H, s, NCH2CH2N), 2.38(2H,t,J= 6.6 Hz, CH2N-), 2.27(3H, s, -CH3), 2.44 ~2.27(4H, m, NCH2CH2N); ESI-MSm/z: 287.1[M+H]+;采用HPLC 检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.8%,tR= 3.41 min。
2.2.12 4-(3-(1H-咪唑-1-基)丙氧基)苯并嘧啶(B-3) 取中间体B 250 mg(0.93 mmol)、咪唑80 mg(1.16 mmol)溶解于乙腈10 mL,加入Na2CO3300 mg(2.83 mmol)。80 ℃反应约35 h 反应完全。后处理方式同化合物A-1,得到黄色油状液体B-3 150 mg,收率63.1%。1H NMR(400 MHz, CDCl3)δ:8.31(1H, dd,J= 1.4 Hz, 7.4 Hz, H-8), 7.95(1H, s, H-2),7.79(1H, td,J= 1.5 Hz, 7.6 Hz, H-6), 7.72(1H, d,J= 7.7 Hz, H-5), 7.58(1H, s, imidazol), 7.54(1H,td,J= 1.2 Hz, 7.5 Hz, H-7), 7.12(1H, s, imidazol),7.00(1H, s, imidazol) 4.09(2H, t,J =7.0 Hz,OCH2-), 4.01(2H, t,J =7.2 Hz, CH2N-), 2.38 ~2.30(1H, m,-CH2-), 2.26(1H, t,J= 7.2 Hz, -CH2-);ESI-MSm/z: 255.1[M+H]+;采用HPLC 检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.4%,tR= 2.73 min。
2.2.13 4-(3-(苯并嘧啶-4-基氧基)丙基)吗啉(B-4) 取中间体B 250 mg(0.93 mmol)、吗啡啉100 µL(1.12 mmol)溶解于乙腈10 mL,加入Na2CO3300 mg(2.83 mmol)。80 ℃反应约6 h 反应完全。后处理方式同化合物A-1,得到黄色油状液体B-4 250 mg,收率98.1%。1H NMR(400 MHz, CDCl3)δ:8.31(1H, d,J= 8.0 Hz, H-8), 8.13(1H, s, H-2), 7.76(1H,td,J =2.1 Hz, 6.9 Hz, H-6), 7.70(1H, d,J= 8.2 Hz, H-5), 7.51(1H, t,J= 7.7 Hz, H-7), 4.10(2H, t,J= 6.6 Hz, OCH2-), 3.67(4H, s, NCH2CH2O), 2.41(4H, d,J= 2.4 Hz, NCH2CH2O), 2.39(2H, t,J= 6.5 Hz, CH2N-); ESI-MSm/z: 274.1[M+H]+;采用HPLC检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.6%,tR= 2.60 min。
2.2.14 4-(4-(1H-吡唑-1-基)丁氧基)苯并嘧啶(C-1) 取中间体C 100 mg(0.36 mmol)、吡唑60 mg(0.87 mmol)溶解于乙腈10 mL,加入K2CO3230 mg(2.17 mmol)。80 ℃反应约35 h 反应完全。后处理方式同化合物A-1,得到白色晶体C-1 90 mg,收率82.9%,mp: 106 ~ 108 ℃。1H NMR(400 MHz,CDCl3)δ:8.31(1H, td,J= 1.2 Hz, 7.9 Hz, H-8),8.04(1H, s, H-2), 7.77(1H, td,J= 1.5 Hz, 7.5 Hz,H-6), 7.71(1H, dd,J =0.6 Hz, 8.0 Hz, H-5), 7.51(1H, t,J= 1.3 Hz, 7.4 Hz, H-7), 6.27(1H, t,J =2.0 Hz, pyrazol), 4.03(2H, t,J =7.3 Hz, OCH2-), 2.14 ~1.98(2H, m, CH2N- ), 1.25(4H, t,J= 3.6 Hz,-CH2CH2-); ESI-MSm/z: 269.1[M+H]+;采用HPLC检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.5%,tR= 3.75 min。
2.2.15 4-(4-(4-甲基哌嗪-1-基)丁氧基)苯并嘧啶(C-2) 取中间体C(300 mg, 1.1 mmol)、1-甲基哌嗪(130 µL, 1.2 mmol)溶解于乙腈10 mL,加入K2CO3(440 mg, 3.20 mmol)。80 ℃反应约8 h 反应完全。后处理方式同化合物A-1,得到黄色油状液体C-2 10 mg,收率31.1%。1H NMR(400 MHz, CDCl3)δ:8.31(1H, dd,J =1.0 Hz, 7.9 Hz, H-8), 8.04(1H, s,H-2), 7.76(1H, td,J= 1.5 Hz, 7.5 Hz, H-6), 7.71(1H, dd,J= 0.8 Hz, 7.6 Hz, H-5), 7.51(1H, td,J =1.3 Hz, 7.4 Hz, H-7), 4.03(2H, t,J= 7.3 Hz,OCH2-), 2.45(4H, s, NCH2CH2N), 2.39(2H, t,J=7.4 Hz, CH2N-), 2.28(3H, s, -CH3), 1.87 ~ 1.79(2H,m, -CH2CH2-), 1.65 ~ 1.51 (2H, m, -CH2CH2-), 1.25(4H, s, NCH2CH2N); ESI-MSm/z: 301.1[M+H]+;采用HPLC 检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.6%,tR= 3.53 min。
2.2.16 4-(4-(1H-咪唑-1-基)丁氧基)苯并嘧啶(C-3) 取中间体C 200 mg(0.71 mmol)、咪唑60 mg(0.87 mmol)溶解于乙腈10 mL,加入Na2CO3230 mg(2.17 mmol)。80 ℃反应约35 h 反应完全。后处理方式同化合物A-1,得到黄色油状液体C-3 110 mg,收率57.2%。1H NMR(400 MHz, CDCl3)δ:8.30(1H, dd,J= 0.8 Hz, 8.0 Hz, H-8), 8.00(1H, s, H-2)7.78(1H, td,J= 1.4 Hz, 7.6 Hz, H-6), 7.72(1H, d,J= 8.0 Hz, H-5), 7.69(1H, s, imidazol), 7.53(1H, t,J= 7.0 Hz, H-7), 7.50(1H, s, imidazol), 7.10(2H, s,CH2N-), 6.92(1H, s, imidazol), 4.02(2H, t,J= 7.0Hz, OCH2-), 1.88 ~ 1.80(4H, m, -CH2CH2-); ESI-MSm/z: 269.1[M+H]+;采用HPLC 检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.8%,tR=2.88 min。
2.2.17 4-(4-(苯并嘧啶-4-基氧基)丁基)吗啉(C-4) 取中间体C 200 mg(0.71 mmol)、吗啡啉62 µL(0.73 mmol)溶解于乙腈10 mL,加入Na2CO3230 mg(2.17 mmol)。80 ℃反应约6 h反应完全。后处理方式同化合物A-1,得到白色晶体C-4 220 mg,收率85.8%。mp:81 ~ 82 ℃;1H NMR(400 MHz, CDCl3)δ:8.31(1H, dd,J= 1.0 Hz, 8.0 Hz, H-8), 8.04(1H,s, H-2), 7.76(1H, td,J= 1.5 Hz, 7.8 Hz, H-6), 7.71(1H, d,J= 7.7 Hz, H-5), 7.51(1H, td,J =1.3 Hz,7.2 Hz, H-7), 4.04(2H, t,J =6.6 Hz, OCH2-), 3.70(4H, t,J= 4.6 Hz, NCH2CH2O), 2.42(4H, t,NCH2CH2O), 2.38(2H, t,J= 7.4 Hz, CH2N-), 1.91 ~1.79(2H, m, -CH2-), 1.60 ~ 1.56 (2H, m, -CH2-);ESI-MSm/z: 288.1[M+H]+;采用HPLC 检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.7%,tR= 2.69 min。
2.2.18 4-((5-(1H-吡唑-1-基)戊基)氧基)苯并嘧啶(D-1) 取中间体D 200 mg(0.68 mmol)、吡唑51 mg(0.74 mmol)溶解于乙腈10 mL,加入K2CO3280 mg(2.02 mmol)。80 ℃反应约40 h 反应完全。后处理方式同化合物A-1,得到白色晶体D-1 160 mg,收率83.1%。mp: 93 ~ 94 ℃;1H NMR(400 MHz,CDCl3)δ:8.31(1H, d,J =8.0 Hz, H-8), 7.99(1H, s,H-2), 7.76(1H, td,J= 1.2 Hz, 7.6 Hz, H-6), 7.71(1H, d,J= 7.8 Hz, H-5), 7.52(1H, t,J= 7.9 Hz, H-7),7.49(1H, s, pyrazol), 7.34(1H, dd,J= 2.1 Hz,8.4 Hz, pyrazol), 6.21(1H, t,J= 2.1 Hz, pyrazol),3.97(2H, t,J= 7.3 Hz, OCH2-),4.03(2H, t,J= 7.3Hz, OCH2-), 2.09 ~ 1.98(2H, m, CH2N-), 1.85 ~1.79(2H, m, -CH2-), 1.41 ~ 1.33(2H, m, -CH2-),1.28 ~ 1.24(2H, m, -CH2-); ESI-MSm/z: 283.1[M+H]+;采用HPLC 检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.4%,tR= 3.79 min。
2.2.19 4-((5-(4-甲基哌嗪-1-基)戊基)氧基)苯并嘧啶(D-2) 取中间体D 200 mg(0.68 mmol)、1-甲基哌嗪83 µL(0.75 mmol)溶解于乙腈10 mL,加入K2CO3280 mg(2.02 mmol)。80 ℃反应约8 h 反应完全。后处理方式同化合物A-1,得到白色晶体D-2 120 mg,收率56.1%。mp:85 ~ 86 ℃;1H NMR(400 MHz, CDCl3)δ:8.31(1H, d,J= 8.0 Hz, H-8), 8.03(1H, s, H-2), 7.76(1H, td,J= 1.2 Hz, 7.5 Hz, H-6),7.71(1H, d,J =8.1 Hz, H-5), 7.51(1H, t,J= 6.9Hz, H-7), 4.00(2H, t,J= 7.4 Hz, OCH2-), 2.46(4H,s, NCH2CH2N), 2.34(2H, t,J= 7.6 Hz, CH2N-), 2.28(3H, s, -CH3), 1.85 ~ 1.79(2H, m, -CH2-), 1.60 ~1.52(2H, m, -CH2-), 1.44 ~ 1.36(2H, m, -CH2-); ESIMSm/z: 315.1[M+H]+;采用HPLC 检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.6%,tR= 3.51 min。
2.2.20 4-((5-(1H-咪唑-1-基)戊基)氧基)苯并嘧啶(D-3) 取中间体D 300 mg(1.02 mmol)、咪唑80 mg(1.16 mmol)溶解于乙腈10 mL,加入Na2CO3320 mg(3.02 mmol)。80 ℃反应约35 h 反应完全。后处理方式同化合物A-1,得到黄色油状液体D-3 120mg,收率46.6%。1H NMR(400 MHz, CDCl3)δ:8.31(1H, dd,J= 1.2 Hz, 8.0 Hz, H-8), 8.00(1H, s, H-2),7.77(1H, td,J= 1.5 Hz, 7.5 Hz, H-6), 7.72(1H, s,imidazol), 7.71(1H, d,J= 2.9 Hz, H-5), 7.52(1H,td,J= 1.2 Hz, 7.0 Hz, H-7), 7.50(1H, s, imidazol),6.92(1H, s, imidazol), 4.04 ~ 3.92(2H, m, OCH2-),1.89 ~ 1.81(4H, m, -CH2CH2-), 1.42 ~ 1.36(2H, m,-CH2-); ESI-MSm/z: 283.1[M+H]+;采用HPLC 检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.9%,tR= 2.69 min。
2.2.21 4-(5-(苯并嘧啶-4-基氧基)戊基)吗啉(D-4) 取中间体D 300 mg(1.02 mmol)、吗啡啉99 µL(1.11 mmol)溶解于乙腈10 mL,加入Na2CO3320 mg(3.02 mmol)。80 ℃反应约6 h反应完全。后处理方式同化合物A-1,得到白色晶体D-4 200 mg,收率65.4%。mp:81-82 ℃;1H NMR(400 MHz, CDCl3)δ:8.31(1H, dd,J= 1.0 Hz, 8.0 Hz, H-8), 8.03(1H, s,H-2), 7.76(1H, td,J =1.5 Hz, 7.5 Hz, H-6), 7.71(1H, d,J= 7.4 Hz, H-5), 7.51(1H, td,J= 1.2 Hz, 7.5 Hz, H-7), 4.01(2H, t,J= 7.3 Hz, OCH2-), 3.70(4H, t,J= 4.6 Hz, NCH2CH2O), 2.41(4H, t,J= 4.6 Hz,NCH2CH2O), 2.33(2H, t,J= 7.4 Hz, CH2N-), 1.89 ~1.77(2H, m, -CH2-), 1.60 ~ 1.50(2H, m, -CH2-),1.48 ~ 1.36(2H, m, -CH2-); ESI-MSm/z: 302.2[M+H]+;采用HPLC 检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.3%,tR= 2.43 min。
2.2.22 4-((6-(1H-吡唑-1-基)己基)氧基)苯并嘧啶(E-1) 取中间体E 240 mg(0.78 mmol)、吡唑80 mg(1.18mmol)溶解于乙腈10 mL,加入K2CO3400 mg(2.89 mmol)。80 ℃反应约50 h 反应完全。后处理方式同化合物A-1,得到白色晶体E-1 110 mg,收率47.7%。mp:63 ~ 64 ℃;1H NMR(400 MHz, CDCl3)δ:8.31(1H, dd,J= 1.08 Hz,8.0 Hz, H-8), 8.00(1H, s, H-2), 7.76(1H, td,J= 1.4 Hz, 7.5 Hz, H-6),7.71(1H, d,J= 7.3 Hz, H-5), 7.5 (1H, td,J= 1.2Hz, 7.5 Hz, H-7), 7.48(1H, d,J =1.5 Hz, pyrazol),7.35(1H, d,J= 2.0 Hz, pyrazol ) 6.22(1H, t,J=2.0 Hz, pyrazol), 4.12(2H, t,J= 7.0 Hz, OCH2-),3.97 (2H, t,J= 7.3 Hz,CH2N-), 4.03(2H, t,J= 7.3Hz, OCH2-), 1.93 ~ 1.85(2H, m, -CH2-), 1.89 ~ 1.85(2H, m, -CH2-), 1.40 ~ 1.34(4H, m, -CH2CH2-); ESIMSm/z: 297.1[M+H]+;采用HPLC 检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.6%,tR= 3.81 min。
2.2.23 4-((6-(4-甲基哌嗪-1-基)己基)氧基)苯并嘧啶(E-2) 取中间体E 300 mg(0.97 mmol)、1-甲基哌嗪110 µL( 0.97 mmol)溶解于乙腈10 mL,加入Na2CO3310 mg(2.92 mmol)。80 ℃反应约8 h反应完全。后处理方式同化合物A-1,得到白色晶体E-2 230 mg,收率72.0%。mp: 47 ~ 48 ℃;1H NMR(400 MHz, CDCl3)δ:8.31(1H, d,J= 8.0 Hz, H-8), 8.03(1H, s, H-2), 7.76(1H, td,J= 1.5 Hz, 7.5 Hz, H-6),7.71(1H, d,J= 7.7 Hz, H-5), 7.51(1H, t,J= 8.1Hz, H-7), 4.00(2H, t,J= 7.3 Hz, OCH2-), 2.4(4H, s,NCH2CH2N), 2.34(2H,d,J= 4.4 Hz, CH2N-), 2.28(3H, s, -CH3), 1.86 ~ 1.79(2H, m, -CH2-), 1.58 ~1.42(2H, m, -CH2-), 1.40 ~ 1.36(4H, m, -CH2CH2-);ESI-MSm/z: 329.2[M+H]+;采用HPLC 检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.5%,tR= 3.76 min。
2.2.24 4-((6-(1H-咪唑-1-基)己基)氧基)苯并嘧啶(E-3) 取中间体E 300 mg(0.97 mmol)、咪唑70 mg(1.02 mmol)溶解于乙腈10 mL,加入Na2CO3310 mg(2.92 mmol)。80 ℃反应约35 h 反应完全。后处理方式同化合物A-1,得到黄色油状液体E-3 110 mg,收率48.1%。1H NMR(400 MHz, CDCl3)δ:8.31(1H, dd,J= 1.1 Hz, 8.0 Hz, H-8), 8.01(1H, s, H-2),7.77(1H, td,J= 1.5 Hz, 7.5 Hz, H-6), 7.71(1H, d,J =7.2 Hz, H-5), 7.52(1H, td,J= 1.2 Hz, 7.5 Hz,H-7), 7.46(1H, s, imidazol), 7.04(1H, s, imidazol),6.89(1H, s, imidazol), 3.99(2H, t,J =7.3 Hz,-CH2N), 3.99(2H, t,J= 7.0 Hz, OCH2-), 1.83 ~1.75(4H, m, -CH2CH2- ), 1.44 ~ 1.34 (4H, m,-CH2CH2-); ESI-MSm/z: 297.2[M+H]+;采用HPLC检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.7%,tR= 2.92 min。
2.2.25 4-(6-(苯并嘧啶-4-基氧基)己基)吗啉(E-4) 取中间体E 300 mg(0.97 mmol)、吗啡啉103 µL(1.16 mmol)溶解于乙腈10 mL,加入Na2CO3310 mg(2.92 mmol)。80 ℃反应约6 h 反应完全。后处理方式同化合物A-1,得到白色晶体E-4 300 mg,收率97.8%。mp: 56 ~ 58 ℃;1H NMR(400 MHz, CDCl3)δ:8.31(1H, dd,J= 1.1 Hz, 8.1 Hz, H-8), 8.03(1H,s, H-2), 7.76(1H, td,J= 1.5 Hz, 7.5 Hz, H-6), 7.71(1H, d,J= 7.7 Hz, H-5), 7.51(1H, td,J= 1.3 Hz,7.5 Hz, H-7), 4.00(2H, t,J= 7.3 Hz, OCH2-), 3.70(4H, t,J= 4.5 Hz, NCH2CH2O), 2.42(4H, s,NCH2CH2O), 2.31(2H, t,J= 7.8Hz, CH2N-), 1.85 ~1.77(2H, m, -CH2-), 1.55 ~ 1.45(2H, m, -CH2-),1.42 ~ 1.36(4H, m, -CH2CH2-); ESI-MSm/z: 316.2[M+H]+;采用HPLC 检测纯度,流动相乙腈-水(90∶10),流速为1 mL/min,纯度99.9%,tR= 2.67 min。
2.3 活性测试
胰岛细胞通过分泌胰岛素发挥降血糖作用,保护胰岛细胞可以改善糖尿病。PA可以诱发胰岛β 细胞死亡,因此本文采用PA 刺激建立糖尿病损伤模型。通过对比化合物组和PA 损伤模型组的细胞活力,判断化合物是否对胰岛β 细胞有保护作用。
小鼠胰岛Min6 细胞融合度达到80%时,将细胞均匀接种于96 孔培养板中,于37 ℃、5% CO2培养箱中培养过夜。模型组加入300 µmol/L PA 工作液,其他组加入300 µmol/L PA 工作液和100µmol/L 待测化合物;刺激24 h 后采用CCK-8 试剂测细胞活力。
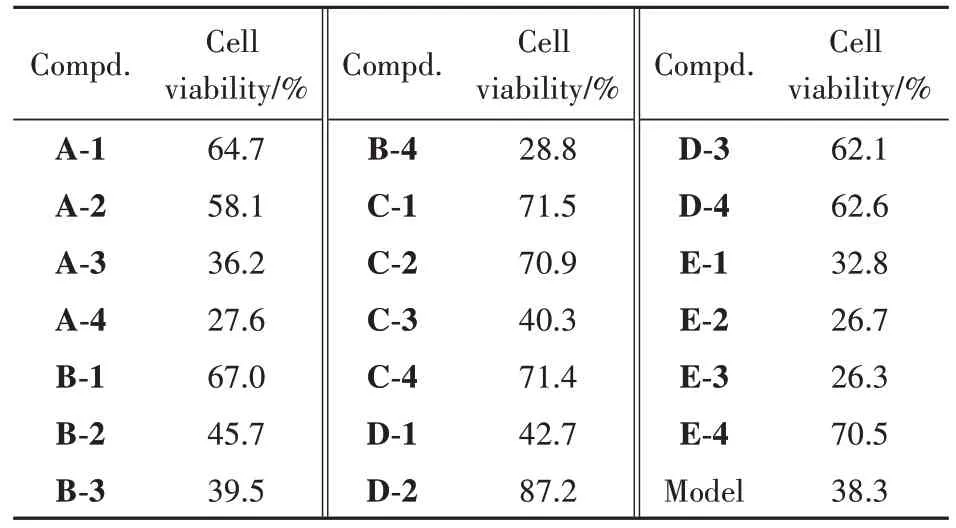
Table 2 Anti-apoptosis activity of benzopyrimidine derivatives at a concentration of 100 µmol/L
3 结果与讨论
本研究以4-羟基苯并嘧啶为原料,通过不同长度的二溴碳链引入吡唑、甲基哌嗪、咪唑、吗啡啉4 种含氮杂环,设计合成了20 种苯并嘧啶骨架拼合含氮杂环的衍生物(A-1 ~ E-4);并测试所合成的苯并嘧啶衍生物对PA刺激的小鼠胰岛β细胞损伤的保护作用,通过比较给药组相对模型组的细胞活力判断化合物是否具有胰岛细胞保护作用。
药理活性表明,大部分化合物对胰岛β细胞有保护作用,其中化合物C-1、C-2、C-4、D-2保护作用较强,采用PA 刺激建立糖尿病损伤模型后,用上述化合物处理的胰岛β细胞活力高于70%,其中化合物D-2 活性最高,化合物C-1 次之。构效关系分析表明,在n= 3 或4 时,目标化合物对β 细胞有显著的保护作用,而在n= 5 时,除R1为吗啉环外,无明显的细胞保护活性。除R1为咪唑环或吗啉环外,当烷烃链长为1 或2 时,化合物均有细胞保护作用。本研究为苯并嘧啶衍生物治疗糖尿病提供了思路,有关活性化合物的抗糖尿病机制研究正在进行中。

