用于检测多硫化氢的荧光探针研究进展
王茂林,郭薇薇,郑月钦
(中国药科大学天然药物国家重点实验室,南京 211198)
硫化氢(hydrogen sulfide,H2S)作为一种被广泛认可的气体信号分子,在神经调节、血管张力调控、细胞保护、抗炎症、抗肿瘤、氧感应等方面具有重要的信号传导作用,能够调控多种生理功能事件[1-4]。而多硫化氢(hydrogen polysulfides,H2Sn,n≥2)则被认为是一种新的潜在信号分子,它主要由H2S 经酶或活性氧(reactive oxygen species,ROS)的作用下生成,并且发挥着与H2S 类似的生理功能[5-6]。由于H2Sn中硫原子氧化价态为0,比硫原子氧化价态为-2 的H2S 具有更强的还原性与亲核性[7-8],因此在一些生理功能调节方面更加显著有效。随着对H2S生物学效应的研究深入,越来越多的证据表明,许多原本认为是H2S发挥的生理学功能实际上是H2Sn的作用所致[9-14]。因此,理解并区分H2S与H2Sn的生理功能与分子机制,将为深入探究H2S的生物学效应提供重要的见解。
相比于经典的信号分子H2S,H2Sn具有更高的蛋白质硫基化效率,这使其在调节酶活性方面具有更大的优势。例如,H2Sn可通过调节瞬时受体电位(TNF receptor associated protein 1,TRAP1) 通道的过硫化来诱导星形胶质细胞中的 Ca2+流入,且这一作用显示出比H2S 高近300 倍的效率[9-10]。在抗肿瘤方面,H2Sn可将硫烷硫引入磷酸酶和张力蛋白同系物(phosphatase and tensin homolog deleted on chromosome ten,PTEN)的活性位点的半胱氨酸,使其发生过硫化修饰来调节其抑制肿瘤的活性[11]。对于蛋白质H2Sn也可以通过过硫化修饰来抑制其活性,例如甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)中152 号位点的半胱氨酸(cysteine,Cys)可在H2Sn的作用下发生过硫化,使其活性降至42%[12]。H2S 具有血管舒张和体内血压降低的生理作用,但分子机制已证明实际上是H2S 在氧气和酶的作用下迅速转化为多硫化氢,利用其氧化性诱导形成二硫化物激活环磷酸鸟苷依赖性蛋白激酶1α(cyclic guanosine monophosphate-dependent protein kinase 1α,PKG1α),从而发挥松弛血管平滑肌的作用[13]。在生命系统中H2Sn与H2S 互为氧化还原对,共同调节体内的氧化还原水平。其中作为氧化产物的H2Sn也可以降低细胞内ROS 水平,发挥抗氧化应激保护细胞的作用。这主要是由于H2Sn可促进核因子红细胞2 相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)的释放,并通过过硫化其负调节因子Kelch 样ECH 相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)诱导Nrf2易位至细胞核,随后上调细胞内还原型谷胱甘肽(reduced glutathione,GSH)水平和Nrf2 调节抗氧化因子血红素氧合酶1(heme Oxygenase-1,HO-1)的表达[14]。总之,随着对H2S 作用机制的研究深入,H2Sn被认为可能是信号传导的真正调节因子。因此,开发监测生命系统中H2Sn的新技术对于理解其在生理学和病理学中的贡献至关重要,同时也为相关疾病的治疗开发提供新的研究途径。
1 传统的多硫化氢检测方法
H2Sn的检测方法当前主要有质谱法、紫外光谱法、高效液相及气相检测、荧光探针检测等方法(图1)。质谱法可直接在水溶液或单溴二胺(monobromobimane,mBB)中检测 H2Sn,但该方法不适合在近中性的pH 下检测,且生成的衍生物在检测过程中不稳定[15-16]。H2Sn也可使用光谱方法进行检测,在300 nm 和372 nm 处的紫外吸收峰可直接用于H2Sn的测定,或通过GaAs电极用原位紫外-可见光谱电化学进行H2Sn氧化/再生过程进行检测[17]。此方法操作简捷,但是受到低的灵敏度的限制且需要在碱性条件下进行。此外,H2Sn可和还原剂二硫苏糖醇(dithiothreitol,DTT)反应生成H2S[18]、与氰离子结合生成稳定的巯基化合物和硫氰酸盐[19]、与三苯基膦(triphenylphosphine,TPP)生成硫代三苯基氧化膦[20]以及与碘代乙酰胺形成稳定的二硫化物[21],再通过高效液相或气相、质谱等方法间接检测来达到检测目的。但这些方法特异性较差,其他硫烷硫化合物也可以给出阳性结果,导致多硫化氢的检测出现误差。总之,以上这些方法局限性较大,不适用于实时检测生物体内的H2Sn。相比之下,H2Sn荧光探针因其具有灵敏度高、特异性好、操作快捷、能在生物体内能实时监测以及对生物样品无损伤或损伤低等优点,已被广泛用于活细胞和组织中进行实时的 H2Sn生物学研究。
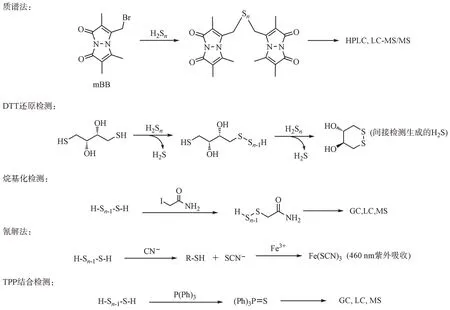
图1 传统的H2Sn检测方法
2 检测多硫化氢的荧光探针
基于H2Sn的理化性质,现今主要的H2Sn荧光探针设计策略主要分为以下6类:(1)基于与2-巯基苯甲酸酯的硫交换反应;(2)基于与硝基或苯醌的还原反应;(3)基于与2-氟苯甲酸酯、2-(苯甲酰硫基)苯甲酸苯酯的亲核反应;(4)基于迈克尔加成反应;(5)基于氮丙啶环的开环反应;(6)基于脱除硝基苯磺酰保护基团的反应。下文主要按照响应机制的反应类型,介绍总结近年来各类定性定量检测H2Sn的荧光探针,着重概述各类荧光探针的设计策略及在生物体内的应用,并讨论当前所存在的挑战及未来的应用前景。
2.1 基于硫交换反应的荧光探针
H2Sn归属于硫烷硫化合物,具有硫代亚砜互变异构体,这种特性使其具有高反应性与不稳定性。其硫代亚砜互变异构体上的硫羰基具有一定的亲电性,可以很容易与巯基发生硫交换反应[22]。基于此,Chen 等[23]构建了一种2-巯基苯甲酰类的H2Sn检测荧光探针(1 和2)。H2Sn可与荧光探针上的巯基等亲核基团发生硫交换反应形成过硫化物中间体,裸露的巯基随后可快速发生的分子内环化生成苯并二硫化合物的同时释放出荧光基团(图2)。荧光探针1 和2 均具有较高稳定性且都显示出低荧光量子产率(分别为0.06 和0.05),加入H2S 后探针1 和2 的荧光强度分别提升25 倍与50 倍,且能在5 min 内达到最大荧光强度。此外,探针1 和2具有高灵敏度,其检测限分别为73 nmol/L 和32 nmol/L。该探针对H2Sn具有一定的特异性,能避免生物硫醇、H2S 及含硫无机盐的影响。但多硫化物与元素硫仍可与该探针反应,引起探针的消耗及荧光基团的释放对检测造成干扰。
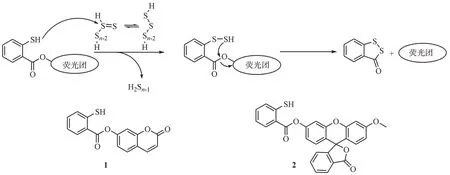
图2 硫交换反应类荧光探针1和2的结构及响应机制
2.2 基于还原反应的荧光探针
相对于生物硫醇及H2S 等化合物,H2Sn具有更强的还原性可以有效还原硝基为氨基或苯醌为苯酚[24]。因此,H2Sn可通过调节反应前后化合物电子云密度的差异可以有效改变荧光探针的荧光波长及强度。Chung 等[25]基于此机制构建了一种基于萘酰亚胺骨架的双光子荧光探针3,可用于检测溶液和活细胞中的H2Sn(图3)。该探针由于存在分子内电荷转移(intramolecular charge transfer,ICT)效应[26]具有较低的荧光背景,当H2Sn接触后可以将吸电子的硝基还原为给电子的氨基,从而消除ICT效应使探针在540 nm 波长处发射强烈黄色荧光。探针表现出优异的荧光性能及良好的稳定性,对H2Sn的选择性高于其他含硫化合物。此外,荧光成像显示探针具有较好的细胞通透性,适合于可视化监测活细胞中的H2Sn。
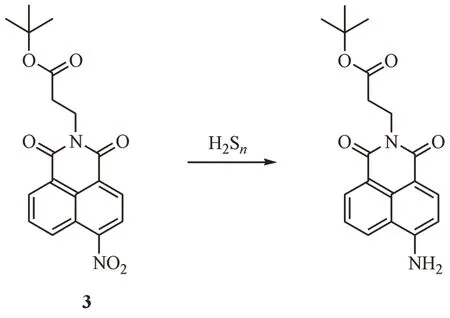
图3 还原反应类荧光探针3的结构及响应机制
吸附于硅胶上的萘酚暴露于空气时可发生氧化生成醌类化合物,且这一反应在水溶液中具有更高的效率[27]。因此,Qiu 等[28]推测并证明含有萘酚结构6,7-二羟基苝-1,12-醌上的羰基可被H2Sn特异性还原,从而构建了一种H2Sn的可逆荧光探针4(图4)。由于存在激发态分子内氢转移(excitedstate intramolecular proton transfer,ESIHT)效应[29],探针处于非荧光状态。而H2Sn可特异性还原探针上的羰基生成酚羟基的化合物,抑制了ESIHT 效应重新生成高荧光的苝核,使490 nm 处出现显著的发射峰。此外该探针具有可逆性,酚羟基可在次氯酸的作用下氧化为醌从而消除荧光。该探针可用于量化检测H2Sn,检测范围为2 ~20 µmol/L,其检测限为18.2 nmol/L。探针具有较好特异性,可在H2S、GSH、Cys 等其他活性硫化合物中选择性检测H2Sn。这种可逆荧光探针为研究H2Sn在生理病理过程以及细胞氧化还原调节过程中的可逆波动提供了一种潜在的检测方法。
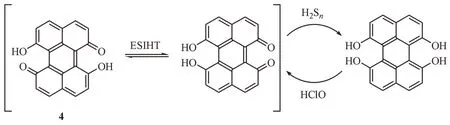
图4 还原反应类荧光探针4的结构及响应机制
基于还原的荧光探针可有效检测H2Sn,为探针的开发提供了一种新的构建思路。但由于H2S 与H2Sn相似的化学性质,在检测过程中H2S 的也会引起荧光信号的变化从而干扰H2Sn的追踪检测。因此,该类探针目前在实际应用方面存在较大改进空间。
2.3 基于亲核取代反应的荧光探针
由于存在α 效应,H2Sn在水溶液中呈现弱酸性(pKa为3 ~ 5),而H2S 和Cys、GSH 等生物硫醇在水溶液中呈现近中性与弱碱性(pKa分别为7.0、8.3、9.2)[30]。因此在弱碱性的生物体内(pH 为7.35 ~7.45)H2Sn更易电离为硫氢负离子形式,相比于H2S与生物硫醇具有更强的亲核性。基于H2Sn的亲核性,Liu 等[31]提出了一种以双亲电子的2-氟苯甲酸酯基为响应基团的检测策略(图5):H2Sn首先亲核进攻2-氟苯甲酸酯基上的氟原子形成过硫化物中间体,随后经历分子内快速环化形成苯并二硫酮化合物并引起酯键的断裂,若与荧光分子连接便可以通过调节分子内电子云分布达到荧光强度的变化。虽然2-氟苯甲酸酯基也可以与Cys 和GSH等生物硫醇发生反应,但生成的硫醚中间化合物不能进一步发生分子环化生成苯并二硫酮并引起酯键的断裂。生物硫醇形成的硫醚化合物可与H2Sn进一步发生硫交换反应转换为过硫化物,继而经历分子内环化并引起酯键的断裂。此外,当氟原子的对位连接上吸电子基团(-CN 和-NO2)时其反应速率显著提升,以硝基为吸电子取代基团时具有最佳的反应速率与产率。
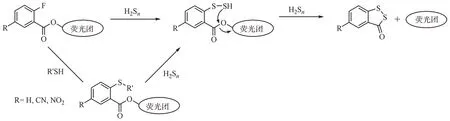
图5 亲核反应类H2Sn荧光探针的设计策略
基于以上策略,Liu 等[31]继而构建了以荧光素为母环的一系列荧光探针,其中双2-氟-5-硝基-苯甲酸酯基连接的荧光探针5 具有良好的荧光性能及H2Sn响应能力(图6)。由于荧光素母环上的酚羟基均被掩蔽,该荧光探针具有低的荧光背景,当H2Sn存在时其荧光强度与时间呈依赖性上升,5 min 内增长137 倍。该探针具有高灵敏度(检测限为71 nmol/L),能够选择性地检测H2Sn并且避免多硫化物和元素硫等化合物的干扰。此外,作者将HeLa细胞与探针孵育20 min后再用接触H2Sn可在细胞中诱导出强烈荧光。相比之下,用H2S处理的细胞没有显示出明显的荧光,验证了该探针可用于活细胞内H2Sn的检测。
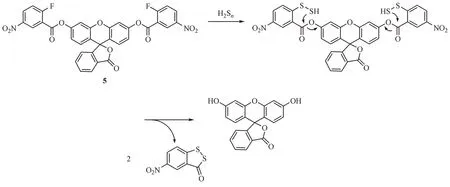
图6 亲核反应类荧光探针5的结构及响应机制
溶酶体作为细胞中的“消化系统”对生物降解、自噬和稳态调节有很大影响,且溶酶体中含量丰富的酶及活性氧与H2Sn体内生成代谢息息相关[32],急需相应的定位检测方法来探究它们之间的联系。Ren 等[33]开发了一种基于咪唑并[1,5-a]吡啶骨架的新型溶酶体靶向探针6,用于测定细胞溶酶体中的内源性的H2Sn(图7)。由于存在光诱导电子转移(photoinduced electron transfer,PET)效应[34],探针处于非荧光状态,当与H2Sn反应后吸电子基团离去导致PET 效应消除而恢复荧光。该探针由于存在叔胺结构呈现弱碱性,可使其能够有效靶向酸性的溶酶体。研究结果显示,探针可以在生物硫醇选择性地识别H2Sn,且具有低检测限(84 nmol/L)、大斯托克斯位移(215 nm)、快速响应时间(< 6 min)和低细胞毒性。此外,探针成功应用于活细胞溶酶体中的内源性H2Sn的检测。
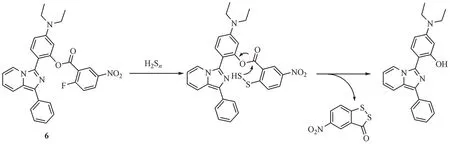
图7 亲核反应类荧光探针6的结构及响应机制
Liu等[35]开发了一种以二氢小檗碱为荧光基团的探针7,可用于多种环境下食品样品和活细胞中H2Sn的检测(图8)。该探针具有高灵敏度和选择性,对H2Sn的响应可在15 min 内完成且不受活性氮、活性氧、过硫化物和生物硫醇等的干扰。探针7 无论是在水溶液还是固态下贮存,都具有良好的稳定性。此外,在较宽的pH 范围(pH 7.0 ~ pH 11.0)和温度范围(25 ~ 45 ℃)内,探针7都能有效发挥H2Sn检测作用,适用于多种复杂环境下的H2Sn检测。更重要的是,探针7使用的荧光基团二氢小檗碱来源于天然化合物,使其对生物体的毒性可降至最低,生物成像实验也表明该探针成功实现了剂量依赖性监测活细胞中的H2Sn。
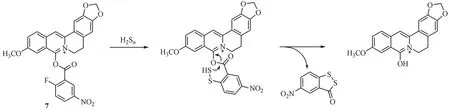
图8 亲核反应类荧光探针7的结构及响应机制
Liu等[36]构建了一种双通道的比率型荧光探针8,能够精确地获得分析物浓度并降低检测过程中的系统误差。该探针以2-氟-5-硝基苯甲酸酯基作为H2Sn的响应单元,同时将6-羟基-2-萘甲酸和4-取代-1, 8-萘酰亚胺之间通过哌嗪连接作为荧光信号单元(图9)。由于2-氟-5-硝基苯甲酸酯基团引起的ICT效应,探针中4-取代-1, 8-萘酰亚胺部分的荧光被淬灭。同时,因为存在荧光共振能量转移(fluorescent resonance energy transfer,FRET)效应[37],仅有电子受体基团6-羟基-2-萘甲酸在526 nm波长处发射绿色荧光。在H2Sn存在下,2-氟-5-硝基苯甲酸酯被切断从而恢复4-取代-1, 8-萘酰亚胺在450 nm 波长处的荧光,同时在FRET 效应的作用下分子内供体与受体基团的荧光强度均显著增强。此外,I450nm/I526nm的荧光比与低浓度的H2Sn(0 ~10.0 nmol/L)之间存在良好的线性关系,其检测限低至40.3 nmol/L,可实现H2Sn在体内及体外的定量检测。该探针易于制备,具有快速响应、高选择性与灵敏度以及显著的荧光比率增强等优点。此外,该探针具有较好的生物安全性,可用于对活细胞和斑马鱼中的H2Sn成像。
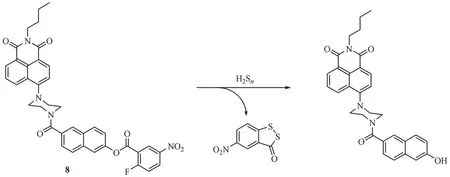
图9 亲核反应类荧光探针8的结构及响应机制
虽然2-氟-5-硝基苯甲酸酯类荧光探针具有高选择性,但该类探针仍会与生物硫醇反应。尽管这一反应不会引起荧光基团的释放造成检测结果的误差,但生物体内含量丰富的硫醇会造成探针的大量消耗,实际应用时可能需要较高浓度的探针来检测生命系统中的H2Sn,这使其在生物成像应用中可能存在一定局限性。为了解决这一缺陷,Ma 等[38]构建了一种以2-(苯甲酰硫基)苯甲酸苯酯为响应基团的荧光探针9,能够选择性地从活性硫物质中检H2Sn。该探针的响应机制如下(图10):H2Sn首先作为亲核试剂攻击2-(苯甲酰硫基)苯甲酸苯酯与之发生酯交换反应,形成的含有裸露巯基中间化合物与H2Sn发生硫交换反应形成氢化过硫化物中间体,随后通过分子内的关环反应释放荧光基团和副产物苯并二硫酮。由于母环上的酚羟基以酯键形式被掩蔽,探针具有低的荧光背景。当添加H2Sn后,探针在640 nm 波长处的荧光发射在10 min 内逐渐增至最大强度,且与游离的探针相比其增幅大于1 000 倍。此外,该探针对于低浓度范围内的H2Sn(0 ~ 20 µmol/L)具有良好的线性关系,检测限为6.7 nmol/L。探针9 的检测限低于大多数H2Sn探针,表明该探针可能用于追踪活生物体中低浓度水平的H2Sn。基于硫酯裂解的荧光探针对H2Sn具有高特异性及敏感性,而且由于生物体内的近中性水相环境,生物硫醇难以亲核进攻硫酯键使其发生分解,有效解决了生物硫醇对探针的消耗这一问题。但探针中因涉及酯键与硫酯键等易水解的结构,在体内代谢循环过程中可能会受到体内酯酶的影响发生裂解影响探针的检测。
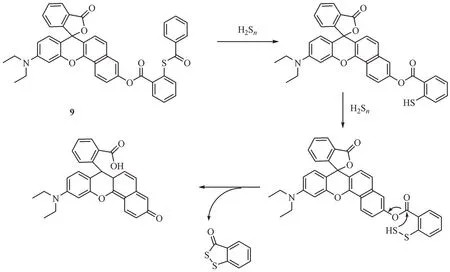
图10 亲核反应类荧光探针9的结构及响应机制
2.4 基于开环反应的荧光探针
Chen 等[39]报道了一种基于氮丙啶开环反应的H2Sn检测荧光探针10,该探针分别以氮丙啶和强荧光的丹磺酰基作为识别单元和信号单元(图11)。与氮丙啶连接时,由于存在扭曲的分子内电荷转移(twisted intramolecular charge transfer,TICT)效应[40],丹磺酰基团会发生荧光猝灭或使其荧光强度减弱。而H2Sn能打开氮丙啶环的三元环使其形成二硫化合物,消除TICT效应使探针发射强烈荧光,使530 nm 处的荧光强度急剧增加,并伴随着显著的颜色变化。探针的检测限为0.3 µmol/L,对H2Sn具有高度特异性,接触H2Sn后,可在15 min 内达到最大荧光强度。该探针在水性缓冲液中是具有一定的稳定性,能在较宽的pH 范围内(pH 6 ~ pH 10)有效发挥检测作用。此外,该荧光探针具有良好的双光子光物理特性,可在固态下可以发光,这使其在固态照明设备中具有一定的应用前景。虽然此类探针对H2Sn表现出高选择性且不与生物硫醇反应造成探针的消耗,但由于其激发波长(λex= 350 nm)较短易受到血液中的蛋白、脂质及水的吸收干扰,阻碍了其在生物成像研究中的应用。
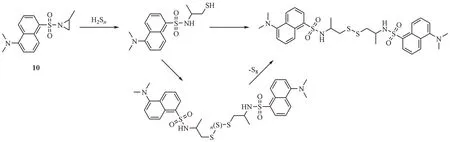
图11 开环反应类荧光探针10的结构及响应机制
2.5 基于迈克尔加成反应的荧光探针
H2Sn检测探针多以2-氟-5-硝基苯甲酸酯和2-(苯甲酰硫基)苯甲酸苯酯作为检测基团,但这些官能团往往也能与细胞内部丰富的生物醇和水解酶发生反应,干扰H2Sn的检测同时消耗荧光探针。为了降低其他硫烷硫化合物的干扰,同时解决由于探针溶解度差、浓度波动大、光稳定性差等缺陷,Li 等[41]报告了一种通过键能转移(through bond energy transfer,TBET)效应[42]的比率型荧光探针11(图12)。该探针的设计理念包括以下3 点: (1)基于稳定的亲电受体筛选识别位点,使H2Sn可特异性发生迈克尔加成反应并随之形成螺环结构,从而改变分子的荧光波长与发射强度;(2)构建比率型探针,实现单波长激发对H2Sn的精确检测;(3)利用纳米粒子的自组装,提高了探针的选择性、光稳定性和水溶性。探针11 分别在355 nm 和565 nm 处具有两个分离良好的激发峰,并对应在486 nm 和591 nm处有相应发射峰。H2Sn加入后抑制了TBET过程致使486 nm 处的荧光逐渐增加,591 nm 处的荧光逐渐降低,达平衡后其荧光增幅比为59(I486nm/I591nm)。随后,作者将小分子比率探针11 包裹在基于两亲性共聚物的自组装纳米粒子(mPEG-PPGPEG)中,以构建有机纳米探针(PPG-Np-RhPhCO)。其中,PPG-Np-RhPhCO 平均流体动力学尺寸为33 nm,在H2Sn存在下可表现出21 倍的信号比(I486nm/I591nm),并且检测限低至9.4 nmol/L。此外,由于存在物理阻断效应,纳米探针PPG-Np-RhPhCO 对生物硫醇及Cys、GSH、CysSSH 和谷胱甘肽过硫化物(glutathione persulfide,GSSH)等多硫化物显示出低响应,PPG-Np-RhPhCO 还可在较宽的pH 范围(pH 4.0 ~ pH 11.0)内对H2Sn进行检测,具有良好的稳定性及生物相容性。此外,纳米探针PPG-Np-Rh-PhCO 对H2Sn成像的能力通过活细胞、斑马鱼和肝组织中的双光子成像得到进一步证实。
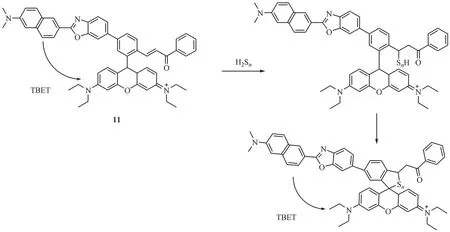
图12 迈克尔加成反应类荧光探针11的结构及响应机制
该类探针为H2Sn探针的开发提供了一种新的思路,由于其良好的荧光响应,且对含硫无机盐及次氯酸钠等氧化剂无显著响应等优点,可作为实时追踪检测H2Sn的良好工具。但Cys、GSH 等生物硫醇以及H2S均可引起该探针荧光强度不同程度的上升,在生物体内应用时会造成一定程度的干扰。
2.6 基于脱保护基团反应的荧光探针
基于保护-脱保护原理,Tsukamoto 等[43]设计合成了一类H2Sn荧光探针12[43]。该系列探针以含有不同取代基的苯磺酰基团保护2',7'-二甲基荧光素构建而成,H2Sn作为亲核试剂可以有效脱去苯磺酰保护基使探针显示强烈荧光(图13)。经荧光响应性能筛选实验发现,2-硝基苯磺酰基作为荧光素羟基的保护基团所设计的探针具有较高选择性和灵敏度,其中探针12-3 在特异性、敏感度和背景信号等方面表现出最优的性能。当加入H2Sn后,探针12-3 的荧光强度迅速上升,且在20 min 内达到最大值,其检测限为9.2 nmol/L。为了降低探针的背景强度,作者尝试用2-硝基苯磺酰基进行双保护,但构建的探针选择性均低于探针12-3。此外,由于探针12-3 较差的膜渗透性难以应用于生物成像,作者基于探针12-3 构建了其乙酰化衍生物探针13。激光共聚焦实验证明探针13具有良好的细胞渗透性,可用于细胞中H2Sn的可视化检测。
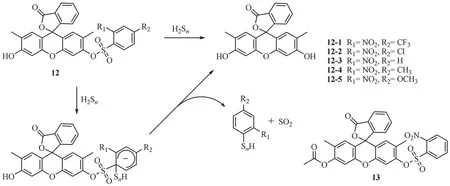
图13 脱保护反应类荧光探针12的结构及响应机制
3 总结与展望
多硫化氢的荧光探针经过10多年的发展已取得许多进展,但在实际应用方面还存在诸多挑战。其中最核心的问题在于,目前报道的探针弹头设计都是基于多硫化氢的亲核性和还原性,然而由于生物体内复杂的生理环境,包含种类多样且浓度较高的亲核物质和还原物质的干扰,导致这类弹头的特异性和灵敏度都很难满足实际应用的需求,因此在使用这类探针过程中,同时使用多种类型的对照实验是非常有必要的,当然更直接能解决这一难点的方式是研发新型的响应弹头,从而构建特异性更好、敏感度更高的荧光探针。
生物正交化学是一类可以在生物环境中发生的特定化学反应,不会破坏生物分子的活性或干扰生化过程,该类反应具有反应速度快、产物转化率高、生物相容性好等优点[44-45]。本课题组在长期多硫化物供体和探针的研究探索中发现,多硫化氢可以特异性地与一些生物正交元件发生的快速、高效的反应,而且这类反应不受生物氨基、羟基和硫醇等亲核性与还原性物质的干扰。因此,有望以此为基础开发新型生物正交响应型弹头,为多硫化氢荧光探针的研发提供新的研究方向。
综上所述,本文主要概述了近年来检测H2Sn的荧光探针,针对其响应机制、荧光性能与生物应用等方面进行了总结与归纳,并结合本课题的工作对多硫化氢荧光探针的开发提出了新的设计理念,与此同时,也期待将小分子H2Sn荧光探针与新兴的生物信息材料等技术相结合,突破在生物体内H2Sn的精准实时监测这一挑战,为深入研究H2Sn的功能机制及开发相关药物提供新的途径。

