遗传密码子拓展技术在赖氨酸酰化修饰研究中的应用
孔 影,叶 慧,邵 畅,2*,郝海平**
(1中国药科大学药物代谢动力学重点实验室,南京 210009;2深圳市罗湖区人民医院药学部,深圳 518005)
蛋白质翻译后修饰(post-translational modifications,PTMs)是一种通过在蛋白质的亲核氨基酸侧链上添加功能基团,进而调节蛋白质的稳定性、酶活性、亚细胞器定位、蛋白质-蛋白质相互作用和蛋白质-DNA 相互作用的调控方式[1-4]。越来越多的研究表明,PTMs在调节基因转录[5]、细胞信号传导[6]和代谢[7]等多种生物学过程中发挥着重要作用。迄今为止,超过400种不同类型的PTMs被报道[8]。
在众多PTMs 中,赖氨酸酰化修饰由于其调控丰富的生物学事件一直受到研究人员的广泛关注。早在20 世纪60 年代初,人们首次发现组蛋白乙酰化可调节基因转录。随着代谢组学和蛋白质组学的发展,组蛋白赖氨酸残基上的新型酰化修饰相继被发现,主要包括巴豆酰化[9]、丙酰化[10]、丙二酰化[11]、琥珀酰化[12]、戊二酰化[13]、β-羟基丁酰化[14]、二羟基异丁酰化[15]、苯甲酰化[16]和乳酰化[17]。赖氨酸酰化修饰多数以酶促反应形式发生,在酶促条件下,酰基转移酶介导修饰的发生,而去酰化酶则负责酰化基团的去除。由于所有的酰基化供体均来自内源性代谢物,同时代谢物还可以通过调节酰基转移酶或去酰化酶的活性,影响蛋白质的酰化修饰水平,因此研究蛋白质酰化修饰有助于理解生理和病理状态下的代谢调节机制,进而发现与肿瘤、心血管疾病、代谢性疾病、炎症和感染性疾病相关的治疗靶点。
然而,研究酰化修饰的功能在技术层面仍然存在挑战。首先,蛋白质的酰化修饰在细胞中是动态且可逆的,同时受酰基转移酶和去酰化酶调控;其次,一个蛋白中往往存在同一酰化修饰的多个修饰位点或者同一位点存在多种酰化修饰,而酰化修饰的酰基转移酶或去酰化酶可能是保守的,对酶的调控往往导致对蛋白酰化修饰产生广泛的影响。因此,无论是体外重组蛋白或是在细胞内都很难获得特定位点携带特定酰化修饰的蛋白形式,这导致对酰化修饰的生物学功能研究变得困难。目前,研究人员常用定点突变技术在修饰位点模拟酰化修饰,比如使用谷氨酰胺模拟赖氨酸乙酰化的电中性,或者将赖氨酸突变成精氨酸模拟去修饰后的正电性,但这些方法只能模仿修饰的电子效应,而不能模仿其空间效应。此外,研究人员也尝试用化学蛋白质合成的手段将修饰位点特异性地引入到目的蛋白中,但也受限于特定的化学反应条件[18-19]。
为了解决上述局限性,研究人员开发出了遗传密码子拓展(genetic code expansion,GCE)技术,能够向蛋白质特定位点引入酰化修饰,这为酰化修饰的功能研究提供了革命性的技术手段。GCE 技术通过将目的蛋白mRNA 的特定位点突变为终止密码子,设计并合成含酰化修饰的UAA,利用生物正交的氨酰tRNA 合成酶(aminoacyl-tRNA synthetase, aaRS)和转运RNA(transfer RNA, tRNA)生成能结合UAA 的氨酰化tRNA,通过识别mRNA 上的终止密码子将UAA 并入核糖体的延伸肽链上,实现在蛋白的特定位点引入特定的酰化修饰(如图1)。该方法的优势在于可以在生理条件下利用内源性加工和折叠机制产生位点特异性的酰化修饰,模拟天然酰化修饰蛋白的化学结构和功能变化,有助于解码酰化修饰调控的生物学过程[20-21]。
目前,已有多种与天然酰化修饰结构一致的UAA 通过GCE 技术引入目的蛋白,用于精准阐明该修饰对目的蛋白的活性、稳定性、亚细胞定位、蛋白质-DNA 相互作用和蛋白质-蛋白质相互作用等方面的影响。此外,研究人员还设计出不能被内源性去酰化酶识别的各种酰化修饰的类似物UAA,以保证GCE 技术构建的蛋白赖氨酸酰化修饰产物的稳定性。在模拟酰化修饰的UAA 上加入光交联基团还能用于捕获酰化修饰蛋白的互作蛋白。本文将根据UAA 结构和类别的不同分别举例说明GCE 技术在研究蛋白酰化修饰及其调控的生物学功能方面的应用(如图1)。
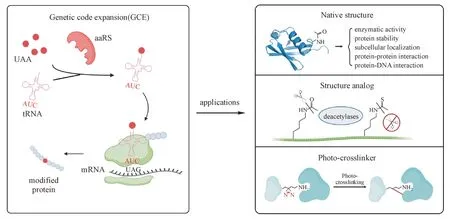
Figure 1 Scheme for the genetic code expansion(GCE) and its applications in studying lysine acylation
1 引入天然修饰结构
通过GCE技术,实现了向目的蛋白特定位点引入特定的酰化修饰,进而精准阐明该修饰对目的蛋白的活性、稳定性、亚细胞定位、蛋白质-DNA 相互作用和蛋白质-蛋白质相互作用等方面的影响。
1.1 酶活性
近年来研究表明,酰化修饰广泛修饰哺乳动物组织和细胞的多种代谢酶[22],这些修饰对酶活性的具体影响成为本领域的重要研究方向,而应用GCE 技术回答特定位点的酰化修饰对代谢酶活性具体影响的研究屡见不鲜。
例如,Wan等[23]首次发现了乳酰化赖氨酸肽段在质谱分析过程中形成的乳酰化赖氨酸的特征离子-环状亚胺离子(图2-A)。基于该诊断离子的灵敏度和特异性,研究人员发现乳酰化修饰高度富集在糖酵解通路的代谢酶中,其中果糖二磷酸醛缩酶A(fructose-bisphosphate aldolase A, ALDOA)的K147 位点修饰丰度最高。鉴于晶体结构显示K147位点在ALDOA 底物结合位点,因而对酶活可能产生影响,Wan 等通过GCE 技术在人源ALDOA的147 位点引入了UAA——乳酰化赖氨酸(lactyllysine, Klac),成功构建了147位点乳酰化的ALDOA(Klac147-ALDOA)。通过对野生型ALDOA(WTALDOA)和Klac147-ALDOA的酶活性测定,证实了K147 位点发生乳酰化后可以显著降低ALDOA 的酶活性。以上研究结果揭示了一条全新的负反馈通路,如图2-B 所示,即当糖酵解途径被过度激活产生乳酸蓄积后,上游代谢酶如ALDOA 发生乳酰化,酶活性受到抑制,糖酵解通量下降,乳酸水平降低。

Figure 2 Cyclic immonium ion of lactyllysine reveals lactylation on K147 reduces enzymatic activity of fructose-bisphosphate aldolase A (ALDOA)A: Production pathway of the CycIm immonium ions from lysine lactylated peptides; B: Illustration of lactylated ALDOA regulates a negative feedback loop in glycolysis
此外,Venkat 等[24]也通过GCE 技术探究了乙酰化对异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)的活性影响。IDH 是三羧酸循环中的一种关键性限速酶,负责催化异柠檬酸转化为α-酮戊二酸和二氧化碳。为了研究乙酰化对IDH 功能的影响,研究人员分别在8 个位点引入乙酰化修饰,结果表明不同位点的乙酰化对IDH 的活性影响存在差异。其中,K55、K142、K177、K242、K350 位点的乙酰化使IDH 活性增强,相反,K100、K230、K235位点的乙酰化则降低了IDH 的活性。Chen 等[25]的研究则通过定点引入乙酰化赖氨酸探索了乙酰化调控核糖核苷酸还原酶(ribonucleotide reductase,RNR)的机制。RNR通过催化脱氧核糖核苷二磷酸(deoxyribonucleoside diphosphates,dNDPs)的从头合成,调控DNA 的合成速率,在各种肿瘤中均呈现高表达。研究人员通过GCE技术发现RNR的大亚基RRM2 上K95 位点的乙酰化会抑制其形成同型二聚体的能力,进而下调RNR 的酶活性,阻碍DNA的合成,从而抑制体内肿瘤的生长。
1.2 蛋白稳定性
线粒体代谢酶丝氨酸羟甲基转移酶2(serine hydroxymethyltransferase 2, SHMT2)是一种相对稳定的丝氨酸/甘氨酸转换酶,研究表明SHMT2 的高表达与肿瘤的侵袭以及预后相关[26]。Wei等[27]通过定点引入乙酰化修饰,发现结肠癌细胞中SHMT2的稳定性随着K95 位的乙酰化程度增加而降低,并且该过程依赖于溶酶体自噬,推测SHMT2 中K95 位的乙酰化能促进其降解。经亲和纯化和质谱分析发现SHMT2 与E3 泛素连接酶TRIM21(tripartite motif-containing protein 21)存在相互作用,表明SHMT2 的K95 位点乙酰化可能通过TRIM21 介导的泛素-溶酶体途径促进SHMT2 的降解,提示诱导SHMT2 的K95 位点乙酰化可能成为治疗结肠癌的手段。另一个研究案例则关注糖酵解通路中的关键酶磷酸甘油酸脱氢酶(phosphoglycerate dehydrogenase, PHGDH)。该酶在三阴性乳腺癌中高表达。Wang等[28]运用GCE技术发现乳腺癌细胞中的PHGDH 的K58 位点乙酰化可以通过干扰PHGDH 与E3 泛素连接酶RNF5(ring finger protein 5)的相互作用,抑制PHGDH 的降解,导致其高表达,促进乳腺癌细胞的增殖。
1.3 亚细胞定位
乙酰化修饰调控许多底物蛋白的亚细胞定位,如S期激酶相关蛋白2(S-phase kinase associated protein 2, Skp2)。其核定位信号(nuclear localization signal, NLS)上的乙酰化会促进Skp2 在胞质滞留,导致细胞有丝分裂阻滞并成为多倍体,导致肿瘤的发生[29]。类似地,Knyphausen 等[30]运用GCE 技术研究了乙酰化修饰对Ras(smallGTPase)蛋白超家族中Ran(GTP-binding nuclear protein)蛋白定位的影响。小GTP结合蛋白Ran是一种穿梭蛋白,参与蛋白质的核质运输。研究人员通过GCE 技术特异性地向Ran引入乙酰化赖氨酸,发现K99位的乙酰化增加了Ran蛋白和转运受体的亲和力,有利于核输入物质的释放和核输出复合物的形成,促进蛋白的核质运输;而将K99 位突变成精氨酸模拟去乙酰化后,细胞中的Ran 则更多地分布在细胞质,阻碍其介导的蛋白的核质运输进程。
1.4 蛋白质-DNA相互作用
在原核生物和真核生物中,赖氨酸酰化修饰的一类重要蛋白质是转录因子。位于转录因子-DNA 结合区域的乙酰化修饰可能通过中和赖氨酸残基的正电荷,阻断转录因子与靶基因DNA 磷酸骨架的相互作用,从而调控靶基因的表达[5]。例如,细菌的反应调节蛋白(regulator of colanic acid capsule synthesis B,RcsB)是一种响应调节因子,参与细胞分裂、鞭毛合成等多种生物过程。Thao等[31]通过GCE 技术在RcsB 的K180 位引入乙酰化后,发现该修饰可以破坏RcsB 与靶基因DNA 的相互作用,使其失去调控基因表达的能力,抑制细菌中荚膜和鞭毛的生物合成。另一个研究案例聚焦造血细胞中一种重要的转录因子GATA-1(GATA binding protein 1)。GATA-1 主要调控红细胞的增殖与分化。Boyes 等[32]通过GCE 技术揭示了GATA-1的乙酰化位点均位于其DNA 结合区域,而乙酰化水平的上升会增强GATA-1与DNA的结合,引起GATA-1 的构象变化,促进GATA-1 在细胞内的转录活性,最终诱导靶基因的表达进而影响细胞的分化进程。
1.5 蛋白质-蛋白质相互作用
蛋白质-蛋白质相互作用是细胞内复杂生物过程的重要组成部分,越来越多的研究表明,酰化修饰在其中发挥着关键的作用。其中,组蛋白翻译后修饰(histone PTMs, hPTMs)可以通过影响染色质的结构和功能,进而调控其与酰基转移酶、酰基阅读蛋白及去酰化酶的相互作用,最终调节基因表达。因此,特异性识别hPTMs 的酰基转移酶、酰基阅读蛋白及去酰化酶对于表观遗传研究至关重要。Huang 等[33]将GCE 技术与过氧化物酶(ascorbate peroxidase, APEX2)介导的邻近标记方法相结合,用于探究活细胞中hPTMs 的相互作用蛋白。如图3 所示,研究人员利用GCE 技术成功构建了融合表达APEX2 的巴豆酰化组蛋白H3K9cr-APEX2,在加入生物素-苯酚和过氧化氢后,APEX2 催化生物素-苯酚产生高反应活性的生物素-苯氧基自由基,该自由基能够与目的蛋白邻近蛋白的富电子残基共价结合,通过定量蛋白质组学对生物素化的蛋白进行富集和表征,共筛选出146 个H3K9cr 的候选互作蛋白,其中包含去酰化酶HDAC2(histone deacetylase 2),这与之前报道的Ⅰ类组蛋白去乙酰化酶是主要的组蛋白去巴豆酰化酶结果一致。该分析方法综合运用了GCE 技术、邻近标记和定量蛋白质组学,为在活细胞中绘制hPTMs 的相互作用蛋白谱提供了新工具。

Figure 3 Schematic illustration of the workflow for proteomic mapping of histone post-translational modification(hPTM)interactors via the genetically encoded histone mark and APEX2-mediated proximity labeling in vivo
2 引入酰化修饰类似物
蛋白的酰化修饰是一种可逆的动态过程,生物体内存在着多种去除酰化修饰的酶。为了保证GCE 技术引入蛋白赖氨酸酰化修饰产物的稳定性,研究人员创新性地设计出不能被内源性去酰化酶识别的酰化修饰类似物来抵抗去酰化修饰这一过程。如图4-A 所示,Zhang 等[34]设计并合成了一种UAA 三氟乙酰赖氨酸(trifluoroacetyl-L-lysine,TFAcK),利用GCE 技术成功在p53 的K164 位点插入了TFAcK 以模拟赖氨酸乙酰化修饰,而该修饰无法被去乙酰化酶sirtuin1 和sirtuin2 识别。进一步,通过19F NMR 技术发现插入TFAcK 的p53 与DNA 相互作用会引发p53 的整体构象变化。相似地,Xiong 等[35]用硫原子取代羰基氧合成了硫乙酰赖氨酸(thioacetyl-lysine, ThioAcK),不同于乙酰基赖氨酸AcK(acetyllysine),ThioAcK 不能被组蛋白去乙酰化酶sirtuin1水解。研究人员成功将AcK和ThioAcK 同时插入到人组蛋白H3 中,为研究组蛋白乙酰化的生物学功能提供了有力工具。
除了乙酰化修饰外,Zhang 等[36]通过引入稳定的丁酰化赖氨酸类似物(lysine butyrylation mimic,bmK)来探究鼠伤寒沙门氏菌中转录因子HilA 上特异性位点的丁酰化作用(如图4-B),发现HilA 上K90 位点插入模拟丁酰化的bmK 会抑制SPI-1(salmonella pathogenicity island-1)的基因表达,并减弱细菌对上皮细胞的侵袭,而用传统研究思路生成的K90Q 突变体则无法模拟HilA K90 丁酰化的效果,这也突出表明了GCE 技术可以模拟天然PTMs的优势。

Figure 4 Structures of acylated unnatural amino acids and their analogs
3 引入“光交联”型UAA
通过GCE 技术在模型蛋白活性位点上插入“光交联”型UAA,经激光照射后UAA 的光交联基团在活化后能共价结合邻近的氨基酸残基,从而捕获位点特异性插入酰化修饰的蛋白质的相互作用蛋白。例如,Qin 等[37]开发了一种单氨基酸位点分辨的互作蛋白组研究策略site-link,通过结合GCE 技术和蛋白组学技术能够在活细胞内揭示目的蛋白上特定位点不同酰化修饰的互作蛋白组。研究人员首先发现短链脂肪酸显著诱导H3K56 位点的巴豆酰化(lysine crotonylation, Kcr)和β-羟基丁酰化(lysine β-hydroxybutyrylation, Kbhb),由于该位点对于调控核小体的拓扑结构至关重要,因此研究人员开发了6 种不同酰化修饰的“光交联”型UAA,经GCE 技术定点引入组蛋白后,发现即使在同一位点,不同酰化修饰形式的组蛋白结合的蛋白谱也存在差别。聚焦组蛋白H3 上56 位赖氨酸的Kcr 修饰(如图5),研究揭示其与位于基因组区域的GLYR1(glyoxylate reductase 1 homolog)蛋白存在特异性相互作用。研究人员在不同的时间点进行光交联实验,发现24 h 时巴豆酰化“光交联”UAA 已被插入到组蛋白中,但其与GLYR1 的交联出现在36 h 后,这说明巴豆酰化修饰被编码到组蛋白之后才与GLYR1 产生相互作用。此外,研究揭示组蛋白H3 上56 位赖氨酸的Kbhb 修饰与超级增强子调控因子BRD4(bromodomain-containing protein 4)存在相互作用,且两者共定位于超级增强子上,继而推测H3K56bhb 定点修饰可能通过超级增强子调节基因转录。该研究揭示了组蛋白位点特异性修饰对基因转录的调控机制,也展示了GCE技术的巨大应用前景。

Figure 5 Schematic overview of the site-link toolkit design strategy
反之,除了在酰化修饰蛋白上插入“光交联”型UAA 外,还可以在酰化修饰的酰基转移酶、酰基阅读蛋白及去酰化酶的反应位点附近或写入区内用基因编码的光反应性氨基酸捕捉其天然底物。Sudhamalla 等[38]基于该方法分析了BRD4的相互作用蛋白组。通过将光交联剂4-叠氮-L-苯丙氨酸(4-azidoL-phenylalanine, pAzF)整合到酰基阅读蛋白的疏水性口袋中,在高乙酰化的HEK293T 细胞的裂解液中鉴定到了许多未经报道的BRD4 相互作用蛋白。类似的方法也成功揭示了去乙酰化酶HDAC1和HDAC8的新底物[39]。
4 展 望
随着质谱技术的进步,新型赖氨酸酰化修饰和修饰位点不断被报道,这使得运用GCE 技术进行基因编码赖氨酸酰化修饰的研究不断拓展和深入,为研究经典及新型的赖氨酸酰化修饰对蛋白质的功能、稳定性、相互作用的影响开辟了交叉研究的方向。为了方便检索,本文整理了目前基于GCE技术已报道的各种酰化修饰类型(表1)。
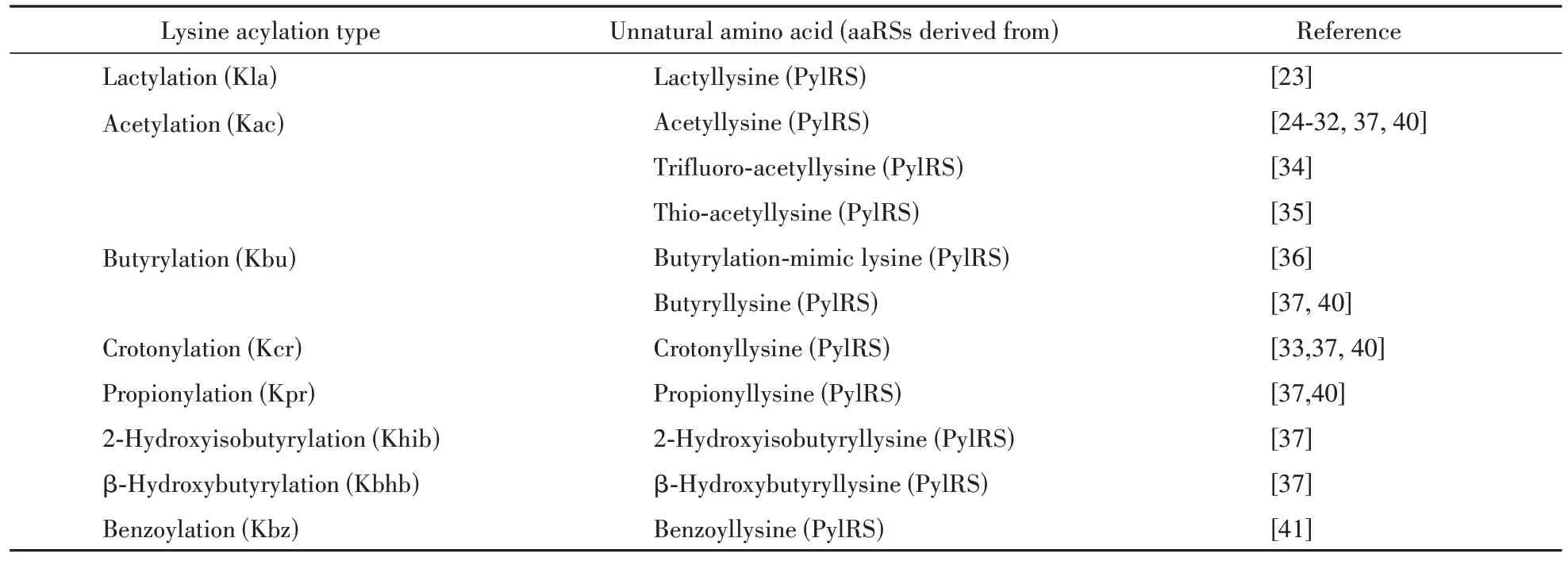
Table 1 An index of genetic incorporation systems for lysine acylation modification
值得注意的是GCE 技术尚未完成对模拟赖氨酸琥珀酰化和戊二酰化修饰的UAA 的基因编码。这是由于GCE 技术需要为每个模拟不同酰化修饰的UAA 筛选生物正交的氨酰tRNA 合成酶/tRNA对,以实现在生物系统中对UAA 的有效插入,这对于体积较大的PTM 可能存在一定的困难。GCE 技术也依赖于足量的UAA 能够进入细胞并不被代谢酶分解,这需要对部分极性较大的UAA 进行结构修饰,以提高其进入细胞的能力。总之,需要进一步优化GCE 技术,提高模拟酰化修饰的UAA 的插入效率,为后续的生物学功能研究提供保障。此外,研究表明蛋白质中往往存在多个发挥协同或拮抗作用的PTMs,因此,迫切需要开发同时将多个PTM 引入特定蛋白的GCE 技术,以进一步揭示PTM 串扰对蛋白质的影响[42]。本课题组将通过对GCE 技术的不断创新与新结构UAA 的合成,增进对蛋白质酰化修饰乃至PTMs的了解与应用。

