度拉糖肽对糖尿病合并轻度单纯夜间高血压患者的血压和EMPs的影响*
袁 彬,张 晶,何胜虎,邱炜炜,黄 辉,冯 凯
(1.江阴市中医院心内科,江苏无锡 214400;2.扬州大学临床医学院/江苏省苏北人民医院心内科,江苏扬州 225001)
高血压是临床上常见的心血管疾病,有研究统计显示,我国成人高血压的患病率为27.9%,老年高血压患者占比高达49.0%[1]。临床往往比较注重控制白天血压,而夜间高血压也是常见的高血压表现,比较隐匿,容易被忽视,且夜间高血压与心血管事件的相关性较高[2]。糖尿病患者由于自主神经功能紊乱,夜间高血压发生率较高。老年患者患高血压合并糖尿病等多种慢性疾病者比例较高,需要联合多种药物治疗。内皮微粒(endothelial microparticles,EMPs)是内皮功能障碍的生物学标志,与高血压的发生、发展相关[3]。度拉糖肽是一种新型的降糖药物,为长效胰高血糖素样肽-1受体激动剂,有研究发现其在降血糖的同时有轻度降压及降脂作用。本研究纳入糖尿病合并夜间高血压人群,研究度拉糖肽对夜间高血压的影响,为临床治疗糖尿病合并夜间高血压提供依据,现报道如下。
1 资料与方法
1.1 一般资料
选取2021年1-12月在江阴市中医院、江苏省苏北人民医院门诊治疗的80例2型糖尿病合并轻度单纯夜间高血压的患者作为研究对象,高血压分级均为1级。高血压诊断符合《中国高血压防治指南》(2018年修订版)的诊断标准[1],2型糖尿病诊断符合1999年世界卫生组织糖尿病诊断标准,排除继发性高血压、严重心肝肾功能损伤。动态血压明确有夜间高血压,夜间(22:00至次日6:00)平均收缩压(systolic blood pressure,SBP)≥120 mmHg、舒张压(diastolic blood pressure,DBP)≥70 mmHg(1 mmHg=0.133 kPa),白天(6:00至22:00),平均SBP<135 mmHg、平均DBP<85 mmHg,诊室血压<160/100 mmHg。根据动态血压结果中夜间血压下降幅度,定义患者血压类型。(1)勺型:夜间血压下降10%~20%;(2)非勺型:夜间血压下降<10%;(3)超勺型,夜间血压下降>20%;(4)反勺型:夜间血压超过白天血压。将患者分为奥美沙坦组、度拉糖肽组,每组各40例。本研究已通过医院伦理委员会批准(审批号LL2018017),所有患者均知情并签署知情同意书。
1.2 方法
1.2.1治疗方法
奥美沙坦组给予晨起口服奥美沙坦(第一三共制药有限公司,20 mg/7片,批准文号:国药准字H20060371)20 mg/次,1次/d。度拉糖肽组给予晨起腹部皮下注射度拉糖肽(德国Vetter Pharma-Fertigung GmbH &Co.KG公司,0.75 mg/0.5 mL,批准文号:注册证号S20190022)0.75 mg/次,1次/周,疗程共8周。
1.2.2观察指标
(1)检测治疗前后CD34+/CD42-EMPs水平:取静脉血5 mL,离心后取去血小板血浆50 μL,加入特异性抗体CD42、CD31,采用流式细胞仪(美国BD公司)检测EMPs。(2)监测治疗前后血压水平:随访治疗前后24 h动态血压水平,包括白天和夜间平均SBP和DBP,比较两组患者夜间血压达标比例(夜间血压<120/70 mmHg)及两组患者治疗前后血压类型变化。(3)监测治疗前后血糖、糖化血红蛋白及血清肌酐水平。(4)不良反应:记录治疗期间的不良反应发生情况,包括头晕、恶心及肾功能情况等。
1.3 统计学处理
2 结 果
2.1 两组患者一般临床资料比较
两组患者一般资料、EMPs水平比较,差异均无统计学意义(P>0.05),见表1。
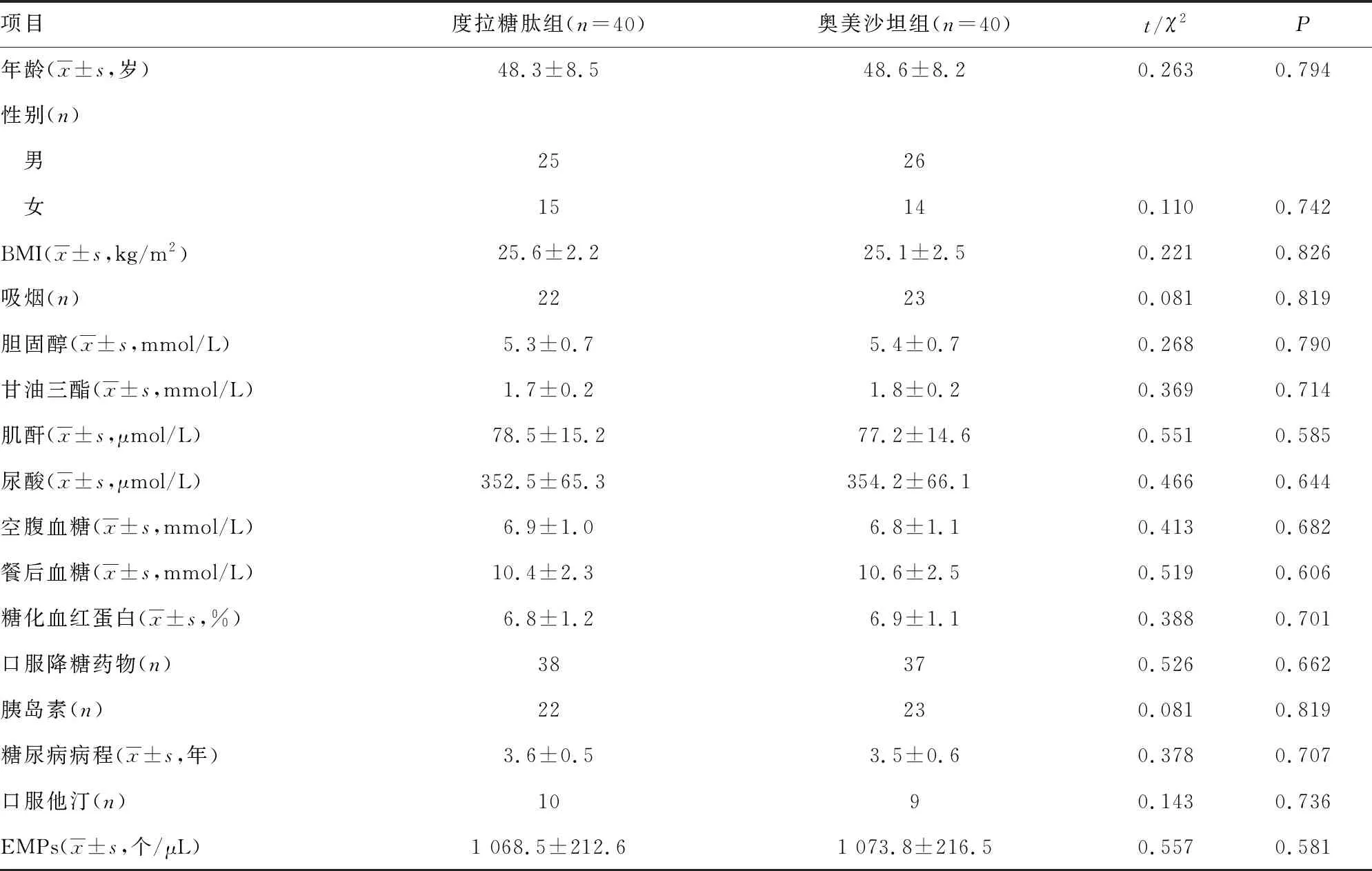
表1 两组患者的一般资料比较
2.2 两组患者治疗前后血压比较
两组治疗后夜间平均SBP、DBP均明显下降(P<0.05);度拉糖肽组夜间血压达标率82.5%,略低于奥美沙坦组(90.0%),但两组患者比较差异无统计学意义(P>0.05)。治疗前两组患者中血压类型均以非勺型高血压为主,治疗后勺型高血压比例较治疗前明显升高,非勺型高血压比例明显下降,差异有统计学意义(P<0.05),见表2~4。
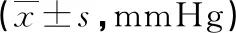
表2 两组患者治疗前后白天血压比较
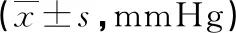
表3 两组患者治疗前后夜间血压比较

表4 两组患者治疗前后高血压类型比较[n(%)]
2.3 两组患者治疗前后血浆EMPs水平比较
两组患者治疗后EMPs水平较治疗前均明显下降(P<0.05)。度拉糖肽组治疗后EMPs水平下降较奥美沙坦组更明显(P<0.01),见表5。

表5 两组患者治疗前后血浆EMPs水平比较个/μL)
2.4 两组患者治疗前后血糖、肌酐和BMI水平比较
度拉糖肽组患者治疗前较治疗后空腹、餐后血糖及糖化血红蛋白均明显下降(P<0.05);两组治疗前后血清肌酐水平、BMI无明显变化(P>0.05),见表6。
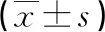
表6 两组患者治疗前后血糖、肌酐和BMI水平比较
2.5 不良反应发生情况
随访8周,两组患者治疗期间均未出现严重不良反应,度拉糖肽组及奥美沙坦组各出现1例轻微头晕不适,观察后均自行缓解;奥美沙坦组出现3例轻度消化道反应,经治疗后均好转。
3 讨 论
白天和夜间的血压变化受到机体昼夜节律影响,因此白天和夜间的血压往往存在差异。夜间高血压指夜间平均血压≥120/70 mmHg,其诊断往往需要24 h动态血压监测,临床上主要通过服用半衰期较长的药物或调整服药时间来控制夜间高血压。夜间高血压与心脑血管疾病发生相关,研究发现夜间高血压可导致肾动脉透明变性[4]。一项回顾性研究发现,夜间高血压可导致ICU患者致死率升高[5]。单中心研究发现,夜间高血压是高龄糖尿病患者发生主要心血管不良事件的主要参数[6]。
EMPs主要由内皮细胞脱落产生,反映血管内皮的损伤情况。其与血管的动脉粥样硬化、炎症反应、血栓形成等相关[7-8]。EMPs不能清除则会出现内皮损伤进一步加重,导致动脉粥样硬化性疾病的加重及进展。研究发现,急性心肌梗死患者循环EMPs水平升高,其升高程度与冠状动脉疾病的严重程度及远期预后相关[9]。高血压疾病的发生、发展过程中往往存在内皮损伤,高血压与内皮功能受损相关[10]。国内研究发现,EMPs与高血压患者血压变异相关[11]。高血压患者EMPs水平明显高于非高血压患者,与高血压相关的内皮损伤有关[12],糖尿病也常常伴随严重内皮功能的损伤,研究发现糖尿病合并动脉硬化患者的EMP水平明显升高[13]。
胰高血糖素样肽-1受体激动剂以葡萄糖浓度依赖的方式刺激胰岛素分泌和抑制胰高糖素分泌,发挥降糖作用,并可抑制胃排空,抑制食欲,可有效降低血糖,并能部分恢复胰岛β细胞功能。研究发现,度拉糖肽能减少糖尿病患者心血管事件的风险[14]。2型糖尿病患者长期使用度拉糖肽能延缓肾功能进展,起到保护肾功能作用。对于糖尿病合并脂肪肝的患者,度拉糖肽能减少肝脏脂肪的分布并降低肝酶[15]。研究也发现,度拉糖肽等减少糖尿病患者缺血性卒中风险,但和症状的严重程度不相关[16]。国内外指南均明确指出胰高血糖素样肽-1受体激动剂在良好控制血糖的同时还能改善患者的远期预后。
常规口服降压药物有时并没有考虑血压的昼夜节律变化,而且某些药物作用时间不能维持24 h,因此夜间血压往往控制不佳,长期可导致心脑血管并发症,夜间高血压也是临床血压控制的难题。睡眠状态下机体血压失调是夜间高血压的主要发病机制,与神经内分泌、情绪、不良生活习惯、肥胖等因素有关,特别是神经内分泌因素包括肾素、血管紧张素、醛固酮系统地过度激活、水钠平衡失调等[17]。临床指南均指出,度拉糖肽等可改善心血管事件的预后[18],其可能的作用机制包括:降低体重、改善胰岛素抵抗、减少肥胖和高血糖产生的氧化应激、改善内皮功能等,而这些作用机制对高血压的控制也有明显益处。
本研究纳入糖尿病合并单纯夜间高血压(主要为血压轻度升高)患者,对比常规口服降压药物和每周皮下注射度拉糖肽对夜间血压的控制效果,发现两种方式均能减低白天和夜间血压,虽然度拉糖肽降压幅度要低于奥美沙坦,但两组患者夜间高血压患者达标率没有明显差异。高血压、糖尿病等慢性疾病患者常常需联合使用多种药物,临床经常存在漏服或服药依从性差的现象,本研究结果显示,临床上一方面可以减少患者因不同时间服用药物带来的不便和漏服风险,另一方面对于高血压合并糖尿病的患者,特别是合并轻度夜间高血压的患者,每周1次使用度拉糖肽可在控制血糖的同时进一步控制夜间血压,从而减少患者使用药物的种类和数量。同时,两组患者夜间血压达标后循环EMPs水平亦明显下降,度拉糖肽治疗后血浆EMPs下降更加明显,提示度拉糖肽在良好控制夜间血压的同时能有更好地保护血管内皮功能,进而降低心脑血管不良事件的发生率。

