慢性间歇性低氧对大鼠肠道菌群与血糖的影响研究*
李 雯,刘娅钦,路 苹,万自芬,张湘燕,赵 丹△
(1.贵州省人民医院呼吸与危重症医学科,贵阳550002;2.国家卫生健康委员会肺脏免疫性疾病重点实验室,贵阳 550000)
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)是临床常见的综合征,目前普遍认为OSAHS是一种全身性疾病,可致多器官损害,其是高血压的致病因素,也是糖尿病、中风、缺血性心肌病、心力衰竭、心律失常等疾病的独立危险因素[1]。慢性间歇性低氧(chronic intermittent hyoxia,CIH)是OSAHS特有的病理生理改变,可导致氧化应激、炎症、交感神经过敏和内皮功能障碍[2]。OSAHS发生并发症病因的中心因素是氧化应激和炎症反应。动物模型显示,氧化应激和炎症反应增加活性氧自由基(reactive oxygen species,ROS),其可通过相关酶类的激活及磷酸化过程活化核因子-κB(NF-κB),后者将导致其下游大量促炎因子、黏附因子表达增强,激活单核细胞、淋巴细胞、内皮细胞等引起内皮功能受损和多系统疾病[3]。肠道菌群作为人或动物的“共生体”,可以辅助宿主进行营养吸收和能量代谢[4]。正常情况下肠道菌群与机体处于平衡状态,通过肠道屏障将肠腔内存在的大量细菌及毒素和机体内环境分隔开,避免了细菌的滞留和移位,正常肠道内的细菌及内毒素并不致病。当由于各种原因打破这种平衡时,肠道屏障破坏,导致细菌发生结构、功能变化或空间上的转移,从而引发机体疾病。肠道黏膜在正常情况下处于高灌注状态,对缺血、缺氧极其敏感,无论是机体整体还是肠道缺血、缺氧都会直接损伤肠道黏膜,进一步影响肠道微生物的定殖[5]。越来越多的研究发现,长期处于CIH状态下会引起肠道菌群改变、血糖调节紊乱,但其机制仍不清楚[6-7]。因此,本研究探讨CIH对大鼠肠道菌群与血糖的作用机制,以期为改善患者预后提供潜在的靶点。
1 材料与方法
1.1 实验动物
选取健康雄性SD大鼠30只,6周龄,体重180~220 g,购自重庆腾鑫比尔实验动物销售有限公司。
1.2 主要试剂
大鼠肿瘤坏死因子α(TNF-α)、脂多糖(LPS)、血糖、胰岛素(INS)的ELISA试剂盒购自上海研辉生物科技有限公司,NF-κB抗体兔多抗购自北京博奥森生物技术有限公司。纯氮气购自贵州省安顺市特种气体有限公司。
1.3 方法
1.3.1模型制作及分组
SD大鼠按随机数字表法分为正常对照组(NC组)、CIH 4周组(CIH4组)、CIH 8周组(CIH8组),每组10只。诱导CIH模型:向舱内循环充入氮气(纯度>99.9%)和空气,氧气分析仪持续检测低氧舱内氧气浓度,确保低氧舱内氧气浓度维持在7%~21%;充入氮气使得低氧舱氧气浓度维持在7%,持续时间30 s,恢复氧浓度21%,持续时间90 s,每次循环2 min[4]。CIH大鼠每天结束实验后将实验动物取出,放入饲养箱内自由饮水与摄食,饲养条件及生活环境与NC组相同,实验过程中CIH8组大鼠死亡2只。分别在实验第4周结束时留取CIH4组大鼠粪便,实验第8周结束时留取CIH8组、NC组大鼠粪便。粪便采集方法:75%乙醇连续3次消毒大鼠肛周皮肤刺激大鼠排便,灭菌镊子从大鼠肛门部取出粪便放入无菌EP管中-80 ℃冰箱保存。第4、8周结束实验时,于清晨保持空腹状态,100 g/L水合氯醛(300 mg/kg)腹腔注射进行常规麻醉大鼠,经股动脉采血并处死大鼠,立即暴露胰腺组织及肠道组织并做好分离,室温下4%多聚甲醛固定24 h。暴露肠道,寻找回盲部,摘取部分小肠段及大肠起始段,清水冲洗多次直至肠道无粪便残渣,放入无菌EP管中-80 ℃冰箱保存。离心血标本(3 000 r/min,离心15 min),留取上清液。
1.3.2检测大鼠血清中TNF-α、LPS、INS及空腹血糖(FBG)水平
采用ELISA法检测各组大鼠血清中TNF-α、LPS、INS及FBG水平,具体步骤参照试剂盒说明书。采用稳态模型法计算胰岛素抵抗指数(HOMA-IR)。
1.3.3高通量测序
通过干冰将大鼠粪便转运至深圳微科服技术有限公司,后续大鼠肠道菌群测序工作交由该公司进行。根据E.Z.N.A.®soil试剂盒(杭州西顿生物科技有限公司)对大鼠肠道样品进行DNA抽提,NanoDrop2000对DNA浓度和纯度进行检测,1%琼脂糖凝胶电泳检测DNA提取质量;338上游引物5′-ACT CCT ACG GGA GGA GCA G-3′和8806下游引物5′-GGA CTA CHV GGG TWT CAA T-3′对V3~V4可变区进行PCR扩增。2%琼脂糖凝胶回收PCR产物,AxyPrep DNA Gel Extraction Kit(美国Axygen公司)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。普洛麦格(北京)生物技术有限公司进行定量检测。根据IlluminaMiSeq平台标准操作规程将纯化后的扩增片段构建PE300的文库,美国Illumina公司的MiseqPE300平台进行测序。
1.3.4大鼠胰腺、肠道组织病理学改变及NF-κB表达
胰腺、肠道组织制作石蜡切片和苏木精-伊红(HE)染色,观察病理学改变。免疫组化测定大鼠胰腺、肠道组织NF-κB表达。复水,抗原修复,3%过氧化氢室温下孵育,加入NF-κBp65兔抗人单克隆抗体和生物素二抗,DAB显色,复染脱水,中性树胶封片固定、晾干后高倍视野显微镜下观察,成像完成后使用Image-Pro Plus 6.0分析软件分析,结果表示为目标蛋白的平均光密度。
1.4 统计学处理
2 结 果
2.1 各组大鼠血清中FBG、LPS、INS、HOMA-IR、TNF-α水平比较
CIH4、CIH8组血清中FBG、LPS、HOMA-IR、TNF-α水平均高于NC组(P<0.05),且CIH8组变化更明显(P<0.05)。CIH8组大鼠INS水平均高于NC、CIH4组(P<0.05),但NC组与CIH4组比较差异无统计学意义(P>0.05),见表1。
表1 各组大鼠血清中FBG、INS、HOMA-IR、LPS、TNF-α水平比较
2.2 各组大鼠肠道菌群种类及丰度表达
CIH大鼠肠道菌群门水平相对丰度主要集中在放线菌门、变形菌门,而NC组大鼠肠道菌群门水平相对丰度主要集中在厚壁菌门和拟杆菌门。CIH大鼠肠道菌群在属水平随着低氧时间的延长未指明的梭菌目细菌、瘤胃球菌属细菌、未指明消化链球菌科细菌、密螺旋体属细菌、拟杆菌属细菌、苏黎世杆菌属细菌及棒状杆菌属细菌的相对丰度增加,乳酸菌属细菌及普雷沃菌属细菌的相对丰度减少,NC组大鼠肠道菌群属水平相对丰度主要集中在乳酸菌属细菌和普雷沃菌属细菌。
2.3 各组大鼠胰腺和肠道组织病理学改变及NF-κB表达
NC组大鼠胰腺组织少量胰腺腺泡胞质疏松,胞核居中,与周围细胞产生间隔;有的胰岛细胞胞质疏松,未见明显炎性细胞浸润。间歇性低氧可导致大鼠胰腺组织腺体杯状细胞消失,有的地方可见腺体脱落,残留基底组织。NC组大鼠肠黏膜结构完整,有的地方可见腺体脱落,固有层少许炎性细胞浸润。间歇性低氧可导致大鼠肠道组织广泛黏膜糜烂,上皮细胞脱落,腺体杯状细胞消失,有的地方可见腺体脱落,残留基底组织,固有层广泛可见较多炎性细胞浸润,见图1。
CIH8组胰腺和肠道组织中NF-κBp65表达高于NC组(P<0.05),其余组间比较差异均无统计学意义(P>0.05),见图2、表2。
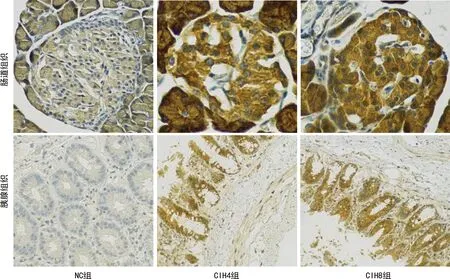
图2 各组大鼠胰腺和肠道组织免疫组化检测(200×)
表2 各组不同组织中NF-κBp65表达比较
3 讨 论
CIH是OSAHS最具特征性的病理生理改变,长期间歇性低氧状态诱发机体的氧化应激被认为是OSAHS引起多系统并发症的最重要机制。OSAHS由于反复发生低氧、复氧过程,可能引起类似缺血-再灌注的病理生理改变,产生大量ROS,进一步激活炎症因子,引起全身炎症反应[8]。人或动物的肠道黏膜处于高灌注状态,因此对缺血、缺氧十分敏感。机体整体或肠道缺血、缺氧的状态会直接损伤肠道黏膜系统,导致肠道菌群发生改变、菌群移位[9-11]。肠道菌群主要位于结肠,机体内外环境破坏均可导致肠道菌群紊乱[12]。CIH小鼠在全身炎症因子水平升高的情况下,肠道菌群发生明显改变,特别是拟杆菌属、脱硫弧菌科增多,双歧杆菌属减少。有研究表明,肠道菌群发酵后的主要代谢产物短链脂肪酸(short chain fatty acid,SCFA)如乙酸、丙酸、丁酸等参与调节机体代谢、肠道免疫及炎症反应[13]。肠道免疫系统通过肠道微生物与先天性免疫系统的Toll样受体(toll-like receptors,TLR)的相互作用引发免疫信号,TLR可通过相关信号通路激活NF-κB途径参与肠道的炎症反应[14-15]。而肠道菌群紊乱可通过引发机体慢性炎症、代谢紊乱、改变SCFA等途径进一步促成糖尿病的发生、发展[14]。NF-κB是哺乳动物的一种多效性转录因子,受氧化应激、LPS、细胞因子等多种刺激而活化,有研究发现NF-κB是介导OSAHS炎症反应的重要转录因子[5]。机体在一般情况下NF-κB处于失活状态,CIH引起类似缺血-再灌注损伤的病理改变,产生大量ROS,激活相关信号通路和NF-κB途径,进而启动基因的转录,使得下游的炎症相关因子如白细胞介素-6(interleukin-6,IL-6)、TNF-α等表达增加[16],引起血管内皮功能损伤。有研究证实,LPS可通过CD14/Toll受体通路激活NF-κB,进入细胞核后与DNA结合,从而启动炎性因子TNF-α、IL-6等的表达,引发机体慢性炎症反应和代谢紊乱[17]。有临床试验研究将中重度OSAHS患者与健康对照进行比较,分别检测氧化应激相关指标及炎症因子水平,3个月后重复检测上述指标,发现中重度OSAHS患者氧化应激相关指标及炎症因子水平明显升高[18]。有实验研究把大鼠至于间歇性低氧环境下生存4周,发现低氧状态下大鼠的IL-6、TNF-α明显升高[19]。有研究指出,氧化应激和炎症反应使得机体产生大量的ROS,其具有细胞毒性,可通过多种途径促进胰岛β细胞凋亡,直接导致胰腺细胞功能受损[20]。机体为适应环境,大量表达炎症因子,其中NF-κB由胞质转位到胞核,激活细胞炎性转导通路,TNF-α、IL-6等炎性因子增加。TNF-α可诱导胰岛素抵抗(insulin resistance,IR)和INS受体底物1(insulin receptor substrate 1,IRS-1)的丝氨酸磷酸化水平升高,而抑制正常的酪氨酸磷酸化,使INS受体与底物结合降低,信号传导受抑制,INS不能发挥正常作用[21]。此外,TNF-α通过蛋白磷酸酶2C(protein phosphatase 2C,PP2C)的转录上调,关键能量传感器AMP依赖的蛋白激酶失活来抑制INS敏感性[22]。有研究显示[23-24],小鼠皮下注射LPS 4周后血糖升高、糖耐量异常,并出现了IR等。PANOUTSOPOULOS等[25]发现,给予OSAHS患者持续气道正压通气(continues the positive pressure to ventilate,CPAP)治疗后,体内高水平的CRP及IL-6等明显下降,IR缓解。有研究提示,短期的CPAP治疗能够降低睡眠期间或全天的血糖水平,改善IR[26]。动物实验发现,低氧能造成肠道菌群改变,从而增加肠道通透性,改变血浆外泌体,诱导脂肪细胞功能障碍,致使IR增加;已有动物实验证实,将OSAHS小鼠粪便微生物转移至受体小鼠后,出现了IR[27-28]。因此,OSAHS引起的肠道菌群失调可以导致IR。本实验通过模拟OSAHS的间歇低氧状态,建立CIH大鼠模型,进一步验证了其可引起肠道菌群失调,体内炎症因子水平发生改变,LPS、TNF-α、NF-κB水平升高,肠道组织和部分胰腺组织腺体破坏,血糖水平改变,为OSAHS合并糖尿病患者的防治提供了新思路。

