肠道菌群通过NLRP3介导神经炎症调节rmTBI导致的记忆功能障碍*
汪家文,李佳洁,2,吴 君,吴文鑫,杨 林
(1.贵州医科大学法医学院/法医司法鉴定中心,贵阳,550004;2.贵州医科大学生物与工程学院/健康医药现代产业学院,贵阳 550004)
创伤性脑损伤(traumatic brain injury,TBI)已成为全球公共卫生问题,据统计全球每年约有1 000万人受TBI影响[1]。TBI是长期残疾及多种慢性神经性疾病如帕金森病、脑卒中、记忆功能损伤、抑郁和神经退行性疾病的主要原因之一[2-4]。中、重度TBI患者一般能得到及时救助,而轻度TBI患者由于器质性变化不明显而延误治疗,进而面临着重复损伤的风险,即重复轻度创伤性脑损伤(rmTBI)[5-7]。胃肠道是微生物最多的器官,10万亿~100万亿的微生物生活在结肠中[8]。已有研究表明,帕金森病、脑卒中、记忆功能损伤和抑郁都与肠道菌群有关,TBI发生后肠道菌群结构也发生改变[9-10]。而rmTBI发生后肠道菌群如何变化,少见报道。
急性TBI可引起肠道菌群失调,24 h内可导致加塞乳杆菌、黄色瘤胃球菌和腹真杆菌数量明显减少,而沟真杆菌和福玛马文布兰菌数量明显增加[11]。TBI后缺血性脑卒中也会导致严重的肠道菌群失调,且与脑损伤的程度和预后有关[12-14]。肠道菌群有助于恢复核苷酸结合寡聚化结构域样受体3(NLRP3)介导的神经炎症和慢性乙醇暴露(CEE)诱导的抑郁样行为,肠道菌群失调也可以导致小鼠脑组织小胶质细胞活化和神经炎症反应,从而加剧脑损伤[15-16]。恢复肠道菌群失调,有望给TBI带来治疗效果。
脑-肠-微生物轴三者之间相互作用的改变在许多疾病的发生、发展中扮演着重要角色[17]。rmTBI常常伴随着炎症的发生,例如rmTBI发生后,NLRP3炎症小体可被激活,从而激活caspase-1,形成活化的炎性体。caspase-1进一步剪切白细胞介素(interleukin,IL)-1β和IL-18前体,形成其成熟体,并通过消皮素D(gasdermin-D,GSDMD)-N介导的质膜孔释放,从而诱导NLRP3炎性细胞焦亡[18-19]。肠道菌群可通过脑-肠-微生物轴来调节神经炎症,而肠道微生物移植能有效地缓解炎症反应从而改善神经功能障碍[20-25]。
粪菌移植(fecal microbiota transplantation,FMT)是一种通过把正常粪便中的细菌混合物转移到患者肠道中而引入新的菌群的方法,该法可使脊髓损伤和缺血性脑卒中后的肠道菌群失调正常化,从而发挥保护神经的作用[13,26-27]。FMT还可通过使TBI后肠道菌群正常化从而达到缓解神经功能缺损的作用[28]。FMT能否使rmTBI后肠道菌群正常化而改善rmTBI导致的神经功能障碍,尚不清楚。本研究拟通过建立rmTBI大鼠模型,研究大鼠rmTBI后肠道菌群失调与其神经功能障碍的关系,以及FMT是否能通过调节NLRP3/caspase-1/IL-18炎症通路来恢复这种失调,影响神经功能效力,从而缓解rmTBI后肠道菌群紊乱、神经炎症、神经功能障碍而发挥治疗作用。
1 材料与方法
1.1 实验动物
6周龄SD雄性大鼠购自长沙天勤生物技术有限公司。动物操作程序按照动物保护和使用委员会的规定进行,并经贵州医科大学动物中心批准(批准号:NJMU-1807003)。实验开始前1周,所有大鼠均于光暗循环新环境适应性喂养,大鼠自由获得食物和水。然后随机将大鼠分为4组:对照(contorl,con)组,rmTBI组,rmTBI+生理盐水灌胃(rmTBI+saline)组,rmTBI+粪便溶液灌胃粪菌移植(rmTBI+FMT)组。
1.2 方法
1.2.1rmTBI模型建立
使用单摆撞击装置构建rmTBI模型。32只大鼠用异氟烷麻醉后将其暴露在单摆撞击装置的平台上进行撞击。每天进行5次撞击,连续进行5 d。
1.2.2FMT治疗
FMT悬浮液制备:9:00-11:00取大鼠新鲜粪便,置于-80 ℃冰箱保存。使用前解冻,以生理盐水稀释为200 mg/mL的粪便悬浮液,并在标准混合器中均化,置于离心机内2 000 r/min离心10 min,收集悬浮液用于FMT。FMT:每天损伤大鼠2 h后对rmTBI+saline组、rmTBI+FMT组大鼠分别进行200 μL生理盐水和粪便悬浮液灌胃,在rmTBI结束后继续灌胃2 d。
1.2.3Morris水迷宫实验
将大鼠轻轻放入直径1.5 m的水池当中,池子分为4个象限,水池里的水没过平台2 cm,并与钛白粉混合以隐藏平台,水温(25±3)℃。平台处于第三象限中部,如果大鼠找到逃逸平台(潜伏期),实验结束;若在120 s内未找到平台,则将大鼠引导到平台上休息15 s,每天3次。分别从第一象限、第二象限、第四象限放入,持续4 d。于第5 d撤去平台,随机选一个象限将大鼠轻轻放入水池中,记录大鼠60 s内的运动路径、距离、在目标象限停留的时间、穿越平台的次数及时间;若60 s内未找到平台,则潜伏期记为60 s。
1.2.4组织处理
各组大鼠用戊巴比妥钠麻醉。然后灌注磷酸盐缓冲液(PBS)和4%多聚甲醛溶液,仔细解剖、分离大鼠脑组织。部分大鼠脑组织进行脑含水量检测,其余浸泡于4%多聚甲醛溶液固定1周。取海马腹侧组织,石蜡包埋、切片并进行免疫组织化学染色(IHC)及苏木素-伊红(HE)染色。
1.2.5脑水肿程度测定
使用干湿法测定大鼠脑水肿程度。使用10%水合氯醛麻醉,经心灌注生理盐水后处死大鼠,取出脑组织,沿正中线切开,分离出左右半球,立即称湿重。然后放入100 ℃烤箱中48 h烤干,再迅速称量脑组织干重。计算脑含水量(%)=(湿重-干重)/湿重×100%。
1.2.6HE染色
切片经70 ℃烤1 h,依次在二甲苯Ⅰ、二甲苯Ⅱ、100%→80%→60%梯度乙醇脱蜡水合后滴加苏木素染核,1%盐酸酒精分化,稀氨水返蓝后滴加 1%伊红染色液,经自来水冲洗后脱水透明,中性树胶封片。
1.2.7ELISA法检测NLRP3、caspase-1、IL-18、IL-1β表达水平
取大鼠外周血血清,分别从NLRP3、caspase-1、IL-18、IL-1β试剂盒中取出板条,分为标准品孔、0值孔、样品孔和空白孔,分别在标准品孔、0值孔和样品孔中加入不同浓度的标准品,样品稀释液各50 μL,辣根过氧化物酶(HRP)100 μL,空白孔不加,封板膜封口,恒温避光孵育1 h。弃去板内液体,吸水纸拍干,洗涤液洗涤后向所有孔中加入底物混合液100 μL,恒温箱避光孵育15 min,加入反应终止液50 μL,酶标仪上450 nm处测所有孔的吸光度值(A值)。
1.2.8IHC法检测大鼠海马区胶质纤维酸性蛋白(GFAP)、离子钙接头蛋白1(Iba-1)表达水平
切片经70 ℃烤1 h,用二甲苯Ⅰ、二甲苯Ⅱ、100%→80%→60%梯度乙醇脱蜡水合后用3% H2O2孵育,去除内源性过氧化物酶,然后置于乙二胺四乙酸(EDTA)抗原修复液中进行高压修复。滴加山羊血清封闭液,在37 ℃培养箱中孵育30 min,然后加入各种靶蛋白的一抗,在4 ℃下孵育过夜。一抗包括GFAP(GTX108711,1∶500稀释,美国Gene Tex公司)和Iba-1(GTX100042,1∶200稀释,美国Gene Tex公司)。在PBS中冲洗3次后,滴加山羊抗兔二抗,室温孵育1 h。PBS洗3次用二氨基联苯胺(DAB)显色液显示信号,用苏木素对细胞核进行双染色,然后在自来水下冲洗15 min.最终脱水透明后用中性树胶封口。
1.2.916S rRNA测序
使用粪便基因组DNA提取试剂盒(TianGen)提取大鼠粪便DNA,使用1%琼脂糖凝胶电泳检测所提取DNA的纯度及浓度。按照常规流程操作方法获 得PCR扩增产物,使用浓度为2%的琼脂糖凝胶电泳检测,对合格的PCR产物进行磁珠纯化,通过酶标定量法根据PCR产物的浓度进行等量混样,充分混匀后再使用2%的琼脂糖凝胶电泳检测。使用通用型DNA纯化回收试剂盒(TianGen)回收目的条带产物。使用NEB Next®UltraTMⅡ FS DNA PCR-free Library Prep Kit(New England Biolabs)构建文库,对构建好的文库进行Qubit和实时荧光定量PCR(qPCR)定量,待文库检测合格后,使用NovaSeq 6000进行PE250上机测序。
1.3 统计学处理
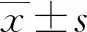
2 结 果
2.1 rmTBI后大鼠记忆功能障碍及FMT的治疗作用
大鼠的水迷宫踪迹见图1A。结果显示,rmTBI可引起记忆功能障碍,表现为:大鼠穿越平台的次数明显减少(P<0.01,图1B),潜伏期明显增长(P<0.001,图1C);使用FMT干预后,大鼠的记忆功能得到了恢复(图1B、C)。4组大鼠的游泳速度差异无统计学意义(P>0.05,图1D),排除了大鼠因为游泳能力不同导致空间记忆功能差异的可能性。
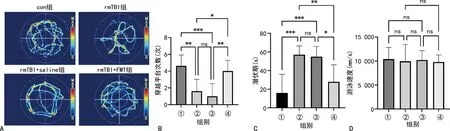
A:代表性大鼠踪迹图;B:大鼠穿越平台次数组间比较;C:大鼠第1次找到平台时间(潜伏期)组间比较;D:大鼠游泳速度组间比较;①:con组;②:rmTBI组;③:rmTBI+saline组;④:rmTBI+FMT组;*:P<0.05,**:P<0.01,***:P<0.001;ns:P>0.05。
2.2 FMT改善rmTBI后脑水肿程度
con组、rmTBI组、rmTBI+saline组、rmTBI+FMT组脑含水量分别为77.3%±0.9%、80.3%±1.2%、81.9%±1.5%、76.4%±2.1%,rmTBI组和rmTBI+saline组差异无统计学意义(P>0.05),相比于con组明显增多(P<0.05);与rmTBI组和rmTBI+saline组相比,rmTBI+FMT组大鼠脑含水量明显减少(P<0.05)。
2.3 组织病理学改变
病理学结果显示:与con组相比,rmTBI组、rmTBI+saline组、rmTBI+FMT组大鼠大脑海马区神经细胞及脑血管周隙明显增宽;与rmTBI组、rmTBI+saline组相比,经FMT治疗后大鼠海马区神经细胞及脑血管周隙明显减小,脑水肿程度明显减轻,见图2。
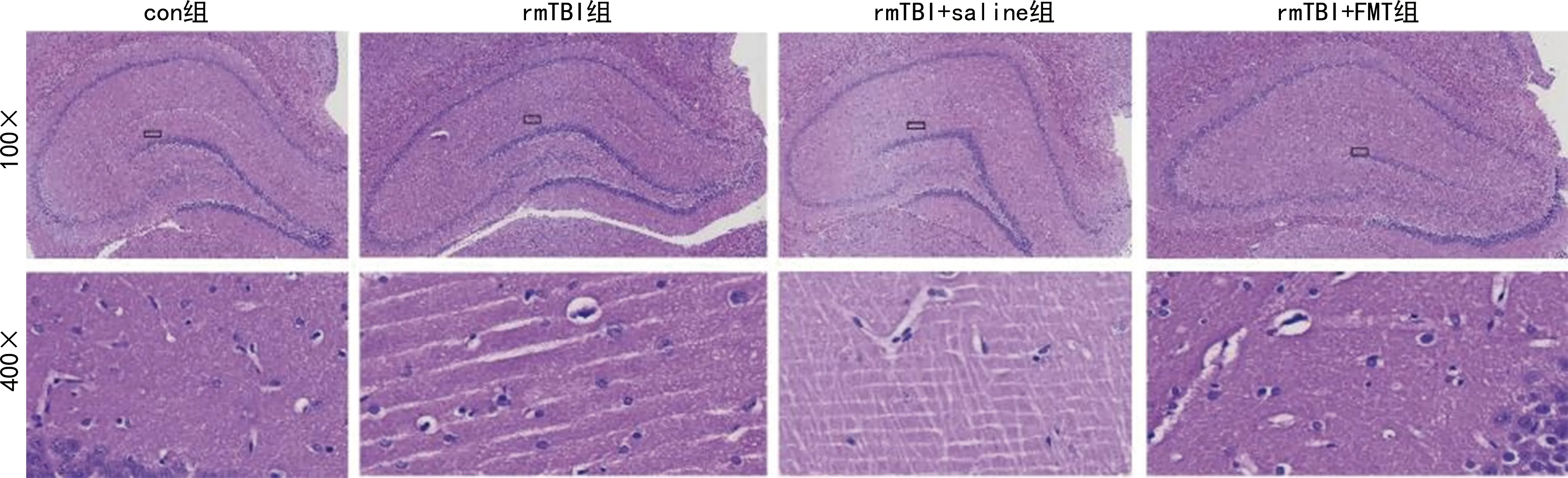
图2 海马区病理学改变(HE染色)
2.4 ELISA法检测大鼠血清中NLRP3、caspase-1、IL-1β、IL-18表达
血清学结果显示:与con组相比,rmTBI组及rmTBI+saline组大鼠血清NLRP3、caspase-1、IL-18表达水平均明显升高(P<0.01),rmTBI组大鼠血清IL-1β表达水平明显升高(P<0.01)。rmTBI组和rmTBI+saline组大鼠组间血清NLRP3、caspase-1、IL-18表达水平差异均无统计学意义(P>0.05),IL-1β表达水平较rmTBI组明显降低(P<0.05)。与rmTBI组及rmTBI+saline组相比,经FMT干预治疗后,大鼠血清NLRP3、caspase-1、IL-18表达水平均明显降低(P<0.05)。与rmTBI组相比,FMT干预后大鼠血清IL-1β表达水平明显降低(P<0.001),与rmTBI+saline组相比差异无统计学意义(P>0.05),见图3。
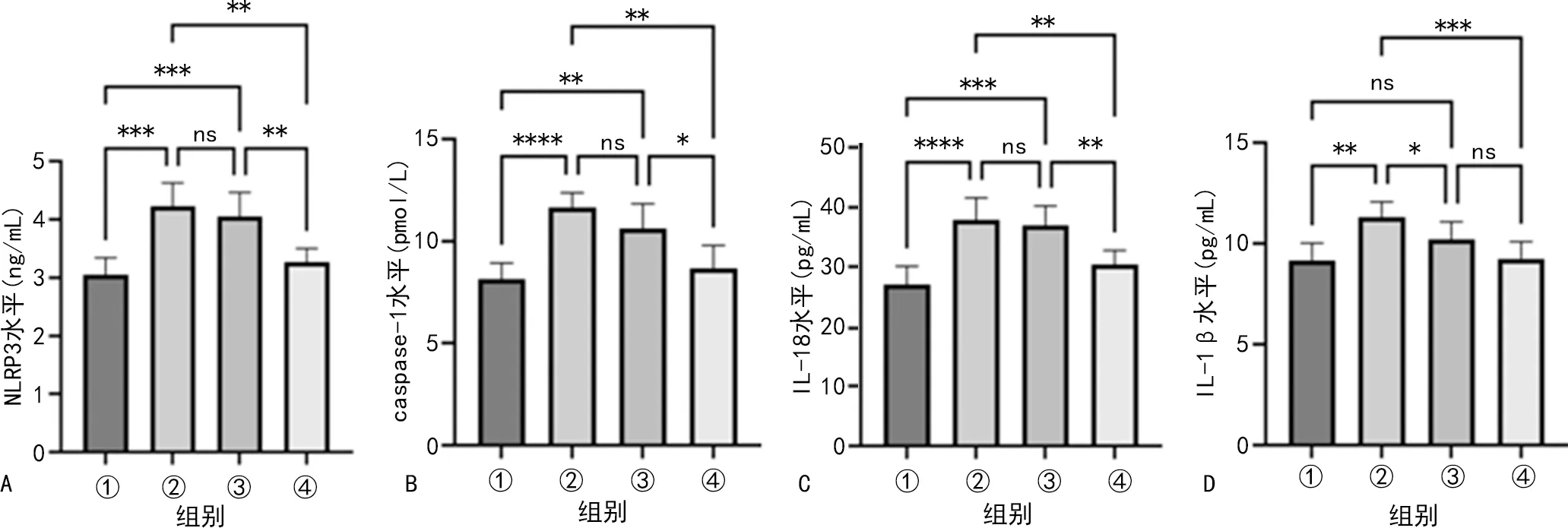
A:大鼠血清NLRP3水平组间比较;B:大鼠血清caspase-1水平组间比较;C:大鼠血清IL-18水平组间比较;D:大鼠血清IL-1β水平组间比较;①:con组;②:rmTBI组;③:rmTBI+saline组;④:rmTBI+FMT组;*:P<0.05,**:P<0.01,***:P<0.001,****:P<0.000 1;ns:P>0.05。
2.5 IHC检测大鼠海马区GFAP、Iba-1表达水平
IHC检测大鼠海马区GFAP、Iba-1表达,结果显示:rmTBI组和rmTBI+saline组大鼠海马区GFAP、Iba-1表达水平无明显差异(P>0.05)。与con组相比,rmTBI组和rmTBI+saline组大鼠海马区GFAP、Iba-1表达水平明显升高(P<0.05)。与rmTBI组和rmTBI+saline组相比,rmTBI+FMT组大鼠海马区GFAP、Iba-1表达水平明显降低(P<0.05),见图4。
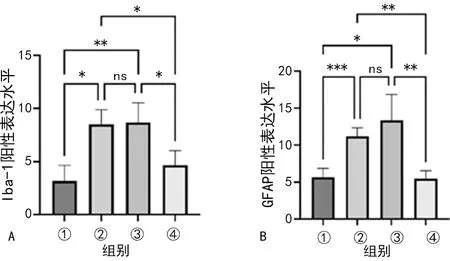
A:随机选取不同标本同一位置0.1 mm×0.1 mm面积内Iba-1阳性表达统计分析;C:随机选取不同标本同一位置0.1 mm×0.1 mm面积内GFAP阳性表达统计分析;①:con组;②:rmTBI组;③:rmTBI+saline组;④:rmTBI+FMT组;*:P<0.05,**:P<0.01,***:P<0.001;ns:P>0.05。
2.6 门分类水平丰度分布
根据物种注释结果,在门水平上选取排名前10的门从高到低分别是:厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteriota)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteriota)、脱硫杆菌门(Desulfobacterota)、疣微菌门(Verrucomicrobiota)、弯曲杆菌门(Campilobacterota)、黏菌门(Myxococcota)。其中厚壁菌门、拟杆菌门均大量存在于各个样品中,所占比例高,是构成肠道菌群的优势菌门。除此之外,各个样品的菌门所占比例也不相同。例如rmTBI组样品4中厚壁菌门相对丰度高达67%;con组样品3中拟杆菌门相对丰度高达58%。
2.7 属分类水平丰度分布
在属分类水平上,丰度排名前10的菌属依次是:乳酸菌属(Muribaculaceae)、乳杆菌属(Lactobacillus)、普氏菌属(Prevotella)、毛螺球菌科-NK4A136属(Lachnospiraceae-NK4A136-group)、普雷沃菌科-Ga6A1属(Prevotellaceac-Ga6A1-group)、理研菌科-RC9属(Rikenellaceae-RC9-gut-group)、罗姆布茨菌属(Romboutsia)、拟杆菌属(Bacteroides)、梭状芽胞杆菌-UCG-014属(Clostridia-UCG-014)、瘤胃菌属(NK4A214-group)。每个样品间菌属构成比例差异较大。例如:con组样品2中Muribaculaceae属相对丰度为45%;con组样品5中Muribaculaceae属相对丰度为23%,Muribaculaceae属在大鼠个体间差异较大。
2.8 肠道菌群、神经功能障碍、神经炎症相关性分析
肠道菌群、神经功能障碍与神经炎症存在不同的相关性。肠道菌群变化与神经功能障碍、神经炎症具有一定相关性,表现为Shannon指数与大鼠潜伏期(r=-0.810)、GFAP(r=-0.721)、Iba-1(r=-0.680)呈负相关,与穿越平台次数呈正相关(r=0.723);Simpson指数与GFAP呈负相关(r=-0.628)。神经功能障碍与神经炎症也具有一定相关性,表现为潜伏期与GFAP(r=0.809)、Iba-1(r=0.803)呈正相关,穿越平台次数与GFAP(r=-0.832)、Iba-1(r=-0.749)呈负相关。除此之外,肠道菌群失调与神经功能障碍、神经炎症等多项指标均存在不同的相关性,见表1。
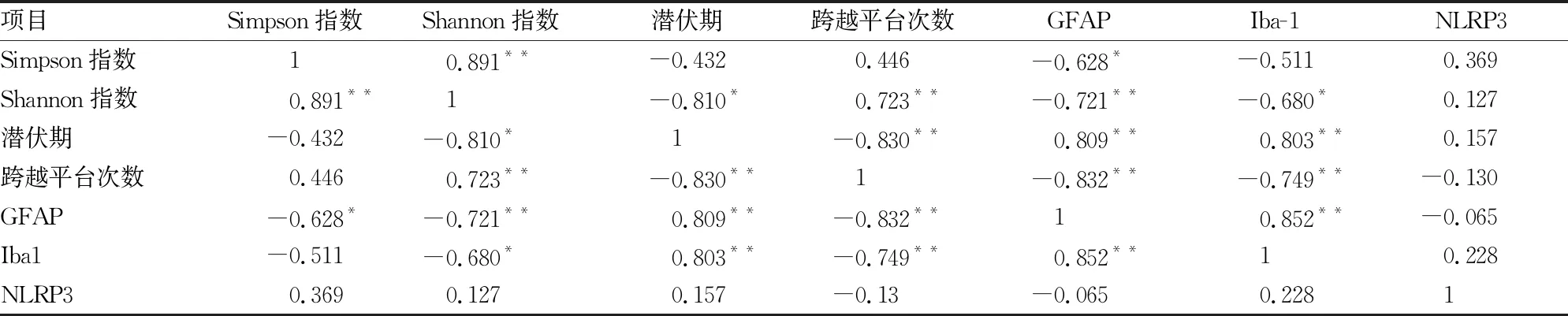
表1 Simpson指数、Shannon指数、炎症因子、记忆功能障碍指标相关性分析(r)
3 讨 论
肠道菌群受多因素的影响,包括性别、遗传因素、饮食、年龄、药物和压力等。近年来,TBI模型已被用于研究肠道微生物组中宿主与微生物之间的相互作用,从而加深对大脑与肠道菌群之间相互调节机制的理解。肠道菌群失调可通过脑-肠-微生物轴影响神经功能,因此神经功能障碍患者更易发生肠道菌群失调,如认知功能障碍、神经免疫功能等神经功能障碍[29-30]。在rmTBI发生后肠道菌群改变,表现为有益菌[如嗜黏蛋白阿克曼菌(Akkermansia)、糖化假丝酵母菌(Candidatus-Saccharimonas)等]减少而有害菌(如Romboutsia)增多,这种紊乱可导致神经行为改变,进而导致神经功能障碍。
rmTBI常常伴随着神经炎症反应的发生和神经功能障碍。神经炎症是机体的一种防御反应机制,适当的神经炎症可通过促进组织修复与除去细胞碎片而对大脑起到保护作用,相反,持续的炎症反应会激活固有免疫细胞,从而导致疾病的发生[31],进而产生神经功能障碍。研究表明,小胶质细胞、星形胶质细胞、神经元细胞是神经炎症中最重要的三类细胞,神经炎症加重了抑郁、阿尔茨海默病、认知功能障碍和神经退行性疾病等神经功能障碍的发生,调节星形胶质细胞-小胶质细胞之间的交互对话可以维持神经元结构和功能的完整性,从而达到维持神经系统内环境的稳定和治疗神经退行性疾病的目的[32-34]。
脑小胶质细胞、星形胶质细胞的激活受多种因素的影响。Iba-1是一种钙结合蛋白,可以特异性地结合巨噬细胞和激活的小胶质细胞;GFAP作为主要的炎症性中枢神经系统疾病标志物,主要存在于成熟的星形胶质细胞内。本研究证实,当rmTBI发生后,肠道菌群稳态被破坏,小胶质细胞、星形胶质细胞被激活。肠道菌群失调可间接影响小胶质细胞、星形胶质细胞功能的促炎和抗炎细胞因子循环水平的改变。当肠道菌群的复杂结构受到破坏时,小胶质细胞尤其受到影响。研究表明,神经元和星形胶质细胞合作促进小胶质细胞分支,诱导小胶质细胞特征基因表达[35]。当神经元所处的微环境稳态被打破时,则会释放出“信号”分子,通过配体-受体的结合,诱导小胶质细胞活化[36]。
肠道微生物成员的细菌产物或代谢物如三甲胺、短链脂肪酸(short-chain fatty acids,SCFAs)是调节小胶质细胞成熟、形态和功能的关键因子[37-38]。SCFAs可能通过肠黏膜进入体循环中,进而影响神经系统功能。本研究结果证实,粪便微生物移植可以抑制小胶质细胞、星形胶质细胞的激活,进而减少神经元细胞的焦亡,改善神经功能障碍。然而,肠道菌群影响小胶质细胞、星形胶质细胞激活的机制尚不清楚,推测可能与肠道微生物成员的细菌产物或者代谢物有关,如三甲胺、SCFAs等。总之,本研究发现肠道菌群的稳态对rmTBI后神经炎症和神经功能障碍至关重要,FMT减少了神经炎症的发生,改善了rmTBI后的神经功能障碍,为肠道微生物在大脑损伤后固有免疫系统中的免疫反应提供了证据,有助于理解和治疗rmTBI后神经炎症和认知功能损伤、抑郁、空间记忆功能损伤和阿尔茨海默病等神经功能障碍。
rmTBI可导致肠道菌群失调,表现为肠道菌群丰度增多而多样性下降,有益菌数量减少而致病菌增多,NLRP3/caspase-1/IL-18炎症通路被激活,同时导致记忆功能损伤;而FMT能有效地使失调的肠道菌群正常化,同时调节NLRP3/caspase-1/IL-18炎症通路使其表达下调,并对rmTBI造成的记忆功能损伤具有恢复作用。

