异基因造血干细胞移植后植入功能不良的危险因素分析*
孙水云,刘 谍,夏新兰,李 燕,张 燕,赵 鹏,李艳菊,李梦醒,王季石,卢英豪△
(1.贵州医科大学临床医学院,贵阳 550004;2.贵州医科大学附属医院血液内科/贵州省造血干细胞移植中心,贵阳 550004)
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)是治疗包括白血病、骨髓增生异常综合征(myelodysplastic syndrome,MDS)、重型再生障碍性贫血(severe aplastic anemia,SAA)等多种恶性血液病及难治性血液病的重要手段,中国每年约5 000例患者行allo-HSCT治疗并多数因此获得长期生存[1]。allo-HSCT的成功建立在供者来源的造血及免疫重建上,如果供者的造血干细胞完全嵌合,且无严重移植物抗宿主病(graft versus host disease,GVHD)和/或原发病复发,但是造血恢复延迟或不完全,即为植入功能不良(poor graft function,PGF)。PGF是allo-HSCT后的严重并发症,可伴随出血、感染等症状,严重影响患者的预后。据文献报道,PGF发病率为5%~27%[2-3],但目前PGF的影响因素尚未充分明确。本文对贵州医科大学附属医院333例allo-HSCT病例进行回顾性分析,探讨PGF的危险因素,并对比PGF组和植入功能良好(good graft function,GGF)组的生存差异,有助于早期确定PGF的高风险人群,建立PGF防治策略。
1 资料与方法
1.1 一般资料
收集2014年1月至2021年12月在贵州医科大学附属医院血液内科行allo-HSCT的患者的完整临床资料。对患者进行一般情况、实验室检查及影像学评估,排除非首次移植或移植28 d内死亡者,共333例患者纳入研究。原发疾病类型:急性髓系白血病(acute myeloid leukemia,AML)144例,急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)101例,MDS 14例,SAA 61例,非霍奇金淋巴瘤(non-hodgkin’s lymphoma,NHL)6例,急性混合表型白血病(acute mixed phenotypic leukemia,MPAL)3例,慢性粒细胞白血病(chronic myelogenous leukemia,CML)2例,浆细胞白血病(plasma cell leukemia,PCL)2例;移植方式:其中亲缘全相合移植179例,单倍体相合移植152例,无关供者移植2例。无关供者移植均为人类白细胞抗原(human leucocyte antigen,HLA)全合配型,且移植后均GGF。根据移植后植入功能对患者进行分组:PGF组患者32例(占9.61%),男14例,女18例,中位年龄25.5(6.0,55.0)岁;GGF组患者301例(占90.39%),男187例,女114例,中位年龄25.0(9.0,61.0)岁。移植前获得患者或其亲属的书面知情同意。本研究方案符合《赫尔辛基宣言》,经贵州医科大学附属医院伦理审查委员会批准(批准号:2023伦审第368号)。
1.2 方法
1.2.1资料收集
临床资料包括年龄、性别、移植方式、供受者性别匹配、原发疾病类型、移植前原发病状态、合并基础疾病、移植前合并感染、首次确诊到移植时间、预处理方案、ABO血型匹配、移植物来源、输注CD34+细胞数、输注单个核细胞数、急性GVHD、移植后30 d内EB病毒感染、移植后30 d内巨细胞病毒(cytomegalovirus,CMV)感染等。采用实时荧光定量PCR对血浆CMV-DNA和EB病毒-DNA进行检测,当病毒载量大于500 copies/mL时认为CMV感染或EB病毒感染。
1.2.2预处理方案
AML、ALL、MDS、NHL、MPAL、CML和PCL共272例患者移植前均接受清髓性预处理(myeloablative conditioning,MAC)。MAC包括Bu/Cy(白消安+环磷酰胺)及改良Bu/Cy(羟基脲+阿糖胞苷+白消安+环磷酰胺+司莫司丁)为基础的方案。无关供者和单倍体移植加用抗人胸腺细胞球蛋白(anti-thymocyte globulin,ATG)。SAA 患者共61例,其中预处理方案为Cy+Flu+ATG(环磷酰胺+氟达拉滨+ATG)23例,Bu+Cy+Flu+ATG(白消安+环磷酰胺+氟达拉滨+ATG)38例。
1.2.3GVHD预防
全部患者在移植前均给予环孢素A(cyclosporin A,CSA)+吗替麦考酚酯(mycophenolate mofetil,MMF)+氨甲蝶呤(methotrexate,MTX)预防GVHD,具体方案为:自移植前第9天开始静脉应用CSA 1.5~2.0 mg·kg-1·d-1,至胃肠道功能恢复时改用口服,血药浓度保持在150~250 μg/L,移植后第15天逐步减量。自移植当日开始口服MMF 0.5 g/12 h,共28 d。移植后第1天静脉应用短疗程MTX 15 mg/m2,移植后第3、6天静脉应用短疗程MTX 10 mg/m2。对于单倍体移植,在以上方案的基础上,于移植前第4天至移植前第1天给予ATG 8 mg/kg;对于非亲缘移植,在上述基础上,于移植前第4天至移植前第1天给予ATG 6 mg/kg。患者GVHD参照《中国异基因造血干细胞移植治疗血液系统疾病专家共识(Ⅲ)——急性移植物抗宿主病(2020年版)》分级[4]。
1.2.4造血重建标准
受者染色体核型及ABO血型转为供者型,移植后连续3 d中性粒细胞计数>0.5×109/L的首日为粒细胞植入时间;脱离血小板输注,连续7 d血小板计数>20×109/L的首日为血小板植入时间[5]。采用短串联重复序列PCR对嵌合状态进行评价,移植后第15天进行初次检测,供者细胞>95%为完全供者嵌合。
1.2.5PGF与GGF定义
PGF定义:移植后28 d,仍有两系或三系血细胞计数减少(ANC<0.5×109/L、PLT<20×109/L或Hb<70 g/L),持续时间超过3 d,或需输血支持,骨髓穿刺发现骨髓增生减低,完全供者嵌合,并且没有并发严重GVHD和原发疾病复发[6-9]。PGF包括原发性PGF及继发性PGF。原发性PGF是指到移植后第28天,患者仍然没有达到造血重建的标准。继发性PGF是指曾达造血重建者再次达到PGF诊断标准。GGF的判定:移植后28 d,在脱离输血及粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)支持治疗下,连续3 d ANC≥0.5×109/L,连续7 d PLT≥20×109/L,Hb≥70 g/L[6]。
1.2.6评价和随访
以总生存期(overall surviva,OS)及无进展生存期(progression-free survival,PFS)评估患者的生存情况。OS的定义是从疾病确诊至患者因任何原因死亡或末次随访。PFS被定义为从移植开始至疾病进展或患者因各种原因死亡的时间。随访的方法有门诊、住院和电话,随访时间截至2022年10月30日。对失访患者,生存期根据末次随访时间确定。
1.3 统计学处理
采用SPSS26.0软件包对数据进行统计分析,计数资料用例数或百分比表示,两组间比较采用χ2检验,等级资料进行秩和检验;采用logistic回归分析筛选allo-HSCT后PGF的危险因素,应用Kaplan-Meier法及Log-rank检验比较两组患者的生存差异。全部统计检验均为双侧,以P<0.05为差异有统计学意义。
2 结 果
2.1 PGF组与GGF组临床特征比较
两组移植方式、原发疾病类型、移植前原发病状态、预处理方案、ABO血型匹配、输注CD34+细胞数、输注单个核细胞数目、CMV感染比较,差异均有统计学意义(P<0.05),见表1。原发疾病为AML、ALL、MDS、SAA及其他的患者PGF 发 生 率分别为6.94%(10/144)、3.96%(4/101)、14.28%(2/14)、26.23%(16/61)、0,差异有统计学意义(χ2=26.021,P<0.001),SAA患者 PGF发生率最高。
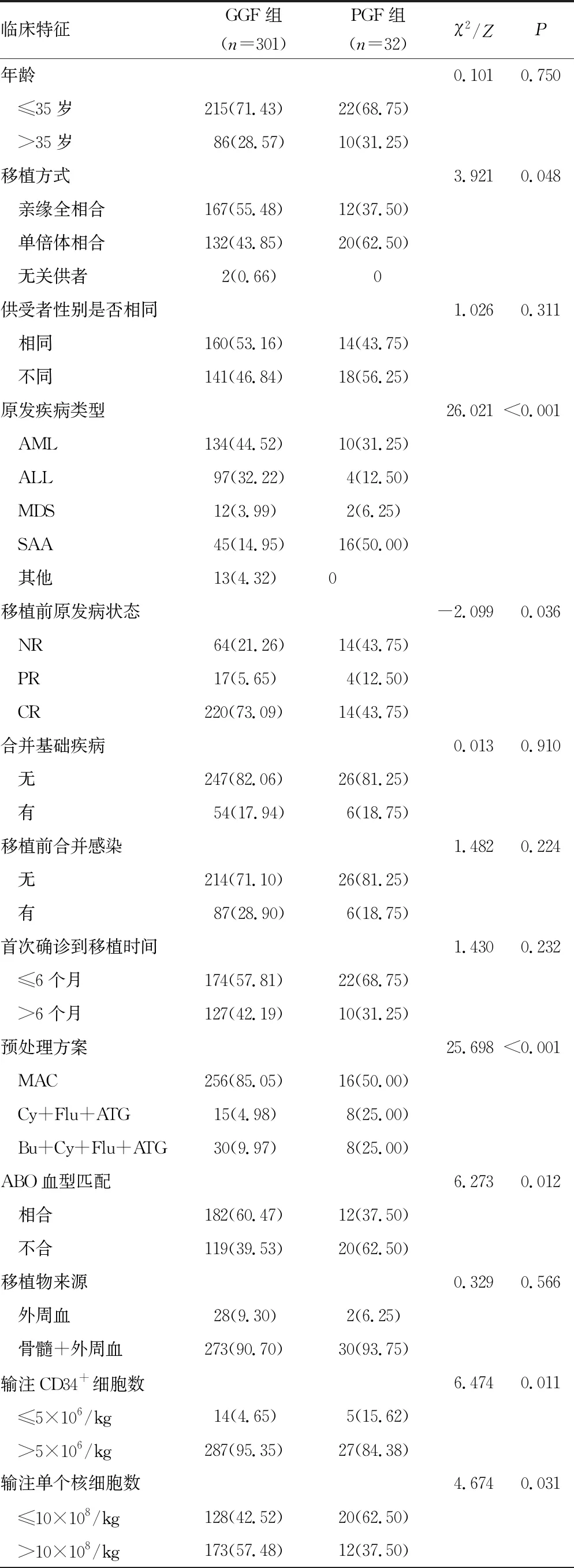
表1 PGF组与GGF组临床特征比较[n(%)]
2.2 PGF的危险因素分析
以上述差异有统计学意义的指标为自变量,以发生PGF为因变量进行logistic回归分析,logistic回归项目赋值见表2。单因素分析结果显示:单倍体相合移植、SAA、移植前疾病无缓解(NR)或部分缓解(PR)、Cy+Flu+ATG或Bu+Cy+Flu+ATG预处理方案、输注CD34+细胞数≤5×106/L,CMV感染(CMV-DNA>500 copies/mL)是PGF的危险因素(P<0.05)。进一步多因素分析显示:单倍体相合移植(OR=2.585,95%CI:1.163~5.742,P=0.020)、输注CD34+细胞数≤5×106/L(OR=2.330,95%CI:1.058~5.132,P=0.036)、CMV感染(OR=2.933,95%CI:1.292~5.623,P=0.010)为PGF的独立危险因素,见表3。
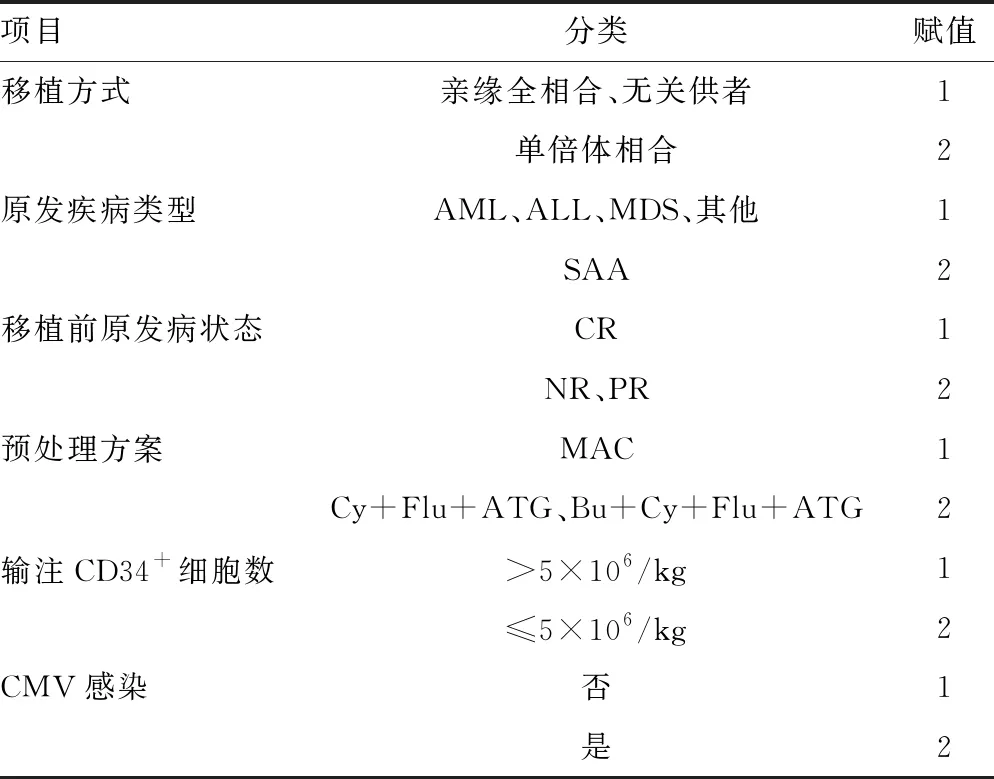
表2 logistic回归项目赋值
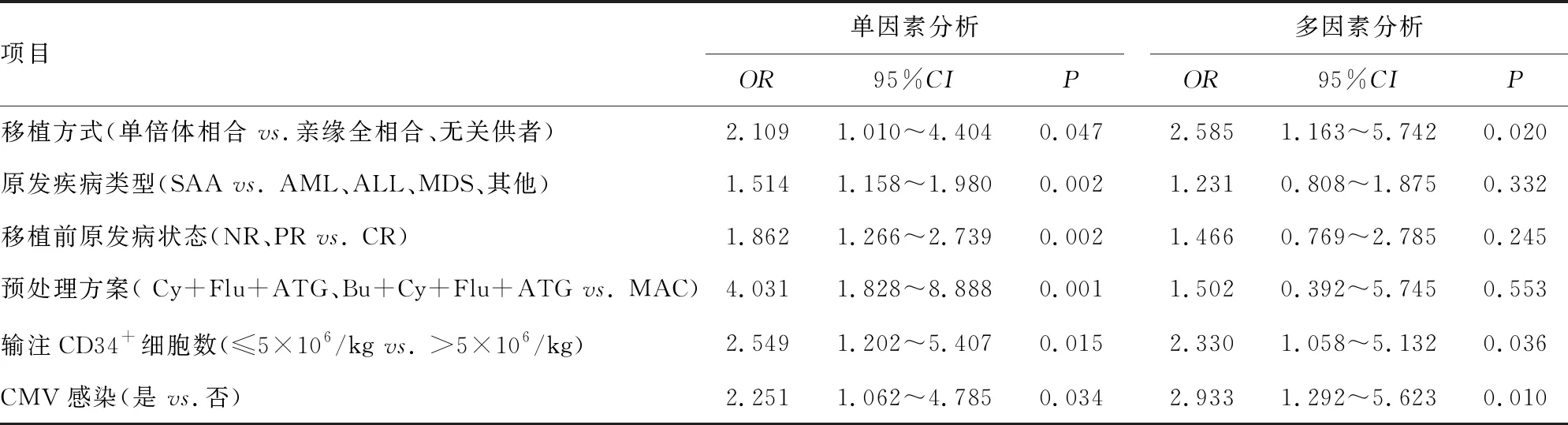
表3 logistic回归分析筛选PGF危险因素
2.3 PGF组和GGF组的生存分析
随访时间2~142个月,中位随访时间25个月,PGF患者3年OS率及PFS率分别为37.5%、25.0%,GGF患者3年OS率及PFS率分别为47.8%、36.8%,差异有统计学意义(χ2=6.269、4.275,P=0.012、0.031),见图1、表4。

A:3年OS;B:3年PFS。

表4 PGF组与GGF组3年OS和PFS分析
3 讨 论
allo-HSCT是使急性白血病、MDS、SAA和其他多种恶性血液病及难治性血液病患者取得长期存活的唯一方法[10],但因持续性的白细胞下降及血小板减少增加了感染和出血的风险,PGF可严重影响患者预后,缩短患者生存期。本研究PGF发生率为9.61%,生存分析显示PGF患者3年OS率(37.5%vs.47.8%)及3年PFS率(25.0%vs.36.8%)均明显低于GGF患者。另外,本研究还发现原发疾病为AML、ALL、MDS、SAA及其他的患者中,SAA患者的PGF发生率最高(26.23%)。单因素分析显示,SAA患者较AML、ALL、MDS及其他患者移植后更易发生PGF(OR=1.514,95%CI:1.158~1.980,P=0.002)。分析原因可能为:(1)病种不同,SAA作为一种骨髓衰竭性疾病,相较其他疾病更易出现植入相关并发症,PGF发生率可能更高。(2)SAA患者大量输血致移植前血清铁蛋白(serum ferritin,SF)水平升高进而铁过载。本研究因SF数据不完整,故影响因素分析中未涉及,但已有研究表明铁过载是allo-HSCT后PGF的独立危险因素[11]。(3)本研究中SAA患者预处理方案中均包括Flu+Cy,而据近期日本的一项研究表明,Flu+Cy方案被确定为再生障碍性贫血患者发生继发性PGF的独立危险因素(HR=6.12,95%CI:1.16~32.40,P=0.03)[12]。
以往大量研究尝试确定PGF的危险因素,报道较多的有HLA不匹配、ABO不相容、移植物CD34+细胞低数量、GVHD、CMV感染、铁过载、脾肿大、预处理方案的强度和骨髓毒性药物,如更昔洛韦的应用等[11,13],但其危险因素至今仍未完全阐明及确定。本文以过去在贵州医科大学附属医院接受allo-HSCT治疗者为研究对象,分为PGF组及GGF组,发现单倍体相合移植、输注CD34+细胞数低(≤5×106/kg)、CMV感染(CMV-DNA>500 copies/mL)与PGF的发生密切相关。
HLA全相合亲缘供者一般在allo-HSCT中被优先考虑,但是HLA全相合的亲缘供者和无关捐献者很少,在单倍体相合移植体系日臻完善和“北京方案”大力推广的情况下,让几乎所有人都能拥有移植供者[14]。尽管一般认为单倍体相合移植和亲缘全相合移植或无关供者移植在急性白血病及其他难治性血液病中效果相当[1,15],但是仍然存在一些单倍体相合移植后发生PGF的情况,严重影响患者长期存活[15-19]。LV等[19]的单中心回顾性研究表明,亲缘全相合移植、无关相合移植及单倍体相合移植继发性PGF发生率分别为3.4%、3.4%及10.1%(P<0.000 1);进一步的多因素分析表明,单倍体相合移植是继发性PGF的独立危险因素(单倍体相合移植vs.亲缘全相合移植:HR=2.525,P=0.004;单倍体相合移植vs.无关相合移植:HR=3.531,P=0.017)。CHEN等[20]对869例患者进行的病例对照研究显示,非亲缘全相合移植是原发性PGF的独立危险因素(OR=4.475,95%CI:1.289~12.537,P=0.018)。XIE等[21]的meta分析表明PGF发生与移植前患者体内存在供者特异性HLA抗体(donor specific anti-HLA antibody,DSA)有关,且这种相关性与研究区域、平均荧光强度(MFI)值、原发疾病等无关。与此同时,CHANG等[17]的前瞻性研究也显示,单倍体HSCT中原发性PGF和DSA存在密切关系。遗憾的是,本研究中DSA数据不完整,所以分析中未能涉及DSA,将在未来尝试完善DSA数据以进一步深入研究。
以往研究显示,造血干细胞与祖细胞构成的CD34+细胞为allo-HSCT术后造血及免疫重建所必需,供体细胞剂量越大,移植物衰竭的风险越小[22-23]。ZHAO等[8]提出CD34+细胞剂量<5×106/kg(OR=5.089,95%CI:1.745~14.841,P=0.003)可能是原发性PGF的独立危险因素。此外,有对继发性PGF进行的回顾性研究表明,低CD34+细胞剂量(HR=3.070,95%CI:1.207~7.813,P=0.019)是继发性PGF的独立危险因素[5]。与既往研究基本相符,本研究提示低CD34+细胞剂量(输注CD34+细胞数≤5×106/kg)是PGF的独立危险因素。尽管已有研究显示原发性PGF与继发性PGF的影响因素与机制有所不同[5-6],但是结合以上研究,推测低CD34+细胞剂量可能对原发性PGF和继发性PGF均有明显影响。因此,如何选择合适剂量以维持较好的疗效仍有待进一步探索。目前欧洲血液和骨髓移植学会推荐CD34+细胞数≥5×106/kg为最佳剂量。近数十年来,许多关于PGF治疗的研究主要集中在不经其他治疗而直接接受CD34+细胞输注。STASIA等[24]报道,41例PGF患者接受来自不同供体类型经G-CSF动员的CD34+细胞治疗后,总有效率为83%,三系恢复率为75%,各供体亚组之间不存在明显差异,这说明CD34+细胞对PGF具有良好的治疗作用。也有以儿童患者为对象进行的调查显示,CD34+细胞输注能改善患儿allo-HSCT后PGF的状况[25]。50例PGF患儿在接受CD34+细胞治疗8周后,中性粒细胞计数中位数明显升高(0.600×109/Lvs.1.516×109/L,P<0.05),尽管未发现与造血恢复相关的CD34+细胞剂量临界值,但可以肯定的是,CD34+细胞剂量高于3.25×106/kg可使中性粒细胞增加。与此同时,经CD34+细胞处理的PGF还降低了红细胞及血小板输注的需要量,最后78.8%的患儿1~2个细胞系得以恢复。可见,CD34+细胞输注是allo-HSCT术后PGF治疗的重要选择。
目前,国内外许多研究已证实CMV感染和PGF发病密切相关[5,26-27],且CMV感染倾向于是继发性PGF的独立危险因素而非原发性PGF的独立危险因素[5,8,19,27]。这可能与原发性PGF和继发性PGF的发病机制不同有关,原发性PGF的发生可能和免疫机制有关,而CMV则是通过直接感染和抑制骨髓基质细胞、造血祖细胞的功能[7],或间接通过使用预防、治疗CMV的药物如更昔洛韦、膦甲酸来抑制骨髓造血[5]。NAKAMAE等[23]对2 162例造血干细胞移植受者资料进行回顾性分析,结果表明受者CMV感染明显增加了移植28 d后细胞减少的危险。XIAO等[28]研究同样发现,CMV感染(OR=9.146,95%CI:1.513~55.276,P=0.016)使患者发生PGF的风险增加。ZHAO等[8]对原发性PGF危险因素进行研究,单因素分析表明CMV感染和原发性PGF发生有关,但进一步多因素分析表明其并非原发性PGF的独立危险因素。SUN等[5]研究表明,CMV再激活(HR=7.827,95%CI:2.002~30.602,P=0.003)是继发性PGF的独立危险因素。与既往报道一致,本研究单因素及多因素分析均显示移植后30 d内CMV感染与PGF的发生密切相关(OR=2.933,95%CI:1.292~5.623,P=0.010),但CMV感染是否是继发性PGF而非原发性PGF的独立危险因素有待进一步证实。由于CMV感染本身和更昔洛韦及其他抗病毒药物使用均可能使PGF发生率升高,故接受allo-HSCT的患者,特别是有CMV感染危险因素的患者,如移植前供受者CMV感染、移植后较重的GVHD、T淋巴细胞耗竭等,应预防性接受抗病毒治疗,并尽量避免使用更昔洛韦等骨髓抑制药物[26]。对此,新型抗病毒药物来特莫韦因其有效性及安全性(与较高的骨髓毒性或肾毒性事件发生率无关)已被批准用于HSCT后100 d内的CMV预防[29],这为临床上预防CMV感染进而预防PGF的发生提供了新的选择。
综上所述,本研究表明单倍体相合移植、输注CD34+细胞数低(≤5×106/kg)、移植后30 d内CMV感染(CMV-DNA>500拷贝/mL)与allo-HSCT后PGF的发生密切相关。SAA是PGF的危险因素,SAA患者较AML、ALL、MDS患者移植后更易发生PGF。由于PGF患者预后差,监测高危患者及早期制订预防策略则显得格外重要,如通过防止CMV感染、增加CD34+细胞输注剂量,可能预防PGF的发生,最终改善患者的生存期。

