腹腔镜结肠癌根治术治疗结肠癌的临床疗效分析
王珂,张波,周帅,杨莹,贺加星,贾国战,乔庆
空军军医大学唐都医院普外科,西安 710038
结肠癌病死率居所有恶性肿瘤第五位,发病率居所有恶性肿瘤第三位,仅次于肺癌、胃癌[1]。结肠癌常见于中老年人,但近几年青年患者逐渐增加[2]。手术治疗、生物治疗等是目前结肠癌的常用治疗手段。随着科技进步,微创技术应用于手术治疗中,其中,腹腔镜技术成为肿瘤治疗的趋势。邱福春等[3]的研究比较了腹腔镜结肠癌根治术与开腹结肠癌根治术治疗结肠癌的临床效果,结果显示,腹腔镜结肠癌根治术禁忌证少、适用范围广,且能减少腹腔损伤,维持机体内环境稳定。但临床对此仍有争议,部分学者认为腹腔镜结肠癌根治术不能作为结肠癌的常用治疗手段,并未有可靠研究证明其安全性及可行性,同时该手术对患者预后及肿瘤复发等的影响也需进一步研究证实[4]。本研究探讨腹腔镜结肠癌根治术治疗结肠癌的临床疗效,现报道如下。
1 资料与方法
1 一般资料
收集2019 年1 月至2022 年6 月空军军医大学唐都医院收治的行结肠癌根治术患者的病历资料。纳入标准:①符合《2021 年V2 版NCCN 结肠癌临床实践指南》[5]并确诊为结肠癌;②符合手术指征;③原发性肿瘤。排除标准:①体重指数>35 kg/m2;②合并其他严重肠道疾病;③依从性较差;④合并严重心血管疾病。根据纳入、排除标准,共纳入115 例结肠癌患者,按手术方法的不同分为观察组(n=59,腹腔镜结肠癌根治术)和对照组(n=56,开腹结肠癌根治术)。观察组中,男性27例,女性32 例;年龄40~71 岁,平均(56.97±6.45)岁;发病位置:降结肠9 例,升结肠13 例,横结肠15例,乙状结肠22 例;TNM 分期:Ⅰ期29 例,Ⅱ期17例,Ⅲ期13 例;分化程度:低分化腺癌31 例,中分化腺癌18 例,高分化腺癌10 例。对照组中,男性23 例,女性33 例;年龄42~75 岁,平均(58.03±5.12)岁;发病位置:降结肠4 例,升结肠11 例,横结肠17例,乙状结肠24 例;TNM 分期:Ⅰ期25 例,Ⅱ期16例,Ⅲ期15 例;分化程度:低分化腺癌33 例,中分化腺癌15 例,高分化腺癌8 例。两组患者各临床特征比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意。
1.2 手术方法
对照组行开腹结肠癌根治术,协助患者保持手术位,术前对患者行全身麻醉与气管插管,麻醉30 min 后找到腹部切点,由切点进刀切开15 cm 左右的切口,开腹后观察患者癌灶,根据其大小、形状、位置切除癌灶,清扫淋巴结后缝合切口,并对创面进行消毒清理。
观察组行腹腔镜结肠癌根治术,术前操作完成后,找到肚脐下方进针点,将穿刺针刺入腹腔,通过针管将CO2气体输入腹腔,并将腹压维持在11~12 mmHg(1 mmHg=0.133 kPa),以此建立人工气腹。分别在患者两侧上腹部穿刺放置6 mm 的套管针,同样将12 mm 套管针放置在患者两侧下腹部,将腹腔镜头等操作工具经套管置入腹腔内,通过腹腔镜查看患者腹腔内脏器情况,了解癌灶情况及其与周围脏器的关系,检查是否出现转移情况。将纱条扎进癌灶周围肠道,用超声刀将肠道表层系膜与腹膜切开,游离其血管至根部。对于横结肠与降结肠癌变患者,先将癌灶附着肠段向上提升,再游离血管,在患者腹部做5 cm 切口后将已分离的癌灶肠段局部拉出腹腔,并切除8~11 cm,用吻合器将肠段吻合处理,随后再放回腹腔。对于乙状结肠病变患者,先进行癌灶上端系膜的血管游离,在操作时需加强对输尿管的保护措施,避免损伤,在腹腔镜观察下操作分离直肠间隙至癌灶下端4~6 cm 处,再将肠段进行吻合,清扫淋巴结后使用0.9%生理盐水清洗腹腔,取出腹腔镜头,拔除导管,给予抗生素预防感染,缝合,创面消毒。
1.3 观察指标
1.3.1 疗效显效:术后血便、腹痛等症状消失,肠道功能恢复正常;有效:术后血便、腹痛等症状好转,肠道功能得到改善;无效:术后血便、腹痛等症状及肠道功能均无改善。总有效率=(有效+显效)例数/总例数×100%[6]。
1.3.2 免疫功能指标分别在术前、术后取患者外周静脉血3 ml,分离血清(2800 r/min 离心5 min),通过流式细胞仪检测CD3+、CD4+、CD8+及自然杀伤(natural killer,NK)细胞水平。
1.3.3 胃肠功能指标包括肠鸣音恢复时间、排气时间、排便时间、进食时间。
1.3.4 并发症包括切口感染、肠梗阻、吻合口漏等。
1.4 统计学方法
采用SPSS 21.0 统计软件进行数据分析,计数资料以例数及率(%)表示,组间比较采用χ2检验;符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 疗效的比较
观察组患者的总有效率为93.22%(55/59),明显高于对照组的75.00%(42/56),差异有统计学意义(χ2=7.225,P<0.01)。(表1)
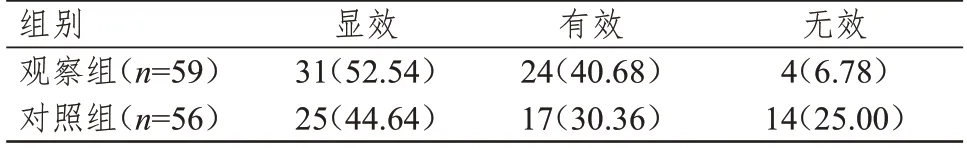
表1 两组患者的疗效[n(%)]
2.2 免疫功能指标的比较
术前,两组患者CD3+、CD4+、CD8+、NK 细胞水平比较,差异均无统计学意义(P>0.05);术后,两组患者CD3+、CD4+、NK 细胞水平均较术前升高,CD8+水平均较术前降低,且观察组患者CD3+、CD4+、NK 细胞水平均高于对照组,CD8+水平低于对照组,差异均有统计学意义(P<0.05)。(表2)
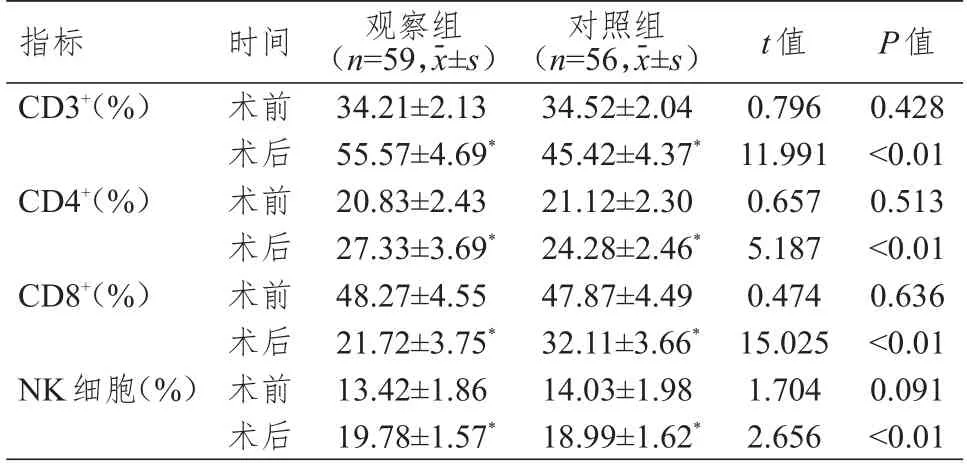
表2 手术前后两组患者免疫功能指标的比较
2.3 胃肠功能指标的比较
对照组患者术后肠鸣音恢复时间、排气时间、进食时间及排便时间均长于观察组,差异均有统计学意义(P<0.05)。(表3)
表3 两组患者胃肠功能指标的比较(h,±s)

表3 两组患者胃肠功能指标的比较(h,±s)
组别观察组(n=59)对照组(n=56)t值P值肠鸣音恢复时间20.49±3.56 31.75±3.41 17.304<0.01排气时间59.35±9.78 65.13±14.02 2.575 0.011进食时间57.61±11.73 64.03±12.94 2.790<0.01排便时间169.29±25.18 184.50±31.47 2.869<0.01
2.4 并发症发生情况的比较
观察组患者并发症总发生率为6.78%(4/59),明显低于对照组患者的46.43%(26/56),差异有统计学意义(χ2=18.550,P<0.01)。(表4)

表4 两组患者并发症发生情况[n(%)]
3 讨论
腹腔镜手术利用微创技术经管道将内窥镜置入机体内,再传影到显示屏上直观观察患者机体病变情况,在操作上同时利用了光子、电子及影像等技术[7]。
乐正宏等[8]在探究腹腔镜结肠癌根治术对比传统开腹手术的治疗效果时提到,行腹腔镜结肠癌根治术对患者机体的影响小于开腹手术,本研究结果与该观点相似。本研究结果显示,对照组患者并发症总发生率明显高于观察组,此结果证实腹腔镜结肠癌根治术可以减少对盆腔的损害,有效保护了盆腔内的自主神经[9-10]。由于腹腔镜具有创伤性小及干扰性小的优势,有效预防了感染,也降低了肠梗阻等发生率,加快了康复进程,提高了近期治疗效果[11-12]。另一方面有学者指出,腹腔镜手术与开腹手术的治疗原理一致,且治疗效果也无明显差异[13-14],该论点与本研究结果不一致。本研究结果显示,观察组患者总有效率明显高于对照组,可能原因为手术操作人员技术上的差异,或手术过程中淋巴结未完全清除。同样,开腹手术操作复杂,手术所需时间较长,可能导致患者机体其他功能受到影响[15]。本研究结果也表明,对照组患者术后肠鸣音恢复时间、排气时间、进食时间及排便时间均长于观察组。开腹手术创伤性大,容易损伤机体胃黏膜,从而降低胃肠功能,而腹腔镜手术利用微创技术,可有效降低对胃肠功能的损伤[16-17]。CD3+是仅存在于T 细胞表面且能识别抗原的分子,其主要作用于标记T 淋巴细胞。CD4+细胞可以直观反映免疫情况,可以作为肿瘤转移的参考指标。CD8+细胞具有协同受体的作用,也是一种免疫抑制细胞。NK 细胞作为机体抗肿瘤的免疫因素,其杀伤作用可以直接攻击靶细胞保护机体免疫力[18]。本研究结果显示,干预后,两组患者CD3+、CD4+、NK 细胞水平均较术前升高,CD8+水平均较术前降低,且观察组患者CD3+、CD4+、NK细胞水平均高于对照组,CD8+水平低于对照组,表明腹腔镜结肠癌根治术后机体内CD8+细胞减少,降低其免疫抑制效果,同时免疫细胞整体增多,可明显改善机体免疫功能,加强机体防御能力。
综上所述,腹腔镜结肠癌根治术治疗结肠癌患者,可提高临床疗效并改善患者免疫功能和胃肠功能,保障预后,推荐临床广泛应用。

